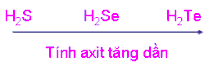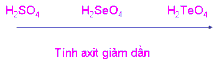- Tính chất và quy luật biến đổi tính chất của hợp chất với hiđro, hiđroxit.
2. Kỹ năng
- Viết được cấu hình lớp electron ngoài cùng dạng ô lượng tử của nguyên tử O, S, Se,Te ở trạng thái cơ bản và trạng thái kích thích.
- Dự đoán được tính chất hóa học cơ bản của nhóm oxi là tính oxi hóa dựa vào cấu hình lớp electron ngoài cùng và một số tính chất khác của nguyên tử.
- Viết được các phương trình hóa học chứng minh tính chất oxi hóa của các nguyên tố nhóm oxi, quy luật biến đổi tính chất của các nguyên tố trong nhóm.
3. Thái độ
- HS sẽ có được cái nhìn tổng quát về một vấn đề.
4. Trọng tâm
- Đặc điểm cấu tạo nguyên tử, liên kết hóa học phân tử nhóm oxi.
- Tính chất oxi hóa mạnh của các nguyên tố nhóm oxi.
II. CHUẨN BỊ
1. Giáo viên
- E-book.
2. Học sinh
- Ôn tập lại: Cấu tạo nguyên tử, liên kết hóa học, phản ứng oxi hóa – khử đã học ở HK1.
- Xem trước E-book, tìm hiểu trước nội dung bài học.
III. TỔ CHỨC HOẠT ĐỘNG DẠY HỌC
A. HOẠT ĐỘNG BAN ĐẦU
1. Ổn định tổ chức: Kiểm tra sĩ số, chia nhóm, phát phiếu học tập.
PHIẾU HỌC TẬP SỐ 1
I. Vị trí nhóm oxi trong BTH các nguyên tố Sử dụng BTH để trả lời các câu hỏi sau đây:
a) Nhóm oxi là nhóm mấy trong bảng tuần hoàn? Gồm mấy nguyên tố?
b) Tên và kí hiệu của các nguyên tố nhóm oxi? Xác định vị trí của các nguyên tố đó trong BTH.
c) Trạng thái tồn tại và mức độ phổ biến trong tự nhiên của các nguyên tố nhóm oxi.
Nhóm VIIA có tên gọi là halogen, thế bạn có biết nhóm VIA theo tiếng Hi Lạp còn được gọi là nhóm gì không?
PHIẾU HỌC TẬP SỐ 2
II. Cấu tạo nguyên tử của các nguyên tố nhóm oxi
Dựa vào kiến thức về cấu tạo nguyên tử và liên kết hóa học đã học ở học kỳ I, xem BTH để trả lời cho các câu hỏi sau đây:
1. Giống nhau giữa các nguyên tố trong nhóm
a) Viết cấu hình electron lớp ngoài cùng của các nguyên tử O, S, Se, Te.
b) Từ đó, rút ra nhận xét những điểm giống nhau về cấu tạo nguyên tử và tính chất các nguyên tố nhóm oxi:
- Số e lớp ngoài cùng → cấu hình e lớp ngoài cùng (khái quát).
- Khả năng cho- nhận e → dự đoán tính chất hóa học cơ bản của các nguyên tố nhóm oxi.
- Số e độc thân ở trạng thái cơ bản → số oxi hóa của các nguyên tố nhóm oxi trong hợp chất với nguyên tố có độ âm điện nhỏ hơn.
2. Khác nhau giữa oxi và các nguyên tố trong nhóm
a) Dựa vào sơ đồ hình 6.1 bên dưới → nhận xét sự khác nhau về phân lớp d và số e độc thân của các nguyên tử nguyên tố nhóm oxi ở trạng thái kích thích.
b) Cho biết số oxi hóa có thể có của các nguyên tố nhóm oxi trong hợp chất với nguyên tố có độ âm điện lớn hơn.
Hình 1: Sơ đồ phân bố e vào obitan ở trạng thái cơ bản và kích thích của
nguyên tử nguyên tố nhóm oxi
Ngoài số oxi hóa là -2, oxi còn có số oxi hóa nào khác trong hợp chất với nguyên tố có độ âm điện lớn hơn ? (ví dụ như:hợp chất với flo, hợp chất peoxit.)
PHIẾU HỌC TẬP SỐ 3
III. Tính chất của các nguyên tố trong nhóm oxi
Dựa vào giá trị độ âm điện, bán kính nguyên tử của các nguyên tố nhóm oxi (bảng 6.1), hãy rút ra nhận xét về:
1. Tính chất của đơn chất
a) Mức độ tính phi kim của các nguyên tố trong nhóm oxi ?
b) So sánh tính oxi hóa của các nguyên tố nhóm oxi với halogen trong cùng chu kỳ và sự biến đổi tính oxi hóa từ O→Te.
2. Tính chất của hợp chất
a) Cho biết công thức phân tử các hợp chất với hiđro, hợp chất hiđroxit của các nguyên tố nhóm oxi.
b) Căn cứ vào sự biến đổi bán kính nguyên tử, độ âm điện và quy luật biến đổi tính chất hợp chất theo nhóm A:
- Rút ra kết luận về sự biến thiên độ bền của các hợp chất với hiđro.
- So sánh tính axit của các hidroxit đó.
2. Kiểm tra bài cũ: Không kiểm tra
3. Tạo tình huống có vấn đề
Cùng nghiên cứu một nhóm các nguyên tố phi kim để so sánh với nhóm halogen.
B. HOẠT ĐỘNG DẠY HỌC
Hoạt động 1: Tìm hiểu về vị trí nhóm oxi trong BTH.
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 1. - Cho HS xem BTH trong quá trình thảo luận. - Tổng kết lại ý, cho HS chép bài. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | I. Vị trí nhóm oxi trong BTH các nguyên tố - Vị trí: nhóm VIA. - Nhóm oxi gồm 5 nguyên tố: oxi (O), lưu huỳnh (S), selen (Se), telu (Te), poloni (Po). - Poloni là nguyên tố kim loại, có tính phóng xạ. |
Có thể bạn quan tâm!
-
 Sử Dụng Phương Pháp Học Tập Theo Nhóm Nhỏ
Sử Dụng Phương Pháp Học Tập Theo Nhóm Nhỏ -
 Cửa Sổ Làm Việc Ps Vẽ Hình Elip
Cửa Sổ Làm Việc Ps Vẽ Hình Elip -
 Biểu Tượng Của Các Đối Tượng Dùng Cho Bài Kiểm Tra Trong Chế Độ Soạn Thảo Của Courselab
Biểu Tượng Của Các Đối Tượng Dùng Cho Bài Kiểm Tra Trong Chế Độ Soạn Thảo Của Courselab -
 Ổn Định Tổ Chức : Kiểm Tra Sĩ Số, Chia Nhóm, Phát Phiếu Học Tập.
Ổn Định Tổ Chức : Kiểm Tra Sĩ Số, Chia Nhóm, Phát Phiếu Học Tập. -
 Các Lớp Tham Gia Thực Nghiệm Và Đối Chứng
Các Lớp Tham Gia Thực Nghiệm Và Đối Chứng -
 Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 1
Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 1
Xem toàn bộ 149 trang tài liệu này.

Hoạt động 2: So sánh về cấu tạo nguyên tử của các nguyên tố nhóm oxi
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 2. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. | II. Cấu tạo nguyên tử của các nguyên tố nhóm oxi 1. Giống nhau - Cấu hình e lớp ngoài cùng: ns2np4 Có 6 e lớp ngoài cùng. |
- Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | Nhận 2e số oxi hóa -2 trong hợp chất. 2. Khác nhau - O không có phân lớp d. - S Te có phân lớp d trống ở trạng thái kích thích có 4 hoặc 6 e độc thân có số oxi hóa +4 và +6. |
Hoạt động 3: Nghiên cứu tính chất của các nguyên tố nhóm oxi
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 3. - Cho HS xem E- book trong quá trình thảo luận. - Tổng kết lại ý, cho HS chép bài. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | III. Tính chất của các nguyên tố trong nhóm oxi 1. Tính chất của đơn chất Tính phi kim mạnh, tính oxi hóa mạnh. + Chỉ yếu hơn các nguyên tố nhóm VIIA cùng chu kỳ. + Giảm dần từ oxi Telu. 2. Tính chất của hợp chất - Hợp chất với hidro:
- Hợp chất hidroxit:
|
C. HOẠT ĐỘNG KẾT THÚC TIẾT HỌC
1. Củng cố kiến thức
Dự đoán số oxi hoá của các nguyên tố nhóm oxi trong hợp chất. Giải thích.
2. Bài tập về nhà – Tìm hiểu
- Yêu cầu học sinh về nhà làm các bài tập trong E-book.
IV. RÚT KINH NGHIỆM TIẾT DẠY
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
..................................................................................................................................
2.6.2. Giáo án bài “Lưu huỳnh”
Bài 43: LƯU HUỲNH
I. MỤC TIÊU
1. Kiến thức
Biết được:
- Hai dạng thù hình phổ biến (tà phương, đơn tà), ảnh hưởng của nhiệt độ đối với cấu tạo và tính chất vật lí của lưu huỳnh.
- Ứng dụng và phương pháp sản xuất lưu huỳnh.
Hiểu được :
- Vị trí, cấu hình electron, lớp electron ngoài cùng, dạng ô lượng tử của nguyên tử lưu huỳnh của trạng thái cơ bản và trạng thái kích thích. Các số oxi hóa của lưu huỳnh.
- Tính chất hóa học: lưu huỳnh vừa có tính oxi hóa( tác dụng với kim loại, hiđro), vừa có tính khử (tác dụng với oxi hóa mạnh).
2. Kỹ năng
- Dự đoán tính chất, kiểm tra, kết luận được về tính chất hóa học của lưu huỳnh.
- Quan sát thí nghiệm, hình ảnh…rút ra được nhận xét về tính chất hóa học của lưu huỳnh.
- Viết phương trình hóa học chứng minh tính oxi hóa và tính khử của lưu huỳnh.
- Giải được một số bài tập: Tính khối lượng lưu huỳnh tham gia phản ứng và sản phẩm tương ứng; các bài tập tổng hợp có nội dung liên quan.
3. Thái độ
Rèn luyện cho HS:
- Đức tính cẩn thận, chính xác, say mê khoa học.
- Ý thức bảo vệ môi trường.
4. Trọng tâm
- Đặc điểm hai dạng thù hình của lưu huỳnh.
- Tính oxi hóa khử của lưu huỳnh.
II. CHUẨN BỊ
1. Giáo viên
- E-book.
2. Học sinh
- Cấu tạo nguyên tử, liên kết hóa học, phản ứng oxi hóa – khử, dạng thù hình.
- Kiến thức về bài “Khái quát nhóm oxi”
- Xem E-book, tìm hiểu trước nội dung bài học.
III. TỔ CHỨC HOẠT ĐỘNG DẠY HỌC
A. HOẠT ĐỘNG BAN ĐẦU
1. Ổn định tổ chức : Kiểm tra sỉ số, chia nhóm, phát phiếu học tập.
PHIẾU HỌC TẬP SỐ 1
I. Tính chất vật lí
1. Hai dạng thù hình của lưu huỳnh
Quan sát bột lưu huỳnh và tìm hiểu ebook, hãy cho biết tính chất vật lí của lưu huỳnh:
- Trạng thái, màu sắc, tính tan (trong nước, trong dung môi hữu cơ).
- Hai dạng thù hình của lưu huỳnh là gì? Cho biết sự giống và khác nhau về cấu tạo và tính chất giữa hai dạng thù hình.
2. Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí của lưu huỳnh
Quan sát hình ảnh (Sự biến đổi trạng thái lưu huỳnh theo nhiệt độ) và đoạn phim (Nung chảy bột lưu huỳnh), hãy nhận xét sự biến đổi trạng thái, màu sắc của S theo nhiệt độ.