PHIẾU HỌC TẬP SỐ 2
II. Tính chất hoá học
- Từ cấu hình e của nguyên tử S, nhận xét về số lớp e lớp ngoài cùng và số e độc thân ở trạng thái cơ bản và trạng thái kích thích.
- Suy ra các số oxi hoá có thể có của S trong các hợp chất. Trong hợp chất nào, S có số oxi hoá – (âm) và trong hợp chất nào S có số oxi hoá + (duơng)?
- Từ các số oxi hoá của S, dự đoán tính chất hoá học của đơn chất S. So sánh với đơn chất O2. Nêu các phản ứng hoá học chứng minh tính chất của S.
Những thí nghiệm chứng minh tính chất hoá học của lưu huỳnh.
Thí nghiệm 1: Khí H2 tác dụng với S
Thí nghiệm 2: Khí O2 tác dụng với S
Hãy quan sát thí nghiệm, nhận xét hiện tượng (nếu có thí nghiệm) và viết phương trình phản ứng, xác định vai trò của S và sự biến đổi số oxi hoá của S trong các phản ứng này, đọc tên của các sản phẩm tạo thành.
PHIẾU HỌC TẬP SỐ 3
III. Ứng dụng
Quan sát những hình ảnh trong E-book và qua thực tiễn, em hãy nêu một số ứng dụng của lưu huỳnh trong đời sống, trong công nghiệp mà em biết.
Em có biết cao su lưu hoá là gì không? Tại sao người ta phải lưu hoá cao su?
PHIẾU HỌC TẬP SỐ 4
IV. Sản xuất lưu huỳnh
1. Có thể khai thác lưu huỳnh từ những nguồn nguyên liệu nào?
2. Để khai thác lưu huỳnh tự do, người ta làm thế nào?
3. Nêu nguyên tắc và viết PTHH dùng để điều chế lưu huỳnh từ hợp chất. Phương pháp sản xuất S từ hợp chất ngoài tác dụng sản xuất S còn có ý nghĩa gì đối với việc bảo vệ môi trường sống của chúng ta?
2. Kiểm tra bài cũ : Không kiểm tra
3. Tạo tình huống có vấn đề
Lưu huỳnh có những dạng thù hình nào? Các dạng thù hình đó có gì giống nhau và khác nhau về tính chất vật lí và tính chất hóa học?
B. HOẠT ĐỘNG DẠY HỌC
Hoạt động 1: Nghiên cứu tính chất vật lí của S.
Hoạt động của HS | Nội dung kiến thức | ||||
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 1. - Cho HS xem E- book trong quá trình thảo luận. - Tổng kết lại ý, cho HS. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | I. Tính chất vật lí của S 1. Hai dạng thù hình của S - Là chất rắn màu vàng, giòn. - Không tan trong nước nhưng tan nhiều trong dung môi hữu cơ (rượu, benzen, …). - Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ). Khối lượng riêng : S> SĐộ bền : S< S t0 nc : S< S | |||
2. Ảnh hưởng của nhiệt độ đối với cấu tạo phân tử và tính chất vật lí củalưu huỳnh | |||||
Nhiệt độ | Trạng thái | Màu sắc | Cấu tạo phân tử | ||
< 113oC | rắn | vàng | S8, mạch vòng tinh thể Sα hoặc Sβ | ||
119oC | lỏng | vàng | S8 mạch vòng, linh động | ||
187oC | quánh, nhớt | nâu đỏ |
| ||
Có thể bạn quan tâm!
-
 Cửa Sổ Làm Việc Ps Vẽ Hình Elip
Cửa Sổ Làm Việc Ps Vẽ Hình Elip -
 Biểu Tượng Của Các Đối Tượng Dùng Cho Bài Kiểm Tra Trong Chế Độ Soạn Thảo Của Courselab
Biểu Tượng Của Các Đối Tượng Dùng Cho Bài Kiểm Tra Trong Chế Độ Soạn Thảo Của Courselab -
 Ổn Định Tổ Chức: Kiểm Tra Sĩ Số, Chia Nhóm, Phát Phiếu Học Tập.
Ổn Định Tổ Chức: Kiểm Tra Sĩ Số, Chia Nhóm, Phát Phiếu Học Tập. -
 Các Lớp Tham Gia Thực Nghiệm Và Đối Chứng
Các Lớp Tham Gia Thực Nghiệm Và Đối Chứng -
 Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 1
Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 1 -
 Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 2
Phân Phối Tần Số, Tần Suất Và Tần Suất Lũy Tích Bkt 2
Xem toàn bộ 149 trang tài liệu này.

445oC | hơi | da cam | S6; S4 | ||
1400oC | S2 | ||||
1700oC | S | ||||
Để đơn giản, người ta kí hiệu là S mà không dùng công thức phân tử S8 trong các phản ứng hóa học. | |||||
Hoạt động 2 : Tìm hiểu tính chất hóa học của S
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 2. - Cho HS xem E- book trong quá trình thảo luận. - Tổng kết lại ý, cho HS chép bài. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | II. Tính chất hóa học
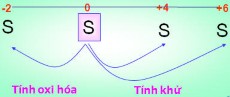
1. Tính oxi hóa a. Tác dụng với KL → muối sunfua 0 Al + S tAl2S3(Nhôm sunfua) 0 Fe + S tFeS (Sắt (II) sunfua) Hg + S HgS (Thủy ngân (II) sunfua) b. Tác dụng với H2 → Khí hidrosunfua 0 H2+ S tH2S Số Oxi hóa của S : 0 → -2. 2. Tính khử: Tác dụng với PK S + O2 → SO2 S + 3F2 → SF6 Số Oxi hóa của S : 0 → +4, +6. |
Hoạt động 3 : Tìm hiểu ứng dụng của S
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 3. - Cho HS xem E-book trong quá trình thảo luận. - Tổng kết lại ý, cho HS chép bài. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | III. Ứng dụng - 90% lượng lưu huỳnh khai thác được dùng để sản xuất H2SO4. - 10% lượng lưu huỳnh còn lại được dùng để lưu hóa cao su, sản xuất chất tẩy trắng bột giấy, diêm, chất dẻo ebonic, dược phẩm, phẩm nhuộm, chất trừ sâu, chất diệt nấm trong nông nghiệp... |
Hoạt động 4: Tìm hiểu phương pháp khai thác lưu huỳnh
Hoạt động của HS | Nội dung kiến thức | |
- Yêu cầu HS thực hiện thảo luận và trình bày các vấn đề trong phiếu học tập số 4. - Cho HS xem E-book trong quá trình thảo luận. - Tổng kết lại ý, cho HS chép bài. | Thực hiện thảo luận và ghi chép lại. - 1 nhóm trình bày trước lớp. - Các nhóm khác cho ý kiến. - Tổng hợp, ghi chép vào vở. | IV. Sản xuất lưu huỳnh 1. Khai thác lưu huỳnh : dùng để khai thác lưu huỳnh từ lòng đất (phương pháp Frasch). Nén nước siêu nóng (1700C) vào mỏ S dưới lòng đất để bơm S dưới lòng đất lên. 2. Phương pháp hóa học a) Đốt H2S trong điều kiện thiếu không khí 2H2S + O2 → 2S + 2H2O b) Dùng H2S khử SO2 2H2S + SO2 → 3S + 2H2O |
C. HOẠT ĐỘNG KẾT THÚC TIẾT HỌC
1. Củng cố kiến thức
- Cho học sinh tóm tắt những kiến thức cơ bản đã học trong bài.
2. Bài tập về nhà – Tìm hiểu
- Yêu cầu học sinh về nhà làm các bài tập trong E-book.
IV. RÚT KINH NGHIỆM TIẾT DẠY
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
.....................................................................................................................
2.6.3. Giáo án bài “Hiđro sunfua”
Bài 44: HIĐROSUNFUA
I. MỤC TIÊU
1. Kiến thức
Học sinh biết:
- Tính chất vật lí, trạng thái tự nhiên và điều chế của hidrosunfua.
- Tính axit yếu của axit sunfuhidric.
- Tính chất của các muối sunfua.
Học sinh hiểu:
- Cấu tạo phân tử, tính khử mạnh của H2S.
2. Kỹ năng
- Dự đoán, kiểm tra, kết luận được về tính chất hóa học của H2S.
- Viết phương trình hóa học minh họa tính chất của H2S.
- Phân biệt H2S với khí khác đã biết như khí oxi, hiđro, clo…
- Giải được bài tập: tính % thể tích hoặc khối lượng khí H2S trong hỗn hợp phản ứng hoặc sản phẩm; bài tập tổng hợp có nội dung liên quan.
3. Thái độ
Rèn luyện cho HS:
- Đức tính cẩn thận, chính xác, say mê khoa học.
- Ý thức bảo vệ môi trường, biết cách sử dụng hóa chất sao cho có lợi cho con người và không gây hại cho môi trường.
4. Trọng tâm: Tính axit yếu và tính khử mạnh của H2S.
II. CHUẨN BỊ
1. Giáo viên
- Giao E-book cho HS, hướng dẫn cách sử dụng.
2. Học sinh
- Xem E-book, tìm hiểu trước nội dung bài học.
III. TỔ CHỨC HOẠT ĐỘNG DẠY HỌC
A. HOẠT ĐỘNG BAN ĐẦU
1. Ổn định tổ chức : Kiểm tra sĩ số, chia nhóm, phát phiếu học tập.
PHIẾU HỌC TẬP SỐ 1
I. Cấu tạo phân tử
Căn cứ vào CTPT của H2S, cấu hình e ngoài cùng và độ âm điện của S, hãy:
- Viết CTCT của H2S. Giải thích liên kết hóa học trong phân tử H2S.
- Xác định số oxi hóa của S trong H2S.
PHIẾU HỌC TẬP SỐ 2
II. Tính chất vật lí
- Bằng kiến thức thực tế của mình, em hãy cho biết tính chất vật lý của hiđrosunfua. (Trạng thái, màu sắc, mùi vị, khả năng tan trong nước, nặng hơn hay nhẹ hơn không khí).
- Đọc thông tin sau và cho biết hidrosunfua có độc không?
Tháng 11 năm 1950, ở Mexico, một nhà mát ở Pozarica đã thải ra một lượng khí hidrosunfua, một hợp chất của lưu huỳnh với hidro. Chỉ trong vòng 30 phút chất khí đó cùng với sương mù trắng của thành phố đã làm chết 22 người và khiến 320 người bị nhiễm độc.
PHIẾU HỌC TẬP SỐ 3
III. Tính chất hóa học
Thí nghiệm 1: Thử tính chất của khí H2S bằng quỳ xanh ẩm
Khi tan trong nước, khí H2S tạo thành dung dịch gì? Độ mạnh yếu của axit này? So sánh với axit cacbonic.
Xét phản ứng giữa H2S và NaOH, cho biết khi nào tạo muối axit, khi nào tạo muối trung hòa?
Thí nghiệm 2: Khí H2S tác dụng với oxi Nhận xét hiện tượng trong 2 trường hợp:
+ Chặn miếng kính ngang ngọn lửa (thiếu oxi).
+ Không có miếng kính (dư oxi).
Từ đó nhận xét tính chất của H2S của thí nghiệm này. Vì sao H2S lại có tính chất đó? Viết phương trình minh họa, chú ý điều kiện phản ứng.
PHIẾU HỌC TẬP SỐ 4
IV. Trạng thái tự nhiên – Điều chế
1. Quan sát những hình ảnh trong E-book, hãy cho biết trạng thái tự nhiên của hidrosunfua.
2. Khí H2S là hóa chất độc hại đối với con người nên người ta không điều chế nó trong công nghiệp mà chỉ điều chế một lượng nhỏ trong PTN nhằm nghiên cứu tính chất lí hóa học của nó.
Hãy trình bày phương pháp hóa học điều chế H2S trong PTN.
PHIẾU HỌC TẬP SỐ 5
IV. Tính chất của muối sunfua
- Quan sát bảng tính tan của muối, nhận xét về tính tan của muối sunfua: những muối nào dễ tan, muối nào không tan, màu sắc?
- Rút ra cách nhận biết gốc sunfua.
2. Kiểm tra bài cũ
Nêu tính chất hóa học cơ bản của lưu huỳnh và minh họa bằng phương trình?
3. Tạo tình huống có vấn đề
Tại sao ở các cống rãnh, hay nơi rác thải công cộng,... thường hay có mùi thối? Mùi đó do khí gì gây ra là chủ yếu? Có độc hại không? Thì hôm nay chúng ta cùng xem xét đó là loại khí gì?