12)chroman. Theo tra cứu tài liệu của chúng tôi, chất 73 có cấu trúc tương tự - tocopherol, tuy nhiên đây là lần đầu tiên nó được tìm thấy trong thiên nhiên và là chất mới. Khi thử hoạt tính kháng oxy hóa thì chất 73 không có hoạt tính. Điều này có nghĩa là mạch nhánh của vitamin E (-tocopherol) đóng vai trò quan trọng đối với hoạt tính chống oxy hóa của vitamin E. Ngoài ra có thể nhóm hydroxy ở vị trí C6 nhân thơm của vitamin E ở dạng tự do cũng đóng vai trò quan trọng cho hoạt tính kháng oxy hóa.
Bảng 3.5. Phổ 1H- và 13C-NMR (CDCl3) của chất 73 (LHR.n2)
1H | 13C | Vị trí | 1H | 13C | |
2 | - | 76,16 | 2' | 1,35 m | 20,98 |
2- | 1,25 s | 24,25 | 3', 5', 6', 7', 9', | 32,36, 32,72, 32,89, 34,77, 37,40, | |
3 | 1,73 m | 3101 | 4' | 1,37 m | 32,72 |
4 | 2,72 m | 22,48 | 4'-CH3 | 0,84 d (5.9) | 19,66 |
4a | - | 120,97 | 8' | 1,37 m | 32,89 |
5 | 6,60 d | 119,05 | 8'-CH3 | 0,85 d (5.9) | 19,75 |
6 | - | 142,51 | 11' | 2,10 m | 41,48 |
7 | 6,66 d | 121,13 | 11'-CH3 | 1,00 d (6.8) | 19,93 |
8 | - | 127,31 | 12' | - | 149,82 |
8a | - | 150,37 | 12'a | 4,66 s | 109,22 |
8- | 2,13 s | 16,11 | 13' | 1,64 | 18,86 |
1' | 1,56 m | 40,25 | CH3CO | 2,24 s | 21,09 |
CH3CO | - | 170,21 |
Có thể bạn quan tâm!
-
 Số Liệu Phổ Của Các Chất Phân Lập Được Từ Cây Rau Má
Số Liệu Phổ Của Các Chất Phân Lập Được Từ Cây Rau Má -
![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 9](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 9
Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 9 -
 Xác Định Cấu Trúc Hóa Học Của Các Chất Phân Lập Được Từ Rễ Cây Cọ Hạ Long (Livistona Halongensis)
Xác Định Cấu Trúc Hóa Học Của Các Chất Phân Lập Được Từ Rễ Cây Cọ Hạ Long (Livistona Halongensis) -
 R ,3 R -3,7,3’-Trihydroxy-5’-Metoxyflavan 5- O - - D - Glucopyranosid
R ,3 R -3,7,3’-Trihydroxy-5’-Metoxyflavan 5- O - - D - Glucopyranosid -
 Nghiên Cứu Thành Phần Hóa Học Của Cây Rau Má
Nghiên Cứu Thành Phần Hóa Học Của Cây Rau Má -
![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 14](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 14
Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 14
Xem toàn bộ 129 trang tài liệu này.
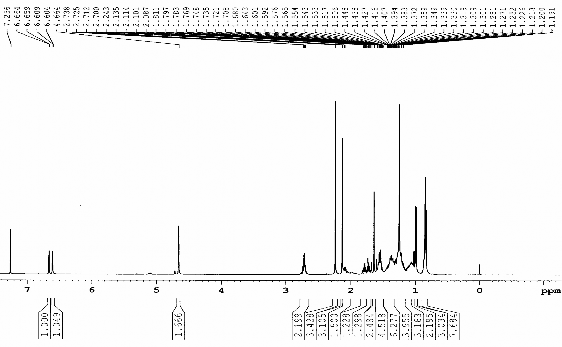
Hình 3.14. Phổ 1H-NMR (CDCl3, 500 MHz) của chất 73 (LHRn2)
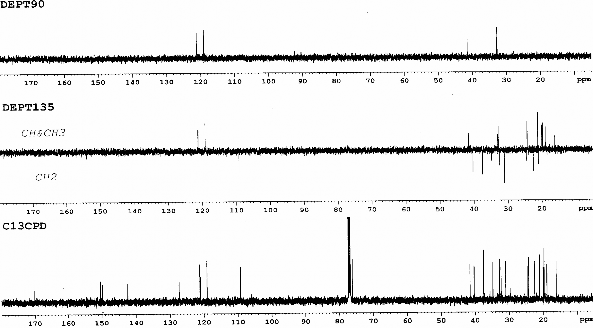
Hình 3.15. Phổ 13 C-NMR và phổ DEPT (CDCl3 ) của chất 73 (LHRn2)
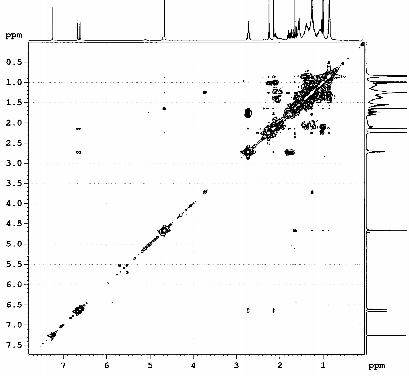
Hình 3.16. Phổ H-H-COSY của chất 73 (LHRn2)
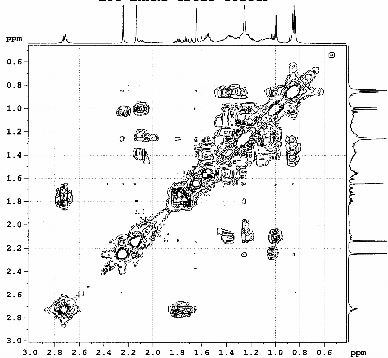
Hình 3.17. Phổ COSY- dãn rộng của chất 73 (LHRn2)
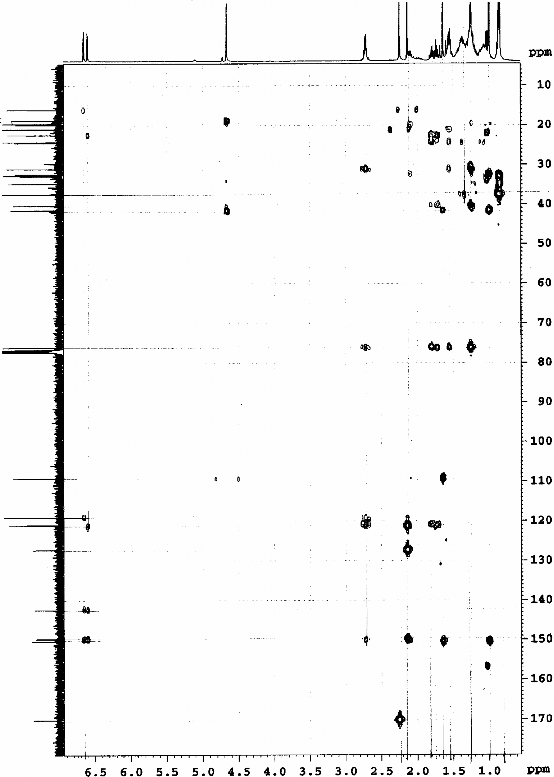
Hình 3.18. Phổ HMBC của chất 73 (LHRn2)
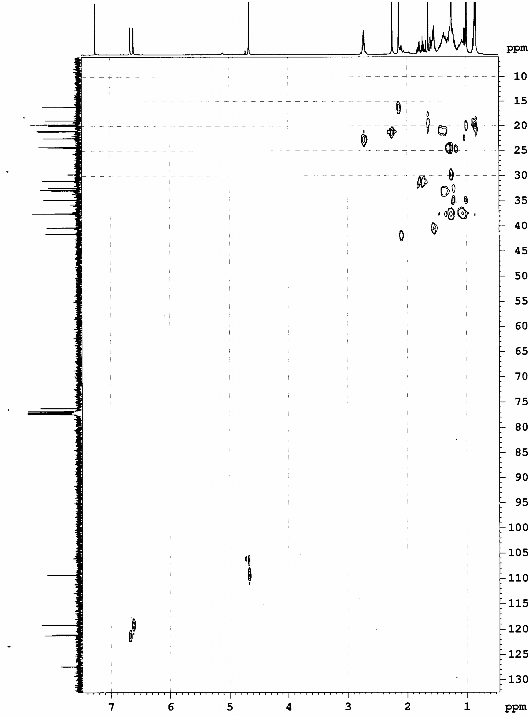
Hình 3.19. Phổ HSQC của chất 73 (LHRn2)
3.1.2.2. Chất 75 (LHRm1): 3,5,3’,5’-tetrahydroxy-4-metoxystilben
75: 3,5,3’,5’-tetrahydroxy-4-metoxystilben
-Phổ 1H-NMR (CDCl3, 500 MHz) (ppm), J (Hz) của chất 75 cho các tín hiệu của một nhóm methoxy ở δH 3,83 (3H, s) cùng với năm proton thơm và hai proton olefin ở vị trí trans tại δH 6,80 (1H, d, J = 16,2 Hz) và 6,85 (1H, d, J = 16,2 Hz). Các tín hiệu proton thơm thuộc hai vòng benzen, trong đó ba proton thuộc một vòng thơm bị thế ở vị trí C-3’ và C-5’ tại δH 6,20 (1H, t, J = 2,1, H-4’); 6,46 (2H, d, J = 2,1, H-2’, H-6’) và hai proton còn lại nằm ở vị trí meta đối với nhau trên vòng A δH 6,55 (2H, s, H-2, H-6). Phân tử của chất 75 có tính đối xứng cao.
- Phổ 13C NMR của chất 75 cho tín hiệu của 15 cacbon trong đó có 7 x CH, 1 x
OCH3 và 5 x Cq. Hai cacbon olefin xuất hiện ở δC 129,49 và 128,94 ppm. Các số liệu phổ cho thấy chất 75 có chứa khung stilben với 5 nhóm thế trong đó có 4 nhóm OH và một nhóm metoxy. Qua so sánh số liệu phổ với tài liệu tham khảo [73, 74], chứng tỏ chất 75 có công thức cấu tạo là 3,5,3’,5’-tetrahydroxy-4- metoxystilben.
Từ các số liệu ESI-MS, phổ hồng ngoại, phổ 1H-NMR, 13C-NMR, so sánh với tài
liệu tham khảo, chúng tôi xác định được cấu trúc của chất 75 như trên.
3.1.2.3. Chất 76 (LHRm2): 2S,3S-3,5,7,3’-tetrahydroxy-5’-metoxyflavan
76: 2S,3S-3,5,7,3’-tetrahydroxy-5’-metoxyflavan
- Công thức phân tử của 76 là C16H16O6 được xác định qua pic ion ở m/z 303 [M- H]- (ion âm) và 327 [M+Na]+ (ion dương) trong phổ ESI-MS. Để khẳng định cấu
trúc của chất 76, chúng tôi đã axetyl hóa chất 76 tạo dẫn xuất tetraaxetyl 80 của nó. Phổ HR-ESI MS của chất 80 có pic ion ở m/z 494,93860 ( tính toán cho C24H24NaO10 là 495,12972). Từ đó khẳng định chắc chắn công thức phân tử của chất 76 là C16H16O6.
- Phổ 1H-NMR của 76 có singlet ở H 3,87 (C 56,5) chứng tỏ chất 76 có một
nhóm metoxy. Phía trường thấp có các tín hiệu singlet ở H 6,93 (2H, H-2’ , H- 6’) và 7,02 (1H, H-4’) đặc trưng cho sự có mặt của nhân phenyl có nhóm thế ở C- 1, C-3, C-5 [74]. Tương tác HMBC của C-1’ (C 133,7) với H-2’/ H-6’ và H-2
khẳng định được 2 nhóm thế ở C-3’ và C-5’. Cặp doublet có hằng số tương tác
meta (J = 2,2 Hz) ở H 5,97 và 5,95 cho thấy vòng A có 2 nhóm thế ở C-5 và C-7. Tín hiệu của 2 nhóm oxymetin ở H 4,88 (H-2), 4,21 (H-3) và cặp doublet kép ở
H 2,89 và 2,77 đặc trưng cho khung 3 hydroxyflavan. Tương tác của proton của nhóm methoxy với C-5’ (C 148,5) cho biết nhóm này gắn với C-5’. Phân tích đầy đủ tương tác trực tiếp trong phổ HSQC và tương tác qua 2 hoặc 3 liên kết trong
25
phổ HMBC cho phép kết luận cấu trúc của chất 76 là 3,5,7,3’-tetrahydroxy-5’- metoxyflavan. Hằng số tương tác bé của H-2 và H-3 cho biết 2 proton này ở vị trí cis với nhau, như vậy chất 76 sẽ có cấu hình tương đối là (2R, 3R) hoặc (2S, 3S). Chất 76 có năng suất quay cực [α]D = +2,7 ( c = 2,84, MeOH) so sánh với tài liệu [17, 75] gợi ý cho biết cấu hình của chất 76 là 2S, 3S. Bằng kết hợp số liệu phổ phân tích ở trên đã xác định được cấu trúc của 76 là: 2S,3S-3,5,7,3’- tetrahydroxy- 5’- metoxyflavan. Đây là một chất mới, lần đầu tiên tìm thấy trong thiên nhiên. Dẫn xuất 2S,3S-3,5,7,3’,5’-pentahydroxyflavan đã được phân lập từ cây Humboldia laurifolia [75].
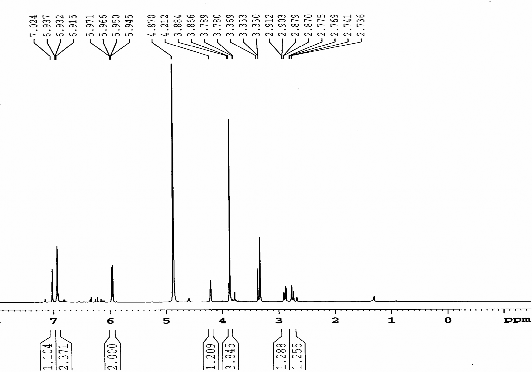
Hình 3.20 . Phổ 1H-NMR (MeOD, 500 MHz) của chất 76 (LHRm2)


![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 9](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-cau-truc-va-hoat-tinh-sinh-hoc-mot-so-hop-chat-phan-lap-tu-cay-9-1-120x90.png)



![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 14](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-cau-truc-va-hoat-tinh-sinh-hoc-mot-so-hop-chat-phan-lap-tu-cay-14-120x90.jpg)