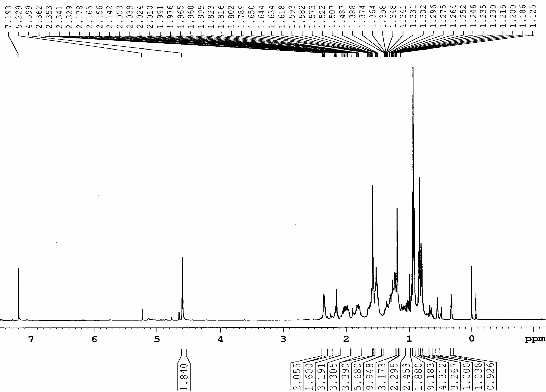
Hình 3.3. Phổ 1H-NMR (CDCl3, 500 MHz) của chất 67 (Cyclomusalenon)
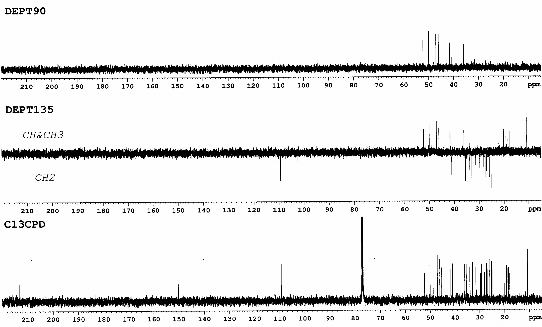
Hình 3.4. Phổ 13C-NMR và phổ DEPT của chất 67 (Cyclomusalenon)
3.1.1.2. Chất 68 (LHVn5a): Cycloleucadenon.
- Phổ hồng ngoại của chất 68 cho các tín hiệu hấp thụ của nhóm cyclopropyl
ở 3030cm-1, nhóm =CH2 ở 3072; 890 cm-1 và của nhóm carbonyl ở 1715 cm-1
-Phù hợp với phổ hồng ngoại, phổ 1H-NMR của 68 cho các tín hiệu cộng hưởng đặc trưng cho vòng cyclopropan tại = 0,566 (1H, d, J= 3,9 Hz, H- 19A), 0,791 (1H, br s, H-19B), 4,66 (2H, m, =CH2) và tín hiệu của 7 nhóm methyl trong đó có hai tín hiệu methyl doublet.
- Phổ 13C-NMR và phổ DEPT của chất 68 cho thấy có tín hiệu của 31
nguyên tử carbon, trong đó có 7 nhóm CH3, 12 nhóm CH2, 5 nhóm CH và 7 carbon bậc 4. Từ các số liệu phổ thu được cho thấy 68 và 67 là hai chất có cùng một cấu trúc khung, tuy vậy 68 có nhiều hơn một nhóm CH3. Điều này cũng được khẳng định thêm qua phổ ESI-MS phân giải cao với pic ion giả phân tử tại m/z =439,39012 (C31H51O) [M+H]+. Như vậy chất 68 có công thức phân tử là C31H50O (M= 438).
So sánh các dữ liệu của phổ 1H- và 13C-NMR của chất 68 với phổ của cycloleucadenone được ghi trong cùng dung môi [56] cho thấy chúng hoàn toàn giống nhau. Vậy có thể kết luận, chất 68 chính là cycloleucadenon. Từ lá cây Tillandsia fasciculata, năm 2001, người ta đã phân lập được cycloleucadenon [56] và đây là lần đầu tiên chất này được phân lập từ chi Cọ thuộc họ Cau.
Bảng 3.2. Số liệu phổ 1H- và 13C-NMR (CDCl3) của hợp chất 68 và cycloleucadenon
Chất 68 | Cycloleucadenon [56] | |||
C | C | H (J=Hz) | C | H (J=Hz) |
1 | 33,4 | 33,4 | ||
2 | 37,5 | 2,30(1H, ddd, J=2,6, 14,0 Hz, H-2A) 2,70(1H, dt, J=6,4, 14,0 Hz, H-2B) | 37,5 | 2,30 (1H, ddd, J= 14,0, 4,5, 2,5 Hz, H-2A) 2,70(1H, dt, J= 14,0, 6,5 Hz, H-2B) |
3 | 216,5 | 216,6 | ||
4 | 50,2 | 50,2 | ||
5 | 48,5 | 48,4 | ||
6 | 21,5 | 21,5 | ||
7 | 28,4 | 28,1 | ||
8 | 47,9 | 47,9 | ||
9 | 21,1 | 21,1 | ||
10 | 26,0 | 26,0 | ||
11 | 26,8 | 26,8 | ||
12 | 32,8 | 32,8 | ||
13 | 48,8 | 48,7 | ||
14 | 45,3 | 45,3 | ||
15 | 35,6 | 35,6 | ||
16 | 25,8 | 25,9 | ||
17 | 52,3 | 52,3 | ||
18 | 18,0 | 0,99 (3H, s, CH3-18) | 18,0 | 0,99 (3H, s, H-18) |
19 | 29,6 | 0,566 (1H, d, J= 3,9 Hz, H-19A) 0,791 (1H, br.s, H-19B) | 29,6 | 0,56 (1H, d, J= 4,5 Hz, H-19A) 0,78 (1H, d, J= 4,5 Hz,, H-19B) |
20 | 36,0 | 36,0 | ||
21 | 18,4 | 0,88 ( 3H, d, J=7,1 Hz, CH3-21) | 18,3 | 0,87 ( 3H, d, J=6,5 Hz, H-21) |
22 | 33,9 | 33,9 | ||
23 | 31,5 | 31,5 | ||
24 | 41,6 | 41,6 | ||
25 | 150,2 | 150,2 | ||
26 | 109,4 | 4,67 (br.s, H2 -26) | 109.4 | 4,67(2H, m, H -26) |
27 | 18,7 | 1,64 ( 3H, t, J = 4,1 Hz, CH3-27 ) | 18,7 | 1,64( 3H, brs, H-27 ) |
28 | 20,2 | 1,05( 3H, s, CH3-30 ) | 20,1 | 1,05 ( 3H, s, H-28 ) |
29 | 19,3 | 1,10 ( 3H, s, CH3-29 ) | 19,3 | 1,10 ( 3H, s, H-29 ) |
30 | 22,2 | 0,91 ( 3H, s, CH3-29 ) | 22,2 | 0,90 ( 3H, s, H-30 ) |
31 | 20,7 | 0,92 ( 3H, d, J = 6,2 Hz, CH3-31 ) | 20,8 |
Có thể bạn quan tâm!
-
 Tách Và Tinh Chế Các Chất Trong Rễ Cây Cọ Hạ Long (Theo Sơ Đồ 2.2)
Tách Và Tinh Chế Các Chất Trong Rễ Cây Cọ Hạ Long (Theo Sơ Đồ 2.2) -
 Β -Sitosterol-3- O- Β –D -Glucopyranosid ( Β -Sitosterol Glucosid), (Lhrm3)
Β -Sitosterol-3- O- Β –D -Glucopyranosid ( Β -Sitosterol Glucosid), (Lhrm3) -
 Số Liệu Phổ Của Các Chất Phân Lập Được Từ Cây Rau Má
Số Liệu Phổ Của Các Chất Phân Lập Được Từ Cây Rau Má -
 Xác Định Cấu Trúc Hóa Học Của Các Chất Phân Lập Được Từ Rễ Cây Cọ Hạ Long (Livistona Halongensis)
Xác Định Cấu Trúc Hóa Học Của Các Chất Phân Lập Được Từ Rễ Cây Cọ Hạ Long (Livistona Halongensis) -
![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 11](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 11
Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 11 -
 R ,3 R -3,7,3’-Trihydroxy-5’-Metoxyflavan 5- O - - D - Glucopyranosid
R ,3 R -3,7,3’-Trihydroxy-5’-Metoxyflavan 5- O - - D - Glucopyranosid
Xem toàn bộ 129 trang tài liệu này.
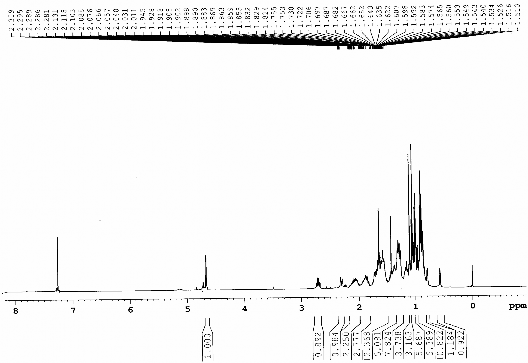
Hình 3.5. Phổ 1H-NMR (CDCl3, 500 MHz) của chất 68 (Cyclolaucadenon)
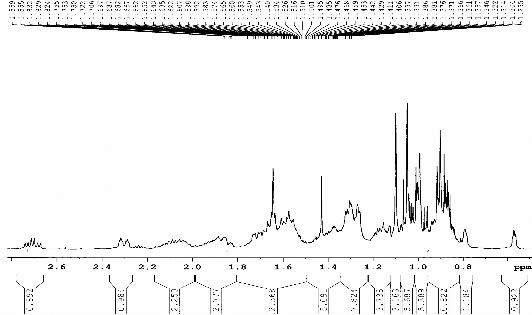
Hình 3.6. Phổ 1H-NMR dãn rộng (CDCl3, 500 MHz) của chất 68
(Cyclolaucadenon)
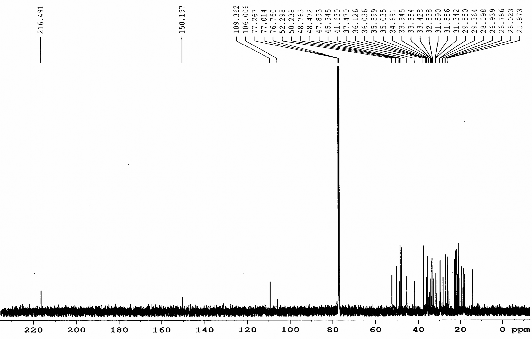
Hình 3.7. Phổ 13C-NMR (CDCl3, 125 MHz) của chất 68 (Cyclolaucadenon)
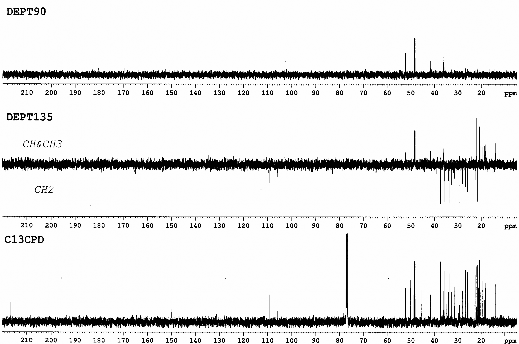
Hình 3.8. Phổ 13C-NMR và phổ DEPT của chất 68 (Cyclolaucadenon)
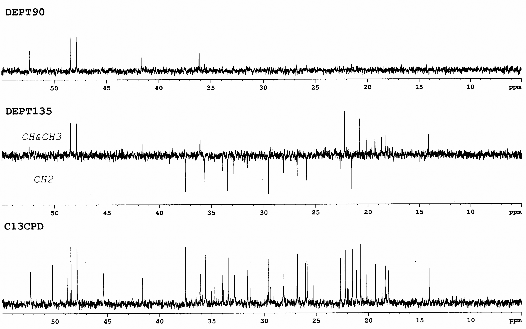
Hình 3.9. Phổ 13C-NMR và phổ DEPT dãn rộng của chất 68
(Cyclolaucadenon)
3.1.1.3. Chất 69 (LHVn4): 3β- Cyclomusalenol .
- Phổ hồng ngoại của chất 69 cho đỉnh hấp thụ đặc trưng của nhóm hydroxyl (3341 cm-1), nhóm =CH2 (3076 và 887 cm-1), nhóm cyclopropyl (3030cm-1).
- Phổ 1H- và 13C-NMR của chất 69 gợi ý chất 69 có cùng khung carbon với
chất 67. Sự có mặt của nhóm isopropenyl thể hiện qua các tín hiệu ở: H =
4,66 (2H, s) và C = 109,3 (t) và 150,2 ppm (s). So với phổ của chất 67 thì phổ của chất 69 không chứa nhóm carbonyl ở vị trí C-3 mà chứa nhóm hydroxyl [H: 3,20 (1H, dt, J=10,9, 4,8 Hz, H-3α, C: 77,0 (d), C-3]. Nhóm
hydroxyl ở C-3 được xác định là ở vị trí β (3β-OH) dựa vào sự tách vạch của
tín hiệu của H-3 là một dt. Trong trường hợp 3α-OH thì tín hiệu của H-3 sẽ là một singlet (s).
- Phổ 13C-NMR và phổ DEPT của chất 69 cho thấy có tín hiệu của 30 nguyên
tử carbon, trong đó có 6 nhóm CH3, 12 nhóm CH2, 7 nhóm CH và 5 carbon bậc 4.
- Phổ khối phân giải cao (HR-ESI-MS) cho pic ion giả phân tử tại m/z = 427,36355 phù hợp với công thức phân tử là (C30H51O) [M+H]+. Như vậy công thức phân tử của chất 69 sẽ là C30H50O.
Từ các số liệu phổ ở trên, kết hợp so sánh với số liệu phổ 1H-NMR của 3β- Cyclomusalenol phân lập được từ cây chuối hột (Musa balbisiana colla) [61], có thể kết luận chất 69 là 3β-cyclomusalenol [(24S),14α, 24-dimetyl- 9β,19-cyclo-5α-cholest-25-en- 3β-ol]. Chất 69 đã được tách từ cây chuối tiêu (Musa sapientum) [57, 58]. Ngoài ra, Hiroyuki và cộng sự đã thông báo có tìm thấy 3β-cyclomusalenol từ rễ của ba loài dương xỉ tại Nhật Bản [59]. Và nhóm tác giả này đã phân lập được 3β-cyclomusalenol dưới dạng acetat từ rễ của hai loài dương xỉ: Polypodium formosanum và Polypodium niponicum [60]. Nhưng đây là lần đầu tiên chất 69 được phân lập từ chi Cọ thuộc họ Cau. Để khẳng định thêm cấu trúc của chất 69 chúng tôi tiến hành khử hóa chất 67 với NaBH4 trong metanol. Sau khi tách, tinh chế sản phẩm phản ứng bằng sắc ký cột chúng tôi thu được chất 69 và đồng phân 3α-OH của nó (3-
epi-cyclomusalenol) với tỉ lệ 3:1 [61, 62]. Số liệu phổ 1H- và 13C-NMR của
sản phẩm chính khi khử hóa chất 67 so với phổ của chất 69 (bảng 3.2) tách từ vỏ cây cọ hạ long là hoàn toàn đồng nhất.
Bảng 3.3. Số liệu phổ 1H- và 13C-NMR (CDCl3) của hợp chất 69, 3β – cyclomusalenol và 3-epicyclomusalenol
Chất 69 | 3β -cyclomusalenol [61] | 3-epicyclomusalenol [63] | |||
C | C | H (J=Hz) | H (J=Hz) | C | H (J=Hz) |
1 | 26,8 | 27,2 | |||
2 | 33,0 | 34,8 | |||
3 | 72,3 | 3,2(1H, dt, J=10,9, 4,8 Hz, H-3α) | 3,21 m (H-3α) | 76,6 | 3,21(1H, m, H-3β) |
4 | 41,0 | 43,4 | |||
5 | 37,9 | 44,6 | |||
6 | 24,5 | 24,7 | |||
7 | 24,8 | 25,2 | |||
8 | 46,9 | 46,9 | |||
9 | 23,2 | 23,6 | |||
10 | 30,2 | 29,6 | |||
11 | 26,9 | 27,0 | |||
12 | 32,9 | 32,9 | |||
13 | 45,3 | 46,7 | |||
14 | 49,0 | 48,9 | |||
15 | 35,3 | 35,3 | |||
16 | 28,0 | 28,0 | |||
17 | 52,2 | 52,2 | |||
18 | 17,7 | 0,883 (3H, s) | 0,96 s | 17,7 | 0,96(3H, s) |
19 | 26,2 | 0,137 (1H, d, J= 3,9 Hz, H-19A) 0,53 (1H, br.d, J= 3,9Hz, H-19B) | 0,39 d, (3,9) 0,59 m | 29,7 | 0,595(1H, d, J=4,0) 0,397(1H,br.d,J=3,7) |
20 | 36,1 | 36,0 | |||
21 | 18,4 | 0,86( 3H, d, J=6,4 Hz) | 0,86 d, (6,5) | 18,4 | 0,86(3H, d, J=6,4) |
22 | 33,9 | 33,9 | |||
23 | 31,5 | 31,5 | |||
24 | 41,6 | 41,6 | |||
25 | 150, | 150,2 | |||
26 | 109, | 4,67(2H, s) | 4,67 d, (1,3) | 109,3 | 4,66(2H, s) |
27 | 18,6 | 1,64( 3H, s) | 1,64 s | 18,7 | 1,640( 3H, s) |
28 | 20,2 | 0,998 (3H, d, J=6,9 Hz) | 1,00 d (6,6) | 20,1 | 0,998(3H,d, J=6,9) |
29 | 19,1 | 0,986 (3H, s) | 0,90 s | 19,1 | 0,987 (3H, s) |
30 | 15,5 | 0,968 (3H, d, J=6,2 Hz) | 14,4 | 0,970(3H, d, J=6,4) |





![Nghiên cứu cấu trúc và hoạt tính sinh học một số hợp chất phân lập từ cây cọ hạ long (Livistona halongensis T.H. Nguyen & Kiew) và cây rau má [Centella asiatica(Linn.) Urban] - 11](https://tailieuthamkhao.com/uploads/2022/05/09/nghien-cuu-cau-truc-va-hoat-tinh-sinh-hoc-mot-so-hop-chat-phan-lap-tu-cay-11-1-120x90.png)
