quang sinh). Các lỗ trống quang sinh sẽ phản ứng với OH- hay H2O để tạo ra gốc tự do mà nó có thể oxy hoá phẩm nhuộm, trong khi đó các điện tử quang sinh cũng có thể phản ứng với các phân tử oxy hấp phụ trên bề mặt để tạo ra các dạng oxygen oxy hoá. Với xúc tác La - ZnO, có thể có một quá trình cạnh tranh xảy ra (sơ đồ 3.5) giữa phản ứng quang hoá bề mặt đã đề cập ở trên và quá trình dịch chuyển ra các điện tử và lỗ trống quang sinh của La2O3 đến ZnO do năng lượng vùng dẫn của ZnO thấp hơn của La2O3.
Cơ chế xúc tác dị thể của ZnO đã được nghiên cứu [110] theo những bước như sau:
Trong điều kiện bức xạ UV:
ZnO hhe(3.17)
e
O
cb 2
vb cb
2
O
(3.18)
hLa OH LaOH
vb
LaOH MB LaOH MB
Trong điều kiện bức xạ khả kiến:
(3.19)
(3.20)
MB h
MB*
(3.21)
cb
2
MB* ZnO eMB(3.22)
e
O
cb 2
O
(3.23)
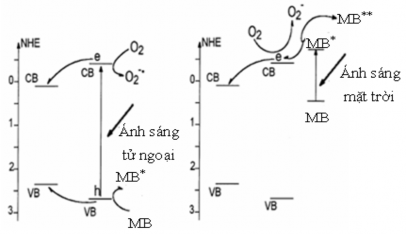
Sơ đồ 3.5. Minh hoạ cơ chế xúc tác quang hoá cuả ZnO và La-ZnO [110]
Với sự tăng nồng độ pha tạp La3+, hàng rào bề mặt (surface barrier) trở nên cao hơn và khu vực tích điện không gian (space charge region) trở nên hẹp hơn nên cặp điện tử và lỗ trống quang sinh được tách rời một cách có hiệu quả bởi trường điện tích lớn điều này giải thích cho hoạt tính quang hoá tăng từ mẫu LZ15 đến LZ1. Mặt khác, với sự tăng nồng độ La3+ thì độ sâu thẩm thấu của ánh sáng vào trong ZnO sẽ vượt quá
lớp tích điện không gian [110]. Vì thế sự tái kết hợp cặp điện tử-lỗ trống quang sinh trở nên dễ dàng hơn dẫn đến hoạt tính quang hoá giảm ở các mẫu LZ13 và LZ14. Vì thế nồng độ La3+ tối ưu được đòi hỏi để có sự phù hợp của độ dày lớp tích điện và độ sâu của thẩm thấu ánh sáng cho việc phân tách cặp điện tử - lỗ trống quang sinh [9]. Ngoài ra, Khatamian và cộng sự [74] cho rằng, hàm lượng La trong ZnO thích hợp là cần
thiết tạo ra hiệu điện thế đáng kể giữa bề mặt và tâm hạt bán dẫn để phân tách có hiệu quả cặp điện tử-lỗ trống quang sinh bởi vì sự quá nhiều La2O3 sẽ bao phủ bề mặt ZnO có thể gia tăng số tâm tái kết hợp. Điều này có thể nhìn thấy trong nghiên cứu này khi tỉ lệ mol La/Zn > 0,047, hoạt tính xúc tác quang hoá giảm rất nhanh.
Với điểm đẳng điện của La - ZnO bằng 7 [74], bề mặt của La - ZnO sẽ tích điện âm khi pH > 7 và tích điện dương khi pH < 7, giải thích cho kết quả sự gia tăng hấp phụ của phân tử MB (tích điện âm) trên bề mặt La - ZnO. Tại pH thấp với sự tích điện dương của bề mặt có thể hạn chế sự cung cấp ion hydroxyl cần cho việc tạo thành gốc tự do. Nói cách khác, pH càng cao thì càng có thể tạo ra nồng độ ion hydroxyl cao để phản ứng lỗ trống tạo thành gốc hydroxyl [14], nhưng sự phân huỷ quang hoá cũng bị ức chế khi pH trong khoảng quá cao bởi vì ion hydroxyl cạnh tranh với phân tử MB trong sự hấp phụ trên bề mặt quang xúc tác [133, 164]. Tuy nhiên, ở pH thấp sự hấp phụ phẩm nhuộm cation trên bề mặt xúc tác tăng, bởi vì bề mặt xúc tác sẽ chuyển về điện tích dương và hút các ion âm dẫn đến sự hấp phụ tăng, hệ quả là hiệu suất phân huỷ tăng trong môi trường acid.
3.4.2.4. Sự hoàn nguyên xúc tác
Kết quả hoàn nguyên xúc tác được trình bày ở hình 3.47, chất xúc tác sau một lần phản ứng được tách ra và nung lại ở 500 oC trong 2 giờ. Kết quả cho thấy qua ba lần sử dụng hoạt tính hầu như không thay đổi.
Cấu trúc và thành phần hoá học của xúc tác sau ba lần hoàn nguyên được nghiên cứu bằng nhiễu xạ XRD (hình 3.48) và kết quả đo EDX (bảng 3.20). Kết quả cho thấy sau ba lần sử dụng cấu trúc tinh thể cũng như thành phần hoá học (tỉ lệ La/Zn) hầu như không thay đổi nhiều, chứng tỏ xúc tác La - ZnO tương đối bền.
10 | 20 | 30 | 40 | 0 | 10 | 20 | 30 | 40 | 0 | 10 | 20 | 30 | 40 | |
Thời gian(phút) | Thời gian(phút) | Thời gian(phút) |
Có thể bạn quan tâm!
-
 Ảnh Sem Của Các Mẫu Tổng Hợp Ở Các Nhiệt Độ Thủy Nhiệt Khác Nhau
Ảnh Sem Của Các Mẫu Tổng Hợp Ở Các Nhiệt Độ Thủy Nhiệt Khác Nhau -
 Cường Độ Tâm Acid Ở Các Nhiệt Độ Khác Nhau Được Đặc Trưng Bằng Lượng Nh3 Giải Hấp Theo Chương Trình Nhiệt Độ
Cường Độ Tâm Acid Ở Các Nhiệt Độ Khác Nhau Được Đặc Trưng Bằng Lượng Nh3 Giải Hấp Theo Chương Trình Nhiệt Độ -
 Bậc Phản Ứng (A) Của Mb Tính Từ Các Tốc Độ Ban Đầu Khác Nhau
Bậc Phản Ứng (A) Của Mb Tính Từ Các Tốc Độ Ban Đầu Khác Nhau -
 So Sánh Hoạt Tính Cảm Biến Khí Hydro Của Zno Và La - Zno Của Luận Án Này Với Một Số Công Trình Khác
So Sánh Hoạt Tính Cảm Biến Khí Hydro Của Zno Và La - Zno Của Luận Án Này Với Một Số Công Trình Khác -
 So Sánh Độ Cảm Biến Ammonia Của Vật Liệu Zno Và La – Zno Với Một Số Nghiên Cứu Khác
So Sánh Độ Cảm Biến Ammonia Của Vật Liệu Zno Và La – Zno Với Một Số Nghiên Cứu Khác -
 Ảnh Hưởng Của Biên Độ Xung (Δe) Đến Tín Hiệu Ip
Ảnh Hưởng Của Biên Độ Xung (Δe) Đến Tín Hiệu Ip
Xem toàn bộ 207 trang tài liệu này.
100
100
80
80
60
60
40
40
Lần1
20
20
100
80
60
40
LÇn2
LÇn3
20
C/Cox 100
1000 cps
C/Co
(100)
(002)
(101)
(102)
C/Co
(110)
(103)
(200)
(112)
(201)
Hình 3.47. Sự hoàn nguyên xúc tác La - ZnO qua ba lần sử dụng (điều kiện: V=100 mL, 30 mg/L, thời gian chiếu tia UV t = 40 phút, khối lượng xúc tác m= 0,1 gam, nhiệt độ phản ứng, t=28 oC, khuấy trộn đều)
L3
L2
L1
Cường độ
20 30 40 50 60 70
2θ (độ)
Hình 3.48. Giản đồ XRD của LZ1 sau ba lần sử dụng
Bảng 3.20. Vật liệu mẫu LZ1 sau ba lần sử dụng
Zn | La | Tỷ lệ mol La/Zn | |
(mol) | (mol) | (đo bằng EDX) | |
Ban đầu (Lo) | 0,01200 | 0,00054 | 0,05 |
Lần 1 (L1) | 0,01245 | 0,000553 | 0,04 |
Lần 2 (L2) | 0,01158 | 0,000601 | 0,05 |
Lần 3 (L3) | 0,01175 | 0,000592 | 0,05 |
Số lần thí nghiệm
Hình 3.49 trình bày phổ UV – Vis các quá trình quang hóa cho thấy cường độ của giải hấp thụ 590 nm giảm rất nhanh, tuy nhiên giải hấp thụ ở 300 nm giảm rất chậm điều này có thể do sự phân huỷ quang hoá phân cắt các phân tử MB thành nhiều phân tử chứa vòng thơm do đó nồng độ hợp chất chứa vòng thơm tăng lên. Khi quá trình cắt mạch nhóm mang màu kết thúc, quá trình phân huỷ quang hoá tiếp tục xảy ra với các tiểu phân chứa vòng thơm tạo thành CO2.
(a)
0phót 3phót 120phót 180phót 300phót
(b)
2 70
60
50
Độ hấp thụ (abs)
COD (mg/L)
40
1
30
20
10
0
200 300 400 500 600 700 800
B−íc sãng(nm)
0
0 20 40 60 80 100 120
Thời gian(phút)
Hình 3.49. a. Phổ UV-Vis của dung dịch MB ở các thời điểm khác nhau; b. Đồ thị COD của dung dịch MB sau khi phân huỷ quang hoá
Kết quả phân tích COD cho thấy COD giảm đáng kể từ giá trị ban đầu là 60,3 mg/L, sau 120 phút chỉ còn lại 5,2 mg/L. Chứng tỏ quá trình oxy hoá xảy ra sâu. Gốc hydroxyl và lỗ trống quang sinh là tác nhân oxy hoá rất mạnh và không chọn lọc có thể khoáng hoá hoàn toàn theo sơ đồ phản ứng sau:
MB Hợp chất vòng phenol Phá vòng phenol CO2 + H2O
3.5. HOẠT TÍNH CẢM BIẾN KHÍ CỦA ZnO VÀ La - ZnO
Trong nghiên cứu này chúng tôi sẽ nghiên cứu hoạt tính cảm biến khí của các vật liệu ZnO và La - ZnO được tổng hợp với tỉ lệ mol La/Zn khác nhau: 0,00 (LZ15) 0,047 (LZ1); 0,07 (LZ13) và 0,09 (LZ14) trên ba loại khí H2, C2H5OH và NH3.
3.5.1. Hoạt tính cảm biến đối với hydro
Hình 3.50; 3.51; 3.52 và 3.53 trình bày kết quả cảm biến khí hydro của các mẫu LZ15; LZ1; LZ13 và LZ14 ở các nồng độ từ 25 đến 250 ppm ở nhiệt độ 300 oC, 400 oC và 450 oC.
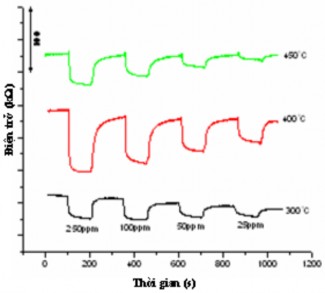
Hình 3.50. Sự phụ thuộc của điện trở của mẫu LZ15 vào nồng độ của khí hydro
ở các nhiệt độ khác nhau
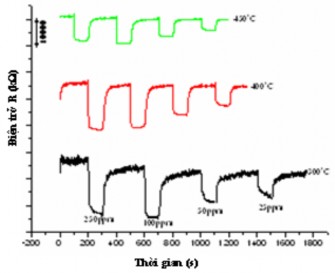
Hình. 3.51. Sự phụ thuộc của điện trở của mẫu LZ1 vào nồng độ của khí hydro
ở các nhiệt độ khác nhau
250ppm 100ppm 50ppm 25ppm
Hình 3.52. Sự phụ thuộc của điện trở của mẫu LZ13 vào nồng độ của khí hydro
ở các nhiệt độ khác nhau
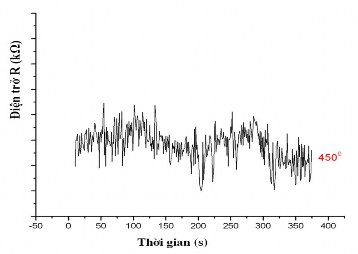
Hình. 3.53. Sự phụ thuộc của điện trở của mẫu LZ14 vào nồng độ của khí hydro
ở nhiệt độ 450 oC
Chúng ta biết rằng, khi vật liệu cảm biến đặt trong môi trường không khí thì điện trở của vật liệu tăng đến giá trị Ra, sau khi đưa vào môi trường có sự hiện diện của khí hydro thì điện trở giảm đến giá trị Rg. Đặc trưng cho mức độ cảm biến khí là độ hồi đáp S = Ra/Rg. Độ hồi đáp càng lớn thì vật liệu đó có tính cảm biến với khí đó càng cao. Giá trị của độ hồi đáp của vật liệu ZnO và La - ZnO được trình bày ở bảng 3.21. Có thể thấy rằng, độ hồi đáp tăng khi pha tạp La vào (mẫu LZ1), sau đó lại giảm đáng kể khi tiếp tục tăng lượng pha tạp La (LZ13, LZ14) và tuỳ thuộc vào mỗi loại vật liệu độ hồi đáp có khuynh hướng tăng khi nhiệt độ tăng, sau đó giảm nếu tiếp tục tăng nhiệt độ. Ví dụ, tại nồng độ 250 ppm hydro, mẫu LZ15 có độ hồi đáp S = 2,4 ở 300 oC, S =
3,8 ở 400 oC và S = 2,5 ở 450 oC. Trong khi đó, độ hồi đáp của LZ1 có khuynh hướng tăng khi nhiệt độ tăng từ 300 oC đến 450 oC. Kết quả này khác với kết quả của nhóm tác giả Malyshev và Pislyakov [99] nghiên cứu hoạt tính cảm biến SnO2 và pha tạp La vào SnO2 đối với hydro. Độ hồi đáp cũng có khuynh hướng tăng khi nồng độ khí hydro tăng. Khi pha tạp La vào thì độ hồi đáp của vật liệu La - ZnO có khuynh hướng giảm, đến tỉ lệ mol La/Zn = 0,09 thì gần như không đo được.
Bảng 3.21. Độ hồi đáp của các vật liệu ZnO và La - ZnO với khí hydro
Nhiệt độ (oC)
Tên mẫu
300 400 450
Nồng độ (ppm) Nồng độ (ppm) Nồng độ (ppm)
25 | 50 | 100 | 250 | 25 | 50 | 100 | 250 | 25 | 50 | 100 | 250 | |
LZ15 | 1,4 | 1,6 | 2,0 | 2,4 | 1,5 | 1,7 | 2,6 | 3,8 | 1,1 | 1,3 | 1,8 | 2,5 |
LZ1 | 1,5 | 1,6 | 2,0 | 2,2 | 1,7 | 2,4 | 5,4 | 8,2 | 1,7 | 3,0 | 9,5 | 9,9 |
LZ13 | 1,1 | 1,4 | 1,4 | 1,8 | 1 | 1 | 1,3 | 2,0 | 1 | 1 | 1 | 1 |
LZ14 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
Người ta cho rằng oxy bị hấp phụ lên bề mặt chất bán dẫn và tạo thành các dạng
oxy tích điện âm ở dạng
O, O
và O2[125, 132]. Cơ chế cảm biến khí dựa trên sự
2
tương tác giữa oxi hấp phụ tích điện âm trên bề mặt và hydro cần phát hiện. Thoạt tiên, oxy hấp phụ trên bề mặt chất bán dẫn và lấy điện tử của nó theo phương trình phản ứng [125, 132]:
O 2 O2 (ads) 2O O(ads) 2e O 2O(ads) e O
(3.24)
Vì vậy, điện trở của chất bán dẫn sẽ tăng. Một số tác giả cho rằng ở nhiệt độ
thấp, dạng oxy tồn tại chủ yếu là O2[96]. Khi chất bán dẫn được tiếp xúc với khí khử
hydro, nó sẽ phản ứng với các ion oxi hấp phụ tạo ra nước và trả lại điện tử trên bề mặt, kết quả làm giảm điện trở của chất bán dẫn. Cơ chế cảm biến khí có thể giải thích theo những phương trình sau:
ZnO 2 2
(O) H H O(gas) e (3.25)
2H 2
(O2)
ads
2H
2O(gas) 2e
(3.26)
Phản ứng này có bản chất thu nhiệt [132], như vậy khi nhiệt độ tăng thì phản ứng (3.24), (3.25) và (3.26) xảy ra càng mạnh. Khi nồng độ khí hydro tăng dẫn đến tốc độ phản ứng (3.24), (3.25) và (3.26) tăng. Sự gia tăng cả hai yếu tố này đều có khuynh hướng tăng quá trình trả lại điện tử trên bề mặt chất bán dẫn hay giảm điện trở của vật liệu. Điều này giải thích tại sao khi tăng nhiệt độ đo hay tăng nồng độ của khí hydro thì độ hồi đáp đều có khuynh hướng tăng. Các phản ứng hấp phụ hoá học có khuynh hướng tăng khi nhiệt độ tăng. Tuy nhiên, khi nhiệt độ tăng đến một lúc nào đó, quá trình giải hấp sẽ chiếm ưu thế, khi đó tốc độ hấp phụ sẽ giảm (phản ứng 3.24), do đó độ hồi đáp sẽ giảm.
Malyshev và cộng sự [99] cho rằng cơ chế cảm biến khí hydro có thể bao gồm hai giai đoạn: Tâm hoạt tính hấp phụ hydro trên bề mặt chất là các gốc ion hấp phụ hoá học của phân tử oxy mà nó là một phần của lớp oxygen - hydroxyl (OHL). Ở giai đoạn đầu của phản ứng, sự hấp phụ các phân tử hydro trên gốc ion O- cùng với sự phân ly của phân tử. Kết quả là nguyên tử H và nhóm OH hình thành và chuyển lên bề mặt thành H+ và OH-. Giai đoạn thứ hai, sự tái kết hợp H+ và OH- xảy ra cùng với sự giải hấp của phân tử nước. Tại cả hai giai đoạn, tốc độ của phản ứng phụ thuộc vào vị trí của mức Fermi trên bề mặt của mức tinh thể. Một sự dịch chuyển hướng lên trên ức chế phản ứng và dịch chuyển mức Fermi hướng xuống dưới tăng tốc độ phản ứng. Mức độ nhạy khí hydro của La - ZnO có khuynh hướng tăng so với ZnO, có thể do sự dịch chuyển mức Fermi hướng lên trên trong phản ứng tạo thành nước trên bề mặt La - ZnO. Khi hàm lượng La quá cao, có thể gây ra sự dịch chuyển mức Fermi hướng
xuống dưới làm ức chế phản ứng. Kết quả này cũng tương tự như trong trường hợp hoạt tính cảm biến khí hydro La - SnO2 so với SnO2 [99].
Kết quả so sánh độ hồi đáp ở bảng 3.22 cho thấy vật liệu ZnO và La - ZnO điều
chế được có độ cảm biến với khí hydro cao hơn so với kết quả của một số công bố trước đây. Độ hồi đáp của ZnO dạng que trong nghiên cứu này cao hơn nhiều so với độ hồi đáp của ZnO dạng nano (0D) trong nhiều công bố [166]. Tuy nhiên, ZnO dạng que phân bố trong các ống Al2O3 [19] cho hoạt tính cảm biến rất cao, điều này có thể do sự hình thành ZnO dạng que có cấu trúc đa chiều cao hơn do sự phân bố của nó trong các ống Al2O3 (1D).






