Bảng 3.14. Cường độ tâm acid ở các nhiệt độ khác nhau được đặc trưng bằng lượng NH3 giải hấp theo chương trình nhiệt độ
LZ1 LZ14 LZ15
Nhiệt độ
(cm3/g) | (cm3/g) | (cm3/g) | |||
199,0214 | 0,406103 | 426,3031 | 0,208972 | 379,4423 | 1,166529 |
397,5486 | 4,236842 | 232,9721 | 0,968724 | 485,8522 | 0,255368 |
436,8058 | 0,31959 | 546,0026 | 0,16791 | 548,5942 | 1,339266 |
546,4814 | 0,125593 | 384,6936 | 2,949864 | 522,7669 | 2,091184 |
- | - | - | - | 471,0582 | 3,515515 |
Có thể bạn quan tâm!
-
 A. Chỉ Số Hướng Mặt Phẳng Của Cấu Trúc Lục Lăng; B. Cấu Trúc Tinh Thể Lục Lăng
A. Chỉ Số Hướng Mặt Phẳng Của Cấu Trúc Lục Lăng; B. Cấu Trúc Tinh Thể Lục Lăng -
 Tổng Hợp Zno Dạng Cầu Trong Hệ Kẽm Acetate – Ethanol - Koh
Tổng Hợp Zno Dạng Cầu Trong Hệ Kẽm Acetate – Ethanol - Koh -
 Ảnh Sem Của Các Mẫu Tổng Hợp Ở Các Nhiệt Độ Thủy Nhiệt Khác Nhau
Ảnh Sem Của Các Mẫu Tổng Hợp Ở Các Nhiệt Độ Thủy Nhiệt Khác Nhau -
 Bậc Phản Ứng (A) Của Mb Tính Từ Các Tốc Độ Ban Đầu Khác Nhau
Bậc Phản Ứng (A) Của Mb Tính Từ Các Tốc Độ Ban Đầu Khác Nhau -
![Minh Hoạ Cơ Chế Xúc Tác Quang Hoá Cuả Zno Và La-Zno [110]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Minh Hoạ Cơ Chế Xúc Tác Quang Hoá Cuả Zno Và La-Zno [110]
Minh Hoạ Cơ Chế Xúc Tác Quang Hoá Cuả Zno Và La-Zno [110] -
 So Sánh Hoạt Tính Cảm Biến Khí Hydro Của Zno Và La - Zno Của Luận Án Này Với Một Số Công Trình Khác
So Sánh Hoạt Tính Cảm Biến Khí Hydro Của Zno Và La - Zno Của Luận Án Này Với Một Số Công Trình Khác
Xem toàn bộ 207 trang tài liệu này.
(oC)
Thể tích NH3 bị hấp phụ
Nhiệt độ
(oC)
Thể tích NH3 bị hấp phụ
Nhiệt độ
(oC)
Thể tích NH3 bị hấp phụ
Tổng tâm acid giảm đáng kể khi lượng pha tạp La tăng. Đối với mẫu ZnO, tổng thể tích NH3 hấp phụ là 8,37 cm3/g, còn với mẫu La - ZnO (LZ1) thì thể tích NH3 hấp phụ là 5,09 cm3/g và La - ZnO (LZ14) là 4,3 cm3/g. ZnO có tâm acid mạnh lớn hơn rất
nhiều so với các mẫu pha tạp La, (LZ1 và LZ14). Khi pha tạp La vào ZnO, tâm acid yếu có khuynh hướng tăng so với ZnO. Điều này có thể liên quan đến hoạt tính cảm biến khí của nó mà chúng tôi sẽ giải thích trong phần 3.4.
Chúng ta biết rằng, điểm đẳng điện của chất rắn là tại đó, thế zeta bằng không. Điểm đẳng điện có thể được xác định bằng cách điều chỉnh pH đến một giá trị thích hợp nào đó. Bề mặt ZnO/La - ZnO (được ký hiệu như R-OH) sẽ trở nên tích điện dương khi ở trong môi trường pH thấp theo phản ứng sau:
ROH + H+ OH-→ -ROH2+ +OH- (3.6)
Nếu ZnO/La - ZnO trong môi trường pH cao bề mặt của nó sẽ tích điện âm theo phản ứng sau đây:
ROH + H+OH− → RO(HO-) + H+ (3.7)
Vì vậy, bề mặt sẽ có khuynh hướng tích điện âm khi pH càng cao, và càng tích điện dương khi pH càng thấp. Tại một giá trị pH trung gian nào đó, bề mặt trở nên không tích điện, và thế zeta trở nên bằng 0, đây chính là điểm đẳng điện (isoelectric point) (thuờng ký hiệu là i.e.p). Giá trị pH tại i.e.p pHi.e.p. Hình 3.36 trình bày mối quan hệ pH theo pHi. Khi ZnO/La - ZnO được đưa vào dung dịch với pH thấp hơn pH đẳng điện, bề mặt của nó tham gia phản ứng (3.6). Giá trị pH tăng bởi vì phản ứng
(3.6) tạo ra nhóm hydroxyl OH-, vì thế pH nhận được có giá trị dương. Ngược lại, khi ZnO/La -ZnO được đưa vào môi trường có pH cao hơn pHi.e.p, bề mặt của nó theo phản ứng (3.7), thế thì pH của dung dịch giảm bởi vì phản ứng (3.7) sinh ra proton H+, pH sẽ nhận được giá âm. Giá trị pH mà tại đó pH tiến đến 0 chính là pHi.e.p. Hình 3.36. cho thấy điểm đẳng điện của LZ1 và LZ15 không khác nhau nhiều lắm, gần xấp xỉ bằng 7.
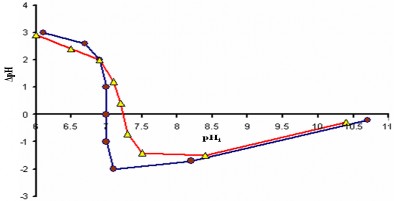
Hình 3.36. Sự phụ thuộc của pH vào giá trị pHi ban đầu để xác định điểm đẳng điện
Trong dung dịch quá bão hoà, luôn có hai quá trình xảy ra đồng thời: Hạt nhân tinh thể hình thành, phát triển và sự ghép nối các hạt tinh thể thành các hạt mới. Theo hướng thứ nhất: Khi đa số các chất hoà tan quá dư kết tinh trong dung dịch quá bão hoà thì có một sự giảm đáng kể về mức độ bão hoà. Trong điều kiện như vậy, các hạt nhỏ hơn bắt đầu hoà tan và tạo thành các hạt lớn hơn vì tiêu hao các hạt nhỏ. Quá trình này thường được biết dưới tên gọi sự “chín muồi Ostwald” (Ostwald ripening) [116]. Theo hướng thứ hai: Năng lượng bề mặt (0001) của cấu trúc lục phương ZnO được cho là có giá trị cao nhất, do đó sẽ có sự ưu tiên phát triển theo hướng [0001] để hình thành cấu trúc que (1D) [71]. Theo khuynh hướng này, tinh thể phát triển không theo hướng sự bồi đắp các monomer (coarsening process) hay cơ chế “chín muồi Ostwald”, mà theo cơ chế “ghép nối có định hướng” (oriented attachment). Sự ghép nối bất đẳng hướng thường xảy ra bằng cách giới hạn một quá trình kết hợp nào đó chỉ trong một vài hướng tinh thể là cơ chế chủ yếu trong việc tạo thành cấu trúc bất đẳng hướng của vật liệu nano. Chúng tôi cho rằng luôn luôn tồn tại hai quá trình này, tuỳ thuộc vào điều kiện nhiệt động học thuận lợi thì một trong hai cơ chế sẽ ưu tiên phát triển. Mô hình hình thành La - ZnO dạng hạt nano và dạng que được trình bày ở sơ đồ 3.3. Khi ở
nồng độ gel loãng, hạt có khuynh hướng phát triển đẳng hướng tạo ra hạt cầu, nồng độ càng loãng thì kích thước hạt càng nhỏ (dĩ nhiên càng dễ kết tụ), lúc này cơ chế chín muồi Otwald sẽ đóng vai trò quyết định sự hình thành hình thái của hạt. Khi ở nhiệt độ thấp (sự thuỷ phân xảy ra chậm) hay nồng độ NaOH thấp (sự thuỷ phân xảy ra chậm), tương đương với trường hợp nồng độ gel thấp, sự hình thành hình thái tinh thể đều có khuynh hướng xảy ra theo cơ chế này. Khi nồng độ gel cao, hay sự thuỷ phân xảy ra nhanh, tức trong trường hợp tổng hợp ở nhiệt độ cao, hay nồng độ NaOH cao, thì hình thành La - ZnO theo cơ chế ghép nối định hướng chiếm ưu thế và kết quả là vật liệu dạng que sẽ hình thành.
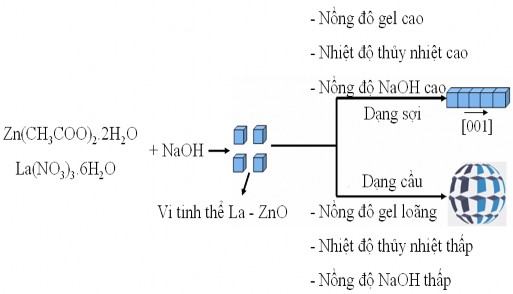
Sơ đồ 3.3. Sơ đồ minh họa sự hình thành La - ZnO dạng sợi và dạng cầu
3.4. HOẠT TÍNH XÚC TÁC CỦA ZnO VÀ La-ZnO
Nghiên cứu động học là một trong những nghiên cứu cơ bản về mặt lý thuyết để ứng dụng vào thiết kế thiết bị trong thực tế và dự đoán cơ chế phản ứng. Các phương pháp dùng để nghiên cứu động học thường được đề cập trong các tài liệu tham khảo như: phương pháp dùng phương trình tốc độ tích phân; dùng thời gian bán phản ứng; phương pháp nồng độ đầu; phương pháp phân lập [13, 130]. Tuy nhiên, các nghiên cứu về mặt thực nghiệm liên quan đến phương pháp nồng độ đầu rất ít được công bố. Đa số các nghiên cứu về động học đều nghiên cứu biến đổi tốc độ phản ứng theo thời gian. Đối với một số phản ứng đặc biệt như phản ứng quang hóa hay oxy hóa nâng cao xảy ra rất nhanh và cơ chế phức tạp, nên việc xác định tốc độ phản ứng một cách liên tục đều rất
khó khăn. Về mặt lý luận thì phương pháp nồng độ đầu có thể khắc phục khó khăn này. Trong luận án này, chúng tôi áp dụng phương pháp nồng độ đầu để nghiên cứu động học của cả hai quá trình oxy hóa nâng cao và quang hóa của phản ứng oxy hóa phân hủy methyl xanh.
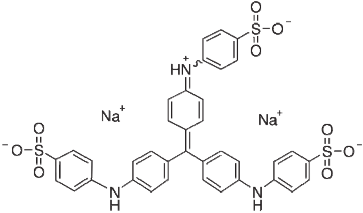
Sơ đồ 3.4. Công thúc cấu tạo của methyl xanh ((disodium [[4- bis[4[(sulphonatophenyl)amino]phenyl]methylene]cyclohexa-2,5-dien-1- ylidene]imino]benzenesulphonate)
3.4.1. Động học mất màu phẩm nhuộm methyl xanh bằng hệ xúc tác ZnO/H2O2 với sự hỗ trợ của sóng siêu âm
Trong nghiên cứu này, chúng tôi sử dụng nano ZnO dạng cầu làm chất xúc tác cho phản ứng phân huỷ methyl xanh (từ đây ký hiệu là MB) bằng H2O2 có sự hỗ trợ của sóng siêu âm. Do điều kiện sử dụng máy siêu âm hạn chế, trong phần này chúng tôi chỉ tập trung nghiên cứu động học.
Hình 3.37 a trình bày sắc đồ HPLC của sóng siêu âm tác động đến nước trong 90 phút, kết quả cho thấy có sự hình thành một lượng rất nhỏ H2O2 (khoảng 0,05 %) ở thời gian lưu 2,5 phút theo phương trình phản ứng:
H2O + siêu âm H2O2 (3.8)
H2O2 hầu như không bị phân huỷ trong điều kiện chiếu siêu âm trong 90 phút, kết quả phân tích bằng HPLC cho thấy nồng độ của nó gần như không thay đổi như chỉ ra trong hình 3.37 b, c. Từ kết quả trên có thể kết luận rằng, trong hệ phản ứng sóng siêu âm đang sử dụng không phát sinh H2O2 và cũng không phân huỷ H2O2.
Diện tích peak: 260947
Diện tích peak: 266480
a
b
c
Hình 3.37. Sắc đồ HPLC: a. nước cất được chiếu siêu âm trong 90 phút; b. Dung dịch H2O2 nồng độ ban đầu; c. Dung dịch H2O2 nồng độ được chiếu siêu âm trong 90 phút
f
e
d
c
b
a
90
80
70
Độ mất mμu (%)
60
50
40
30
20
10
0
0 2 4 6 8 10
``````````````````````````````````````````````````````````````````````````
Thời gian (phút)
Hình 3.38. Động học phân huỷ màu MB dưới các điều kiện khác nhau:
a. MB + sóng siêu âm, b. MB + H2O2, c. MB +H2O2+ sóng siêu âm, d. MB + ZnO,
e. MB + ZnO + sóng siêu âm, f. MB +ZnO+ H2O2 + sóng siêu âm.
Hình 3.38 trình bày sự phụ thuộc của thời gian vào độ chuyển hoá mất màu của MB ở những điều kiện khác nhau tại nhiệt độ phòng. Có thể thấy rằng, sóng siêu âm không thể làm mất phẩm nhuộm (hình 3.38 a), độ chuyển hoá mất màu của MB với H2O2 (hình 3.38 b) thấp hơn trường hợp có kết hợp thêm sóng siêu âm (hình 3.38 c). Độ chuyển hoá mất màu của MB chỉ dùng xúc tác ZnO cũng cao hơn nhiều trong trường hợp dùng sóng siêu âm và H2O2 (hình 3.38 d). Độ chuyển hoá mất màu dùng sự kết hợp ZnO + H2O2 + sóng siêu âm cho độ chuyển hoá màu cao nhất (hình 3.38 f).
Trong hệ xúc tác nâng cao dùng xúc tác kết hợp sóng siêu âm, được cho có ba vùng phản ứng khác nhau [48]. Thứ nhất là bên trong các bọt khí có nhiệt độ cao, thứ hai là vùng bề mặt giữa bọt khí và dung dịch và cuối cùng là vùng trong dung dịch. Trong nghiên cứu này từ chỗ chỉ áp dụng sóng siêu âm thì không thể phân huỷ MB do MB bền đối với sóng siêu âm (hình 3.38 a), phản ứng trong bọt khí cũng được cho là không xảy ra trong trường hợp này.
Tuy nhiên, sự chuyển hoá xảy ra và tăng đáng kể trong khi có sự hiện diện của H2O2 và sóng siêu âm, cho thấy rằng phản ứng có thể xảy ra ở một mức độ nào đó trong dung dịch. Lý do tại sao độ chuyển hoá mất màu cao trong trường hợp chỉ dùng ZnO cần phải được nghiên cứu thêm, tuy nhiên chúng tôi cho rằng điều này có thể liên quan đến sự hấp phụ của MB đối với ZnO. Sự kết hợp của xúc tác ZnO với H2O2 và sóng siêu âm làm tăng một cách đáng kể tốc độ chuyển hoá màu của MB so với các điều kiện khác. Điều này là do sự mất màu của MB chủ yếu do sự oxy hoá của các gốc tự do sinh ra trên bề mặt pha lỏng và chất xúc tác. Trong nghiên cứu này, động học hình thức của phản ứng oxy hoá bằng H2O2 làm mất màu MB với xúc tác ZnO có sự hỗ trợ của sóng siêu âm sẽ được nghiên cứu bằng phương pháp nồng độ đầu [13].
Động học hình thức của sự mất màu có thể mô tả bằng công thức:
r dC k[H dt
2O2
]a .[MB]b
(3.9)
Trong đó, [H2O2] và [MB] là nồng độ của hydroperoxide và MB [mol.L-1], a và b là bậc phản ứng của hydroperoxide và MB ; k là hằng số tốc độ [(mol.L-1) (1-a-b) (giây)-1].
Tại thời điểm ban đầu của phản ứng, tốc độ đầu có thể mô tả bằng phương trình:
r dC
i dt
C
t
Ci Ct
t
k[MB ]a [H
]
b
2O2 i
(3.10)
i
Ở đây, Ci và Ct (mol.L-1) là nồng độ cuả MB ở thời gian ban đầu và thời gian t; t
là khoảng thời gian (giây) từ lúc bắt đầu phản ứng đến thời điểm t.
Trong trường hợp nồng độ hydroperoxide rất lớn so với MB thì phương trình (3.10) có thể viết lại là:
r Ci Ct
k ' .[ MB ]a
với
k ' k[H O ]b
(3.11)
i ti
2 2 i
Logarite hoá phương trình (3.11), ta có:
logri =logk’+alog[MB]i (3.12)
Nồng độ ban
Bảng 3.15. Tốc độ ban đầu được tính ở 20 và 40 giây
ri(20s)
ri(40s)
x 105 | ||||
x 10-3 | (mol/L) | H2O2/MB | (mol.L-1.s-1) | (mol.L-1.s-1) |
0,48 | 0,43 | 896 | 2,237 | 1,118 |
0,42 | 0,43 | 1024 | 1,940 | 9,724 |
0,36 | 0,43 | 1194 | 1,663 | 8,321 |
0,3 | 0,43 | 1433 | 1,374 | 6,874 |
0,24 | 0,43 | 1792 | 1,079 | 5,405 |
0,47 | 0,56 | 1191 | 2,231 | 1,116 |
0,41 | 0,56 | 1366 | 1,940 | 9,705 |
0,35 | 0,56 | 1600 | 1,653 | 8,266 |
0,29 | 0,56 | 1931 | 1,363 | 6,816 |
0,24 | 0,56 | 2333 | 1,072 | 5,363 |
0,47 | 0,60 | 1277 | 2,222 | 1,111 |
0,41 | 0,60 | 1463 | 1,930 | 9,650 |
0,35 | 0,60 | 1714 | 1,646 | 8,231 |
0,29 | 0,60 | 2069 | 1,356 | 6,784 |
0,23 | 0,60 | 2609 | 1,065 | 5,326 |
Vấn đề khó khăn của phương pháp này là xác định nồng độ đầu, trên cơ sở thực nghiệm, chúng tôi chọn 2 thời điểm nồng độ đầu là 20 giây và 40 giây. Bảng 3.15. trình bày kết quả tính toán tốc độ ban đầu ở các thời điểm 20s và 40s. Do nồng độ mol của hydroperoxide được lấy lớn hơn hàng trăm lần đến hàng nghìn lần so với nồng độ của MB (xem tỉ lệ mol hydroperoxide : MB trong bảng 3.15), nồng độ hydroperoxide được giả thiết là không đổi trong phương trình tốc độ đầu (xem phương trình (3.11) và (3.12)).
Tại mỗi nồng độ hydroperoxide cố định, vẽ đồ thị logri theo log[MB]i dùng ri tính toán thời điểm 20 giây và 40 giây. Có ba đồ thị tương ứng với ba nồng độ cố định 0,38; 0,56; và 0,60 mol/L được trình bày ở hình 3.39. Tất cả các đồ thị đều có mối
tương quan tuyến tính rất cao với hệ số xác định R2 xấp xỉ bằng đơn vị (R2 = 0,999). Do ba đồ thị này gần như trùng nhau, nên một phần đồ thị ở gần đoạn cắt với trục tung được tách ra và phóng đại để quan sát rõ hơn và cũng được lồng vào hình 3.39 a. Giá trị đoạn cắt trục tung và độ dốc của đường thẳng sẽ là các giá trị logk’ và a, từ đó có thể tính được a và k’. Giá trị a (a1, a2, a3) cho mỗi nồng độ hydroperoxide được trình bày ở bảng 3.16. Tương tự như vậy, đồ thị logri với log[MB]i dùng ri tính ở 40 giây
cũng cho đường thẳng với hệ số xác định cao (R2 = 0,999) như chỉ ra trong hình 3.39 b.
Kết quả hồi qui tuyến tính được trình bày ở bảng 3.16. Giá trị tính toán đối với tốc độ ban đầu ở 20 giây (M = 1,053, SD = 0,006) là không khác biệt thống kê với giá trị tính từ nồng độ ban đầu ở 40s (M = 1,038, SD = 0,033), t(2) = 0,936, p = 0,488. Kết quả này cho thấy việc tính toán bậc phản ứng có độ lặp lại cao. Từ kết quả này có thể kết luận rằng bậc phản ứng của MB là bằng đơn vị trong phản ứng đang nghiên cứu.
-4.65
-4.70
-4.75
-4.95
a
b
c
(a)
-4.640
-4.645
-4.650
-4.655
-4.660
-4.665
-3.330 -3328. -3326. -3324. -3.322 -3320.
log(MB)
a b c
(b)
-4.946
-4.948
-4.950
-4.952
-4.954
-4.956
-4.958
-4.960
-4.962
-4.964
-3.330 -3.328 -3.326 -3.324 -3.322 -3.320
log[MB]
i
-5.00
-5.05
log(ri(20s))
-4.80
log(ri(40s))
-5.10
-4.85
-5.15
-4.90
log(r i(40s))
-5.20
logR i(20s)
-4.95
-5.25
-5.00
-3.65 -3.60 -3.55 -3.50 -3.45 -3.40 -3.35 -3.30
i
log[MB]
-5.30
-3.65 -3.60 -3.55 -3.50 -3.45 -3.40 -3.35 -3.30
i
log[MB]
Hình 3.39. a. Đồ thị log(ri(20s)) với log[MB]i; b. Đồ thị log(ri(40s)) với log[MB]i





![Minh Hoạ Cơ Chế Xúc Tác Quang Hoá Cuả Zno Và La-Zno [110]](https://tailieuthamkhao.com/uploads/2023/08/28/tong-hop-nano-kem-oxit-co-kiem-soat-hinh-thai-va-mot-so-ung-dung-17-1-120x90.gif)
