NH4OH vừa đủ để kết tủa
Mục đích của việc sử dụng các dung dịch này làm kết tủa các protid, lipid và các chất hữu cơ khác, nhằm loại chúng ra khỏi dịch thử, hạn chế sự ảnh hưởng của chúng đến việc xác định kết quả.
Các phương pháp xác định hàm lượng đường như:
Phương pháp Bertran
Phương pháp Somogyi
Phương pháp Codextan
Phương pháp DNS
Trong các phương pháp trên, phương pháp Bertran là phương pháp thường được sử dụng nhất vì độ chính xác, tính kinh tế và phù hợp với tiêu chuẩn đo lường của Việt Nam cũng như của thế giới.
Trong phương pháp Bertran, để khử tạp người ta sử dụng dung dịch kẽm feroxyanua. Ưu điểm của dung dịch này là: kinh tế, không gây độc, đảm bảo việc khử tạp tốt ít ảnh hưởng đến quá trình định phân.
1.17 XÁC ĐỊNH HÀM LƯỢNG ĐƯỜNG KHỬ PHÁP BERTRAND
1.17.1 Cơ sở của phương pháp
BẰNG PHƯƠNG
Đa số các phương pháp hoá học dùng để xác định đường khử đều dựa trên khả năng khử các hợp chất khác nhau của chúng. Một trong những
phương pháp xác định đường khử phương pháp Bertran.
chính xác. Phổ biến rộng rãi nhất là
Nguyên tắc:
Ở môi trường kiềm mạnh, các đường khử
(glucose,
fructose, mantose…) có thể dễ
dàng khử
oxi của Cu(OH)2 tạo kết tủa
dạng Cu2O màu đỏ gạch, qua đso tính được lượng đường khử:
Để định lượng đường khử ta thường dùng thuốc thử feling: thuốc thử này gồm hỗn hợp (1:1) của hai dung dịch: dung dịch sunfat đồng (feling
A) và dung dịch kieàm cuûa muoái kalinatri tactrat keùp (feling B).
Khi trộn hai dung dịch feling A và feling B với nhau thì xảy ra phản ứng giữa chúng theo hai giai đoạn. Đầu tiên tạo thành kết tủa hidroxit đồng xanh da trời.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Sau đó Cu(OH)2 tác dụng với muối kalinatri tactrat kép tạo thành muối phức hòa tan và dung dịch có màu xanh thẫm.
HO CH
COONa
O CH COONa
Cu(OH)2 +
Cu + 2H2O
HO CH
COOK
O CH COOK
Như vậy, muối kép này có tác dụng giữ cho ion Cu2+ trong môi trường kiềm không bị kết tủa dưới dạng Cu(OH)2. Muối phức trên không bền, vì thế các đường có chứa các nhóm andehid hoặc ceton đễ dàng khử Cu2+
thành Cu2+ tạo kết tủa đỏ
và bản thân đường bị
oxi hoá khi dung dịch
đường tác dụng với dung dịch Felling.
O CH
COONa
HO CH
COONa
RCHO + Cu
+ 2H2O RCOOH + Cu2O +
O CH
COOK
HO CH
COOK
Để định lượng Cu2O có tính khử, trước hết ta oxi hóa nó bằng muối sắt ba (Fe3+) làm cho muôi sắt này chuyển thành muối sắt 2 (Fe2+) ở môi trường acid:
Cu2O + Fe2(SO4)3 + H2SO4 → 2CuSO4 + H2O + 2FeSO4
FeSO4 được xác định bằng cách cho tác dụng với KMnO4 là chất oxi hóa, do đó dùng KMnO4 để chuẩn độ FeSO4 ở môi trường acid
10FeSO4 + 8H2SO4 + 2KMnO4 →
+8H2O
K2SO4 + 2MnSO4 + 5Fe2(SO4)3
Từ số mL KMnO4 0,1N dùng để chuẩn độ FeSO4 hình thành, tra bảng
để có số
mg đường glucose, maltose, saccharose, nhân với hệ số
pha
loãng ta có hàm lượng đường trong 100g thực phẩm.
1.17.2 Chuẩn bị mẫu
Cân 10g mận (phần lọc để chuẩn độ sẽ có nồng độ đường biểu thị bằng glucoza vào khoảng 4 – 10%). Nghiền cẩn thận và cho vào 30mL nước cất nóng 70800C để hoà tan mẫu, lấy nước trích ly. Chuyển toàn bộ hỗn hợp vào erlen 100mL
Đun cách thuỷ ở 80oC trong 15 phút. Lắng gạn lấy phần dung dịch
cho vào bình định mức 250. Cho thêm 30mL nước vào becker chứa xác mận tiến hành trích ly như trên đến lần thứ 3. Cho toàn bộ dịch trích ly vào erlen 250.
Khử
tạp chất: Cho vào 1mL kaliferocyanua 15%, lắc đều, để
yên
trong 2–3 phút. Cho thêm 5mL kẽm acetat 30% vào erlen chứa dịch xác định trên, khuấy mạnh.
Tiến hành lọc kết tủa (tạp) bằng giấy lọc băng vàng, rửa tạp bằng nước nóng cho sạch.
Cho dung dịch vào bình định mức dung tích 250 mL, tráng lại dụng cu
chứa dung dịch vài lần với nước cất. Nước tráng cho cả vào bình và
không được quá 250mL. Trung hòa axit hữu cơ có trong chất thử bằng dung dịch NaOH 10% đến khi pH = 7 (kiểm tra bằng giấy chỉ thị màu vạn năng).
Định mức bằng nước cất tới 250mL. Đem đi xác định hàm lượng đường
1.17.3 Xác định hàm lượng đường Lần lượt cho vào erlen 250mL: Dung dịch feling A 10 mL;
Dung dịch feling B 10 mL;
Cho 10 ml dịch lọc đã chuẩn bị ở trên và khoảng 20 ml nước cất. Đun sôi hỗn hợp đúng 3 phút tính từ khi bột nước xuất hiện đầu tiên. Sau khi đun sôi, dung dịch vẫn phải có màu xanh biếc đặc trưng. Nếu dung dịch bị mất màu hoàn toàn, màu lục, vàng hoặc nâu chứng tỏ lượng dung dịch feling cho vào không đủ để oxi hoá lượng đường trong mẫu. Trường hợp đó cần làm lại thí nghiệm hoặc với lượng thuốc thử nhiều hơn hoặc với lượng mẫu ít hơn.
Lấy bình ra và để nghiên cho cặn Cu2O lắng xuống. Dung dịch bên
trên lớp cặn phải có màu xanh của Cu(OH)2. Khi keát tuûa Cu2O lắng xuống, tiến hành lọc phần nước bên trên qua phễu lọc.
Cho nước đã đun sôi vào bình nón và tiếp tục gạn lọc vào phễu cho đến khi nước trong bình nón hết màu xanh.
Trong quá trình gạn lọc chú ý tránh đừng để cho kết tủa rơi vào phễu và luôn luôn giữ 1 lớp nước đã đun sôi trên mặt kết tủa trong bình nón và trong phễu để tránh oxi hoá.
Lần gạn lọc cuối cùng, gạn hết nước và cho ngay vào bình nón 20mL dung dịch Fe2(SO4)3 để hòa tan kết tủa Cu2O. Rút hết nước trong phễu,
thay bình hút lọc cũ bằng bình mới. Đổ dung dịch Fe2(SO4)3 đã hòa tan
hết kết tủa Cu2O trong bình nón, lên trên lớp cặn còn lại trên phễu.
Tráng bình nón và rửa phễu bằng dung dịch Fe2(SO4)3cho đến khi không còn vệt Cu2O trong bình nón và trong phễu. Hút xuống bình lọc và tráng rửa lại bằng nước cất đun sôi, hút cả xuống bình lọc. Chú ý là chỉ
dùng khoảng 30–50mL Fe2(SO4)3 để tráng bình và rửa phễu.
Thêm 5mL H2SO4 20%
hòa tan hoàn toàn kết tủa Cu2O,
Lấy bình lọc ra và chuẩn độ dung dịch sắt (II) hình thành bằng dung dịch KMnO4 cho đeán khi xuaát hieän maøu hồng nhạt vững bền trong 15 giây.
Làm song song với mẫu kiểm chứng thay dung dịch đường bằng nước cất.
Ghi nhận số
mL KMnO4 đã dùng và đem tra ở
bảng để
có lượng
đường glucose, lactose, maltose hoặc đường nghịch chuyển tùy theo yêu cầu.
1.17.4 Tính toán kết quả
Hàm lượng đường toàn phần biểu thị bằng đường glucose hoặc
đường nghịch chuyển (g) trong 100g thực phẩm.
Tính bằng công thức: X
a .Vdm . 100
Trong đó:
1000 Vxd Gbd
X : Hàm lượng đường khử tính theo %
a: Số mg đường nghịch chuyển hoặc đường glucose (mg)
tương
ứng với số
mL KMnO4 0,1N, được ghi
ở trong
Bảng
bảng của mẫu thí nghiệm trừ đi mẫu kiểm chứng.
G bd: lượng mẫu cân ban đầu, g.
Vxd: lượng dung dịch thử lấy để làm thí nghiệm (mL) Vdm: thể tích sau khi định mức.
1000: chuyển từ mg sang g. 100: Hệ số chuyển tính thành %
5.6 Bảng xác định đường glucoza
KMnO4 0,1N (ml) | Glucoza (mg) | KMnO4 0,1N (ml) | Glucoza (mg) | KMnO4 0,1N (ml) | |
10 | 3,21 | 40 | 12,2 | 70 | 20,4 |
11 | 3,52 | 41 | 12,5 | 71 | 20,7 |
12 | 3,82 | 42 | 12,8 | 72 | 20,9 |
Có thể bạn quan tâm!
-
 Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm
Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm -
 Phản Ứng Xảy Ra Trong Phương Pháp Lowry
Phản Ứng Xảy Ra Trong Phương Pháp Lowry -
 Xác Định Hàm Lượng Lượng Axit Amin Trong Thực Phẩm Bằng Phương Pháp Folmadehyl
Xác Định Hàm Lượng Lượng Axit Amin Trong Thực Phẩm Bằng Phương Pháp Folmadehyl -
 Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran
Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran -
 Xác Định Hàm Lượng Lipid Bằng Phương Pháp Adam – Rose – Gottlieb
Xác Định Hàm Lượng Lipid Bằng Phương Pháp Adam – Rose – Gottlieb -
 Xác Định Chỉ Số Xà Phòng Hoá Của Dầu Mỡ Thực Phẩm
Xác Định Chỉ Số Xà Phòng Hoá Của Dầu Mỡ Thực Phẩm
Xem toàn bộ 176 trang tài liệu này.

4,14 | 43 | 13,0 | 73 | 21,2 | |
14 | 4,45 | 44 | 13,3 | 74 | 21,4 |
15 | 4,75 | 45 | 13,6 | 75 | 21,7 |
16 | 5,06 | 46 | 13,9 | 76 | 22,0 |
17 | 5,38 | 47 | 14,2 | 77 | 22,2 |
18 | 5,69 | 48 | 14,4 | 78 | 22,5 |
19 | 5,99 | 49 | 14,7 | 79 | 22,7 |
20 | 6,31 | 50 | 15,0 | 80 | 23,0 |
21 | 6,60 | 51 | 15,3 | 81 | 23,2 |
22 | 6,90 | 52 | 15,6 | 82 | 23,5 |
23 | 7,20 | 53 | 15,8 | 83 | 23,7 |
24 | 7,50 | 54 | 16,1 | 84 | 24,0 |
25 | 7,80 | 55 | 16,4 | 85 | 24,2 |
26 | 8,10 | 56 | 16,6 | 86 | 24,5 |
27 | 8,40 | 57 | 16,9 | 87 | 24,7 |
28 | 8,73 | 58 | 17,2 | 88 | 25,0 |
29 | 8,99 | 59 | 17,5 | 89 | 25,2 |
30 | 9,29 | 60 | 17,7 | 90 | 25,5 |
31 | 9,58 | 61 | 18,0 | 91 | 25,7 |
32 | 9,87 | 62 | 18,3 | 92 | 26,0 |
33 | 10,2 | 63 | 18,5 | 93 | 26,2 |
34 | 10,5 | 64 | 18,8 | 94 | 26,5 |
35 | 10,7 | 65 | 19,1 | 95 | 26,7 |
36 | 11,0 | 66 | 19,3 | 96 | 27,0 |
37 | 11,3 | 67 | 19,6 | 97 | 27,2 |
38 | 11,6 | 68 | 19,9 | 98 | 27,5 |
39 | 11,9 | 69 | 20,1 | 99 | 27,7 |
100 | 28,0 |
13
Bảng 5.7 Bảng xác định đường nghịch chuyển
KMnO4 0,1N (ml) | Đường nghịch chuyển (mg) | KMnO4 0,1N (ml) | Đường nghịch chuyển (mg) | KMnO4 0,1N (ml) | |
10 | 3,24 | 40 | 12,2 | 70 | 20,3 |
11 | 3,55 | 41 | 12,5 | 71 | 20,6 |
12 | 3,87 | 42 | 12,8 | 72 | 20,8 |
13 | 4,17 | 43 | 13,1 | 73 | 21,1 |
14 | 4,48 | 44 | 13,3 | 74 | 21,3 |
15 | 4,80 | 45 | 13,6 | 75 | 21,6 |
16 | 5,11 | 46 | 13,9 | 76 | 21,8 |
17 | 5,42 | 47 | 14,2 | 77 | 22,1 |
18 | 5,72 | 48 | 14,5 | 78 | 22,4 |
19 | 6,04 | 49 | 14,7 | 79 | 22,6 |
20 | 6,35 | 50 | 15,0 | 80 | 22,9 |
21 | 6,65 | 51 | 15,3 | 81 | 23,1 |
22 | 6,95 | 52 | 15,5 | 82 | 23,4 |
23 | 7,25 | 53 | 15,8 | 83 | 23,6 |
24 | 7,55 | 54 | 16,1 | 84 | 23,8 |
25 | 7,83 | 55 | 16,4 | 85 | 24,1 |
26 | 8,13 | 56 | 16,6 | 86 | 24,3 |
27 | 8,43 | 57 | 16,9 | 87 | 24,6 |
28 | 8,73 | 58 | 17,2 | 88 | 24,8 |
29 | 9,03 | 59 | 17,4 | 89 | 25,1 |
30 | 9,32 | 60 | 17,7 | 90 | 25,3 |
31 | 9,61 | 61 | 18,0 | 91 | 25,6 |
32 | 9,91 | 62 | 18,2 | 92 | 25,8 |
33 | 10,2 | 63 | 18,5 | 93 | 26,1 |
34 | 10,5 | 64 | 18,7 | 94 | 26,3 |
35 | 10,8 | 65 | 19,0 | 95 | 26,5 |
36 | 11,1 | 66 | 19,3 | 96 | 26,8 |
37 | 11,4 | 67 | 19,5 | 97 | 27,0 |
38 | 11,6 | 68 | 19,8 | 98 | 27,3 |
39 | 11,8 | 69 | 20,1 | 99 | 27,5 |
100 | 27,8 |
1.18 XÁC ĐỊNH HÀM LƯỢNG ĐƯỜNG KHỬ PHÁP DNS
1.18.1 Nguyên tắc
BẰNG PHƯƠNG
Phương pháp này dựa trên cơ sở phản ứng tạo màu giữa đường khử
với thuốc thử
acid dinitrosalicylic (DNS). Cường độ
màu của hỗn hợp
phản
ứng tỉ
lệ thuận với nồng độ
đường khử
trong một phạm vi nhất
định. So màu tiến hành
ở bước sóng 540nm. Dựa theo đồ
thị
đường
chuẩn của glucoza tinh khiết với thuốc thử DNS sẽ tính được hàm lượng đường khử của mẫu nghiên cứu.
Phương trình phản ứng tạo màu giữa đường khử và DNS acid:
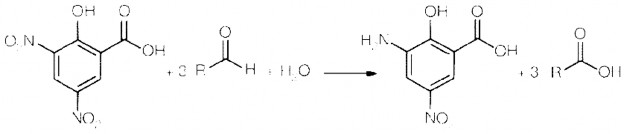
Hình 5.14(a) Acid dinitrosalicylic, (b) 3amino, 5 dinitrosalicylic acid
1.18.2 Xử lý mẫu
Tùy vào đối tượng nghiên cứu (hạt, quả...) mà cách chuẩn bị dung dịch
nghiên cứu dùng để định lượng đường có khác nhau đôi chút, nhưng
nguyên tắc chung như sau:
Trường hợp nguyên liệu thí nghiệm không chứa quá nhiều tinh bột hoặc inulin, có thể trích lyđường từ nguyên liệu bằng nước. Cân và cho vào cối sứ 1 g nguyên liệu hạt hay các mẫu thí nghiệm thực vật khô như cây, lá hoặc quả khô... đã được nghiền nhỏ (và sấy khô đến khối lượng không đổi). Nếu là nguyên liệu tươi (như hoa, quả tươi) thì cân 5 – 10 g. Nghiền cẩn thận với bột thủy tinh hay cát sạch và 30ml nước cất nóng 70 – 80°C. Chuyển toàn bộ hỗn hợp vào bình định mức dung tích 1000 ml. Đun cách thủy 70 – 80°C trong 35 – 40 phút, kết tủa protein và các tạp chất bằng dung dịch chì acetate Pb(C2H2O2)2.3H2O hoặc chì nitrate Pb(NO3)2 10%.
Tránh dùng quá dư chì acetate (dùng 2 – 5 ml chì acetate). Sau đó loại bỏ lượng chì acetate dư bằng dung dịch Na2SO4 bão hòa, để yên hỗn hợp 10 phút. Tiếp đó thêm nước cất tới vạch mức và đem lọc qua giấy lọc vào cốc hay bình khô. Nước lọc dùng làm dung dịch thí nghiệm.
Trường hợp nguyên liệu chứa quá nhiều tinh bột hoặc inulin như