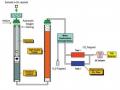
1.14.7 Phương pháp hấp thụ tử ngoại
1.14.7.1 Nguyên tắc
Protein hấp thụ bức xạ UV mạnh ở bước sóng 280 nm, chủ yếu do
các gốc tryptophan và tyrosine của phân tử protein. Vì hàm lượng của
tryptophan và tyrosine trong phân tử protein của mỗi loại thực phẩm khá ổn định, độ hấp thụ UV ở 280 nm có thể dùng để tính nồng độ protein dựa vào định luật Lambert Beer. Vì mỗi protein có thành phần axit amin có chứa số vòng thơm khác nhau nên cần xác định độ hấp thụ phân tử (molar absorptivity hay extinction coeficient) cho từng loại protein.
1.14.7.2 Quy trình
Protein được hòa tan trong dung dịch đệm hoặc kiềm.
Đo độ hấp thụ của dung dịch protein ở 280 nm đối chiếu với mẫu trắng.
Nồng độ protein được tính theo công thức:
A = abc
Có thể bạn quan tâm!
-
 Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng
Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng -
 Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm
Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm -
 Phản Ứng Xảy Ra Trong Phương Pháp Lowry
Phản Ứng Xảy Ra Trong Phương Pháp Lowry -
 Xác Định Hàm Lượng Đường Lần Lượt Cho Vào Erlen 250Ml: Dung Dịch Feling A 10 Ml;
Xác Định Hàm Lượng Đường Lần Lượt Cho Vào Erlen 250Ml: Dung Dịch Feling A 10 Ml; -
 Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran
Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran -
 Xác Định Hàm Lượng Lipid Bằng Phương Pháp Adam – Rose – Gottlieb
Xác Định Hàm Lượng Lipid Bằng Phương Pháp Adam – Rose – Gottlieb
Xem toàn bộ 176 trang tài liệu này.
Trong đó, A: mật độ quang a: độ hấp thụ phân tử b: chiều dày cuvet
c: nồng độ

1.14.7.3 Áp dụng, ưu và nhược điểm: Áp dụng:
Phương pháp hấp thụ UV được dùng để xác định protein cótrong
sữa và các sản phẩm thịt. Đây không phải làphương phaṕ cóưń g
dụng rộng rãi đối với cać loaị thực phẩm khać. Nóđược áp dụng
tốt hơn đối với các hệ protein đã được tinh sạch hoặc protein
được trích ly taćh nhờkiềm hoặc các tác nhân gây biến tính như ure 8 M.
Mặc dù các liên kết peptit cótrong protein hấp thụ UV ở 190220 nm mạnh hơn so với ở 280 nm, tuy nhiên đo UV ở vùng bước sóng ngắn như vậy khó khăn hơn.
Ưu điểm:
Nhanh và tương đối nhạy (ở 280 nm cần 100 g protein hoặc hơn
để phân tích; nhạy hơn phương pháp biuret nhiều lần).
Không bị nhiễu bởi sulfat amon và các muối đệm khác.
Mẫu không bị phân hủy; có thể dùng cho các phân tích khác sau khi phân tích xong protein; được áp dụng rộng rãi để xác định protein chạy qua cột sắc ký.
Nhược điểm:
Axit nucleic cũng hấp thụ UV ở 280 nm. Tỷ số giữa độ hấp thụ ở
280 nm và 260 nm của protein tinh sạch và axit nucleic tương ứng
là 1,75 và 0,5. Do đó có thể
hiệu chỉnh phần hấp thụ
của axit
nucleic ở 280 nm nếu biết các tỷ số này. Có thể hiệu chỉnh độ hấp
thụ của axit nucleic dựa vào sự 280 nm.
chênh lệch độ
hấp thụ ở
235 và
Cósự chênh lệch đáng kể vềhàm lượng các axit amin thơm trong thaǹ h phần cấu tạo của protein từ các nguồn khác nhau.
Dung dịch đo cần phải trong suốt và không màu. Độ đục do các
hạt có trong dung dịch sẽ làm sai lệch kêt́ quả đo mật độ quang.
Đòi hòi hệ protein câǹ xác định phải tương đối tinh sạch.
1.14.8 Xác định hàm lượng lượng axit amin trong thực phẩm bằng phương pháp folmadehyl
1.14.8.1 Lý thuyết
Khi thêm một lượng dư formol trung tính vào dung dịch axit amin, lúc này formol sẽ đẩy H+ ra khỏi – NH3+ và phản ứng với nhóm – NH2 tạo
thành dẫn xuất methyl hóa. Dẫn đến, axit amin mất đi tính bazo và chỉ còn tính axit do chỉ còn lại nhóm – COOH tự do.
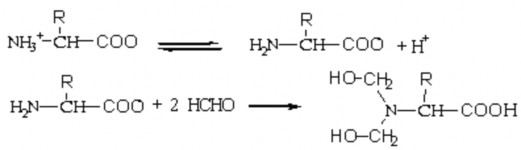
Định lượng các nhóm cacboxyl của chúng bằng dung dịch kiềm tiêu chuẩn. Từ đó tính được lượng nito amin của các axit amin có trong dung dịch.
Khi dùng phương pháp này cần chú ý những điểm sau:
Phải tuân thủ
những điều kiện để
cho phản
ứng tạo thành
metylen monoacid và phản ứng trung hòa tiến hành hoàn toàn,
nghĩa là cần có dư một ít dung dịch formaldehyd vào phản ứng trung hòa hoàn toàn các nhóm cacboxyl được thực hiện khi pH môi trường đạt tới 9,2 – 9,5.
Arginin và ure không phản ứng với formaldehyd cho nên không tính khi chuẩn bằng kiềm
Tirosin cho kết quả cao hơn vì ngoài nhóm cacboxyl, nhóm
phenol cũng một phần được định phân bởi kiềm. Một số acid amin cho kết quả ít hơn như prolin
Nếu trong dung dịch có chứa nhiều NH3, nhất là trong các dịch thủy phân protein thì phải loại trừ NH3 trừ trong chân không ở nhiệt độ 400C.
Các muối amon như NH4Cl, (NH4)2SO4 cũng tác dụng với
formaldehyde tạo thành hexamethylen tetramin và acid. Acid này sau đó được trung hòa bởi kiềm gây ra sai số
2(NH4)2SO4 + 6CH2O (CH2)6N4 + 2H2SO4 + 6H2O
4NH4Cl + 6CH2O (CH2)6N4 + 4HCl + 6H2O
Dung dịch nghiên cứu có màu đậm phải pha thật loãng vì nếu màu đậm thì khó nhận biết sự thay đổi màu khi chuẩn độ
Phương pháp này chỉ cho kết quả thật đúng đối với trường hợp của acid monoamino monocacboxylic. Để kết quả đúng với mọi trường hợp (khi trong dung dịch ngoài các acid monoamino monocacboxylic ra còn có chứa các acid monoamino dicacboxylic và diamino monocacboxylic) cần phải trung hòa dung dịch pH = 7 trước khi phân tích.
1.14.8.2 Dụng cụ và thiết bị
Máy lắc
Máy khuấy từ, cá từ Máy đo pH
Bình định mức 100mL 1 pipet 1mL
1 pipet 20mL
1.14.8.3 Hóa chất Na2HPO4 0,1N NaOH 0.05N
Ba(OH)2 bão hòa trong
CH3OH
1.14.8.4 Tiến hành
3 erlen 100mL
1 burette 25mL
2 becher 100mL
Ống nhỏ giọt
Formol trung tính 20% Phenolphtalein 1%
Lấy 1mL nước mắm cho vào bình định mức 100mL, dùng nước cất tráng, rửa và chuyển vào bình định mức sao cho khoảng 50mL, đậy lắp và lắc trong 10 phút
Thêm 3 giọt chỉ thị PP; cho từng giọt Ba(OH)2 bão hòa cho đến khi dung dịch có màu hồng. Cho dư 3mL Ba(OH)2 bão hòa, đun
sôi 1 phút rồi tiến hành lọc, rữa kết tủa bằng nước nóng. Thể tích dung dịch sau khi lọc khoảng 70mL.
Trung hòa dung dịch lọc bằng HCl 0,1N cho đến không màu. Dung NaOH 0,01N thêm từng giọt cho tới hồng nhạt, rồi dùng HCl 0,01N thêm từng giọt lắc đều cho đến không màu. Định mức dung dịch bằng nước cất trung tính đến 100mL
Lấy 25mL dịch lọc cho vào becker 250mL, thêm vào 20mL dung dịch focmon trung tính, 50mL nước cất; 2 giọt PP lắc đều trong 5 phút
Chuẩn độ bằng dung dịch chuẩn NaOH 0,05N đến khi dung
dịch có màu hồng nhạt. Ghi thể tích NaOH 0,05N tiêu tốn và
tính kết quả theo công thức dưới đây.
Song song tiến hành làm thí nghiệm kiểm chứng cho mẫu trắng, bằng cách thay dung dịch nghiên cứu bằng nước cất.
1.14.8.5 Tính toán kết quả
Lượng gam Nitơ acid amin có trong 1 lít nước mắm:
g/lit N
= 0,014
(Vth
Vtr)N
Vdm
1000
amin
Trong đó:
NaOH Vxd
Vbd
Vth và Vtr: Số mL NaOH dùng chuẩn độ cho mẫu thực và mẫu trắng.
N: Nồng độ dung dịch NaOH dung để chuẩn độ Vbd : Thể tích mẫu cho vào bình định mức (1mL) 0,014: Khối lượng của 1mdlg N.
Vdm : Thể tích bình định mức (100mL)
Vxd: Thể tích mẫu đem đi phân tích (25mL)
PHƯƠNG PHÁP XÁC ĐỊNH GLUXIT TRONG THỰC
PHẨM
1.15 GIỚI THIỆU CHUNG
Glucid là những hợp chất hữu cơ trong phân tử có chứa C, H, O kết hợp với nhau, trong đó có nhiều nhóm hydroxyt và một nhóm aldehyt (
CHO) hoặc xeton (CO) tự
do như
glucoza, fructoza… hoặc một hay
nhiều nhóm aldehyde hay ketone kết hợp với các nhóm chức khác như saccaroza, tinh bột… Ngoài ra, trong phân tử gluxit tỉ lệ mol của nguyên
tố oxy và hydro là 1:2 giống phân tử nước nên gluxit còn có tên gọi là
hydratcacbon.
Về phương diện hóa học, glucid có thể chia làm 2 nhóm:
Nhóm oza gồm các loại đường khử
trực tiếp khử
oxy do có nhóm
aldehyt hay xeton tự do trong phân tử, như glucoza, fructoza, lactoza...
Nhóm ozit không trực tiếp khử oxy vì các nhóm aldehyt và xeton ở
dưới dạng kết hợp với nhóm chức khác, khi thủy phân cho hai hoặc
nhiều oza (các holozit) như tinh bột, saccaroza… hoặc khi thủy phân
ngoài các oza còn cho các chất không phải oza (các heterozit), thí dụ như glucozit. Những glucozit không có giá trị về dinh dưỡng mà những chất có tính chất dược lý dùng làm thuốc chữa bệnh hoặc là chất độc.
Đường khử là các đường chứa nhóm aldehyt (CHO) hoặc xeton (CO) như glucoza, fructoza, arabinoza, maltoza, lactoza; trong khi đó saccaroza, trehaloza không phải đường khử.
Đa số các phương pháp chuẩn độ đường đều dựa trên khả năng khử của đường, do đó để xác định thành phần các đường không khử, người ta thường dùng phương pháp thủy phân đường không khử thành đường khử và chuẩn độ tổng lượng đường khử bao gồm lượng đường khử ban đầu trong mẫu và đường khử tạo ra do thủy phân đường không khử (thường
là các di, tri hay polysaccarit). Sau đó lượng đường không khử được tính bằng công thức:
Đường không khử = (đường tổng – đường khử) * hệ số k
Hệ số k phụ thuộc vào đường không khử, k = 0,95 với saccaroza và k
= 0,9 với tinh bột.
1.16 ĐẶC ĐIỂM CỦA CÁC PHƯƠNG PHÁP
Hầu
hết
các phương pháp xác định hàm lượng gluxit bằng phương
pháp hóa học đều dựa vào tính chất khử của nhóm andehyt và ceton tự do trong phân tử. Do đó, các phương pháp này chỉ xác định các loại đường khử (glucoza, fuctoza…). Để xác định hàm lượng các loại đường đôi, ba, hay polysaccarit (đường không khử) phải thủy phân các loại đường này thành các loại đường khử đơn giản.
Các hợp chất như lipit, protit, các kim loại… cũng ảnh hưởng lớn đến
kết quả xác định. Do đó trước khi xác định gluxit cần loại bỏ các loại
hợp chất này.
Có rất nhiều phương pháp xác định gluxit (đường khử, đường tổng, tinh bột). Song để có một kết quả chính xác, phải đặc biệt chú ý đến hai
khâu quan trọng trong khi chuẩn bị mẫu: Phương pháp thủy phân và
phương pháp khử tạp. Ngoài ra, độ tinh khiết hóa chất, thao tác kỹ thuật cũng góp phần tạo nên một kết quả chính xác
Phương pháp thủy phân:
Thông thường khi xác định loại đường không khử trực tiếp oxy hóa
như
saccaro, tinh bột… người ta thường dùng axid để
thủy phân các
đường này thành đường khử. Nhưng trong môi trường axid mạnh, nhiệt
độ cao thì không những các đường này bị thủy phân mà còn một số
đường khác như levuloza, pentoza… cũng bị thủy phân tạo thành các dẫn xuất của furfurol làm ảnh hưởng đến quá trình định phân. Do đó, khi tiến
hành thủy phân cần xác định nồng độ axit, nhiệt độ và thời gian tối ưu để thủy phân vừa đủ các loại đường không khử mục tiêu thành đường khử mà không làm ảnh hưởng đến những thành phần khác trong mẫu.
Những điều kiện của quá trình thủy phân:
Dung dịch mẫu phải có nồng độ từ 4 – 10% tính bằng đường glucoza.
Môi trường thủy phân là axit HCl 1N.
Nhiệt độ và thời gian: tuỳ theo từng loại đường mà có các chế độ khác nhau: Thủy phân đường saccaro trong nồi cách thủy ở 70 – 750C trong 15 phút. Thủy phân tinh bột, dextrin trong nồi cách thủy sôi trong 3 giờ. Sau khi thủy phân cần làm lạnh ngay dưới vòi nước.
Trung hòa (bằng dung dịch NaOH) để
đưa dung dịch về
môi
trường trung tính hay bazơ yếu. Vì ở môi trường này thuận lợi cho việc khử tạp và tủa đồng.
Phương pháp khử tạp:
Tuỳ theo từng nguyên liệu, từng loại thực phẩm mà sử dụng những phương pháp khử tạp khác nhau. Sau đây là một số dung dịch dùng để khử tạp.
Dung dịch chì axetat 30%
Dung dịch kaliferocianua 15%, dung dịch kẽm sungfat 30%
Dung dịch patanh: HNO3(d=1.39) 160mL + Chì oxit đỏ NaOH (d= 1.33) 10mL + Nước cất vừa đủ 1000mL
22g +
Dung dịch kaliiodmercurat: KI 33.2g + HgCl2 13.5g + CH3COOH 200mL + Nước cất 640mL
Khử tạp bằng nhôm hydroxit
Dung dịch nhôm clorua 1% (hoặc nhôm sunfat 1%)