Không phải là phương pháp tuyệt đối: cần phải xây dựng đường chuẩn hoặc đối chiếu với phương pháp Kjeldahl.
1.14.4 Phương pháp Lowry
1.14.4.1 Nguyên tắc
Phương pháp Lowry kết hợp phản ứng biuret với phản ứng khử của dung dịch FolinCiocalteau (phosphomolybdic/ phosphotungstic acid) vơí các gốc tyrosine và tryptophan của phân tử protein. Phức màu xanh da trời
tạo ra được đo ở bước song 750 nm. Từquy trình ban đầu Miller và
Hartree đãcónhưñ g cải tiến để
cải thiện độ
tuyến tính của quan hệ
giưã mật độ quang vơí nồng độ protein.
Cường độ màu của hỗn hợp phản ứng tỉ lệ thuận với nồng độ protein trong một phạm vi nhất định. Dựa vào mức độ hấp thụ quang học của
Có thể bạn quan tâm!
-
 Phương Pháp Nội Suy Gián Tiếp Để Ước Tính Lượng Nước Bằng Cách Đo Obrix
Phương Pháp Nội Suy Gián Tiếp Để Ước Tính Lượng Nước Bằng Cách Đo Obrix -
 Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng
Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng -
 Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm
Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm -
 Xác Định Hàm Lượng Lượng Axit Amin Trong Thực Phẩm Bằng Phương Pháp Folmadehyl
Xác Định Hàm Lượng Lượng Axit Amin Trong Thực Phẩm Bằng Phương Pháp Folmadehyl -
 Xác Định Hàm Lượng Đường Lần Lượt Cho Vào Erlen 250Ml: Dung Dịch Feling A 10 Ml;
Xác Định Hàm Lượng Đường Lần Lượt Cho Vào Erlen 250Ml: Dung Dịch Feling A 10 Ml; -
 Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran
Xác Định Hàm Lượng Đường Tổng Bằng Phương Pháp Bertran
Xem toàn bộ 176 trang tài liệu này.
protein chuẩn, ta có thể nghiên cứu.
xác định được hàm lượng protein trong mẫu
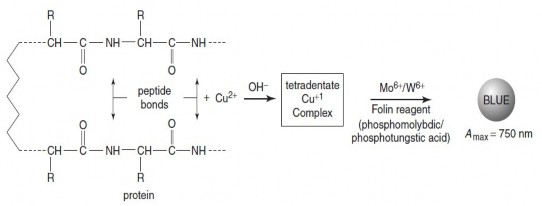
Hình 4.11 Phản ứng xảy ra trong phương pháp Lowry
1.14.4.2 Quy trình
Quy trình sau dựa trên nhưñ g cải tiến của Hartree:
Hoà tan mâũ protein cần phân tích đến hàm lượng thích hợp (20
100 g)
Sau khi lam̀ nguội, bổ sung dung dịch Tartrat Kali Natri Na2CO3
và ủ ở nhiệt độ phòng 10 phút.
Cho thêm dung dịch CuSO4 – KNaC4H4O6 (Tartrat Kali Natri) – NaOH sau khi để nguội và ủ ở nhiệt độ phòng 10 phút.
Bổ sung tiếp dung dịch phản ứng Folin mới được chuẩn bị, khuấy
đêù và ủ ở 50oC trong 10 phút.
Đo mật độ quang ở 750 nm.
Xây dựng đường chuẩn cẩn thận băǹ g albumin của serum bò (BSA: Bovine Serum Albumin) để xác định nồng độ protein của mẫu.
1.14.4.3 Áp dụng
Do tính đơn giản và độ nhạy cao, phương pháp Lowry được sử dụng rộng rãi trong phân tích hóa sinh. Tuy nhiên, đây không phải làphương pháp được dùng rộng rãi để xác định protein trong thực phẩm nếu chưa
chiêt́ tách protein ra khoi sản phẩm.
1.14.4.4 Ưu điểm
Rất nhạy:
50100 lần nhạy hơn so với phương pháp biuret
1020 lần nhạy hơn so với phương pháp hấp thụ UV ở 280 nm.
Độ nhạy tương đương với phương pháp Nessler hóa, tuy nhiên tiện lợi hơn
Ít bị ảnh hưởng bởi độ đục của mẫu.
Có tính đặc hiệu cao hơn so với các phương pháp khác
Tương đối đơn giản; có thể thực hiện trong vòng 11,5h.
1.14.4.5 Nhược điểm
Vì một số lý do sau, quy trình Lowry đòi hỏi phaỉ xây dựng đường
chuẩn cẩn thận cho từng áp dụng:
Màu sắc thay đổi tùy loại protein rõ hơn so với phương pháp biuret.
Cường độ protein.
màu không tỷ
lệ thuận nghiêm ngặt theo nồng độ
Phản ứng bị ảnh hưởng ở mức độ khác nhau bởi đường sacaroza, lipit, đệm phosphat, monosacarit và hexoamin.
Đường khử, sulfat amon và các hợp chất có nhóm SH với nồng độ cao ảnh hưởng đến phản ứng.
1.14.4.6 Tiến hành Hoá chất cần dùng:
Dung dịch A: 4g NaOH (0,1M) và 20g Na2CO3 (2%) pha trong 1000ml nước cất.
Dung dịch B: 0,5g CuSO4.5H2O (0,5%) pha trong dung dịch Natri citrat (1%) hoặc trong dung dịch Natri Kali Tactơrat 1%.
Dung dịch C: Hỗn hợp của hai dung dịch A và B theo tỉ (pha trước khi dùng).
lệ 49:1
Thuốc thử folin, trước khi dùng pha loãng hai lần sao cho độ axit bằng 1N.
Albumin huyết thanh bò 1mg/ml.
Cách tiến hành:
Mẫu thí nghiệm
Lấy chính xác 0,5ml dịch chứa protein với hàm lượng thích hợp cho vào ống nghiệm, thêm vào đó 2ml dung dịch C, lắc đều để yên trong 10
phút. Sau đó thêm vào hỗn hợp trong ống nghiệm 0,25ml folin đã pha
loãng 2 lần, lắc đều và để yên trong 30 phút, mầu vàng của hỗn hợp
chuyển sang mầu xanh da trời và đạt đến cường độ mầu cực đại. Đem
so màu của hỗn hợp trên máy so màu quang điện ở bước sóng 750nm.
Xác định được trị số
mật độ
quang học của dung dịch nghiên cứu. Đo
trên máy 3 lần lặp lại và lấy trị số trung bình.
Mẫu đối chứng:
Cho 0,5ml đệm cho vào ống nghiệm, thêm vào đó 2ml dung dịch C và bước tiếp theo được tiến hành như mẫu thí nghiệm.
Xây dựng đường đồ thị chuẩn:
Hàm lượng protein tan trong dung dịch được xác định theo phương pháp Lowry, dùng albumin huyết thanh bò (BSA) làm chất chuẩn.
Cân 0,01g (10mg – albumin huyết thanh bò) hoà tan trong 10ml
nước, ta được dung dịch gốc có nồng độ là 1mg/ml. Sau đó pha
loãng dung dịch gốc bằng nước cất với các nồng độ 20, 40, 60, 80, 100, 120 g/ml để tiến hành xây dựng đồ thị chuẩn.
Mẫu thí nghiệm: lấy chính xác 0,5ml dung dịch BSA ở nồng
độ pha loãng như
trên cho vào
ống nghiệm, thêm vào mỗi
ống 2ml dung dịch C để ở
nhiệt độ
phòng 10 phút, sau đó
cho 0,25ml thuốc thử folin (1N) đem so màu với bước sóng 660nm.
Mẫu đối chứng: lấy 0,5 ml nước cất cho vào ống nghiệm, thêm vào đó 2ml dung dịch C và các bước tiếp theo được tiến hành như mẫu thí nghiệm.
Qua 3 lần lặp lại thí nghiệm có thể xây dựng đường hồi quy. Kết quả được xử lý theo phương pháp thống kê thông thường.
1.14.5 Phương pháp nhuộm màu Bradford
1.14.5.1 Nguyên tắc
Khi thuốc nhuộm Coomassie Brilliant Blue G250 liên kết với protein, màu thuốc đổi từ đỏ nhạt đến xanh nhạt và bước sóng hấp thụ cực đại của màu nhuộm dịch từ 465nm đến 595nm. Sự thay đổi mật độ quang ở
bước sóng 595nm tỷ lệ thuận với nồng độ protein có trong mẫu. Cũng
giống như các phương pháp nhuộm màu khác, phương pháp Bradford
dựa vào bản chất lưỡng tính của protein. Khi dung dịch có chứa protein được axit hóa đến pH nhỏ hơn điểm đẳng điện của protein, thuốc nhuộm sẽ bám vào protein bằng tương tác tĩnh điện. Hiệu quả nhuộm màu tăng
lên do tương tác kỵ
nước giữa phân tử
phẩm nhuộm với bộ
khung
polypeptit kề bên các gốc tích điện dương của protein. Trong trường hợp của phương pháp Bradford, phẩm nhuộm sau khi bám vào protein sẽ thay đổi phổ hấp thụ so với lúc chưa liên kết.
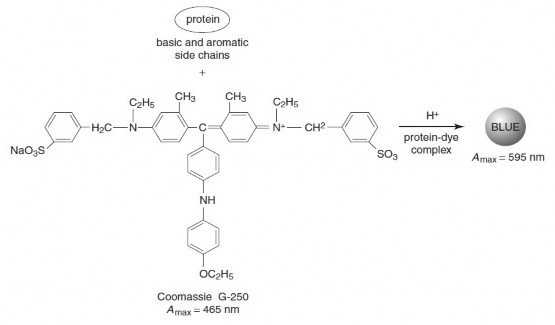
Hình 4.12 Phản ứng xảy ra trong phương pháp Bradford
1.14.5.2 Quy trình
Hòa tan phẩm màu Coomassie Brilliant Blue G250 trong etanol 95% và axit hóa bằng axit phosphoric 85%.
Hoà
trộn mẫu protein (1100
g/ml) và dung dịch chuẩn BSA
(Bovine Serum Albumin) với dung dịch Bradford.
Đo mật độ quang ở 595 nm đối chiếu với mẫu trắng.
Nồng độ protein cótrong mẫu được tính từ đường chuẩn BSA.
1.14.5.3 Áp dụng, ưu và nhược điểm:
Phương pháp Bradford sử dụng Coomassie Brilliant Blue G250 là
phương pháp nhanh và nhạy. Phương pháp này đã thay thế hầu hết các
phương pháp nhuộm màu sử dụng các phẩm nhuộm tích điện âm với
gốc axit sulfonic, như acid orange 12, Orange G và Amido Black. Phương
pháp Bradford đã được ứng dụng thành công khi xác định protein của
cháo, bia thành phẩm trong sản xuất bia. Quy trình này cũng được cải
tiến để định lượng protein ở hàm lượng g. Do phép đo nhanh, nhạy và ít
bị nhiễu hơn so với phương pháp Lowry, nó đã được sử dụng rộng rãi trong phân tích các loại protein tinh sạch.
Ưu điểm của phương pháp:
Thời gian tiến hành nhanh, phản phút.
Độ lặp lại tốt
ứng có thể
hoàn thành trong 2
Nhạy gấp nhiều lần so với phương pháp Lowry
Không bị nhiễu bởi sulfat amon, polyphenol, carbohydrat như
đường sacaroza hoặc các cation như K+, Na+ và Mg2+
Đo protein và các peptit có phân tử xấp xỉ hoặc lớn hơn 4000 Da.
Nhược điểm
Bị nhiễu bởi các chất tẩy rửa ion hoặc phi ion như Triton X100 và sodium dodecyl sulfat. Tuy nhiên, đây làcác sai số nhỏ (0.1%) có thể hiệu chỉnh được băǹ g các mẫu kiểm tra phù hợp.
Phức proteinphẩm màu có thể baḿ dính vào cuvet thạch anh. Phân
tích cần phải thực hiện với cuvet thủy tinh hoặc nhựa.
Màu sắc thay đổi tùy loại protein; Phải lựa chọn cẩn thận protein chuẩn.
1.14.6 Phương pháp Bicinchoninic Acid (BCA)
1.14.6.1 Nguyên tắc
Protein khử ion đồng (II) thành ion đồng (I) trong môi trường kiềm. Phức tạo ra giữa ion đồng (I) và dung dịch cơ chất BCA màu xanh táo sẽ
có màu hồng nhạt. Cường độ protein.
màu tạo ra sẽ
tỷ lệ
thuận với nồng độ
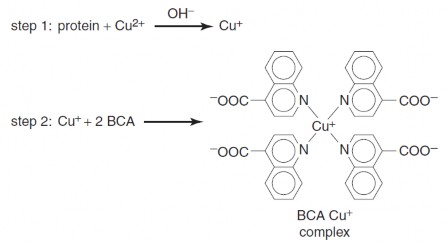
Hình 4.13 Phản ứng xảy ra trong phương pháp BCA.
1.14.6.2 Quy trình
Hòa cuǹ g luć
dung dịch protein với cać
dung dịch cơ chất phan̉ ưń g
BCA, gồm muối BCA natri, carbonat natri, NaOH, sulfat đồng pH 11.25.
Ủ ở nhiệt độ 37 oC thời gian 30 phút hoặc ở nhiệt độ phòng với
thời gian 2 h, hoặc ở 60 oC trong 30 phút. Việc lựa chọn nhiệt độ
phụ thuộc vào độ nhạy mong muốn. Nhiệt độ cao hơn cho tín hiệu màu lớn hơn.
Đo màu dung dịch ở 562 nm đối chiếu với mẫu trắng.
Xây dựng đường chuẩn sử dụng BSA
1.14.6.3 Áp dụng, ưu và nhược điểm:
Phương pháp BCA được dùng cho protein đã được tách và tinh sạch. Chưa có báo cáo nào cho thấy có thể áp dụng phương pháp này để xác định protein trong thực phẩm.
Ưu điểm
Độ
nhạy có thể
so sánh được với phương pháp Lowry; độ
nhạy
của phương pháp micro BCA (0.51.0 pháp Lowry.
g) tốt hơn so vơí phương
Việc hòa trộn các dung dịch phản hơn so với phương pháp Lowry.
ứng 1 lần thực hiện dễ
dàng
Các dung dịch cơ chất phản Lowry.
ứng bền hơn so với
ở phương pháp
Không bị nhiễu bởi các chất tẩy rửa phi ion và các muối đệm.
Các tác nhân gây biến tính protein ở nôǹ g độ vưà HCl 4M hoặc ure 3M) không gây nhiễu.
Nhược điểm
phải (guanidine
Màu sắc không bền theo thời gian. Người phân tích cần chúýcẩn
thận đêń thời gian đọc kêt́ quả đo mật độ quang.
Bất kỳ hợp chất nào có khả năng khử Cu2+ thành Cu+ đều góp phần làm tăng cường độ màu.
Đường khử gây nhiễu ở mức độ nhiều hơn so với ở phương pháp Lowry. Sulfat amon ở nồng độ cao cũng gây nhiễu.
Sự
khác biệt màu sắc giữa các protein cũng tương tự
như ở
phương pháp Lowry.