trên các gen mã hóa cho enzyme GOLS.
C
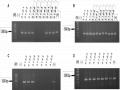
Hình 3.9. Biểu hiện gen GFP chỉ thị trên rễ tơ cây đậu tương
A. Kết quả nhuộm X-Gluc; B. Kiểm tra biểu hiện của GFP dưới kính hiển vi huỳnh quang; C. Mẫu đối chứng không biểu hiện GFP dưới kính hiển vi huỳnh quang
3.2.2. Kiểm tra hoạt động của cấu trúc chỉnh sửa gen CRISPR/Cas9 trên các dòng rễ tơ
Tiến hành kiểm tra hoạt động của hệ thống chỉnh sửa gen CRISPR/Cas9 được thiết kế với hai trình tự RNA định hướng (sgRNA) nhằm tạo đột biến trên hai gen (GmGOLS03và GmGOLS19) mã hóa enzyme galactinol synthase - enzyme tham gia vào quá trình sinh tổng hợp một số loại đường khó tiêu oligosaccharides họ raffinose (raffinose family oligosaccharides – RFOs) [33]. Nguyên liệu sử dụng trong biến nạp là lá mầm 3 ngày tuổi của giống đậu tương ĐT26. Thông qua việc khuếch đại gen
bằng các cặp mồi đặc hiệu của gen bar và gen Cas9, kết quả cho thấy các dòng rễ tơ thu được đều mang gen chuyển (Hình 3.10). Các đột biến xảy ra ở các dòng rễ tơ đậu tương chuyển gen bằng A. rhizogenes K599 mang vector pFGC5941/G03-19 được ghi nhận thể hiện qua sự xuất hiện các băng sai lệch kích thước trên gel polyacrylamide 15% so với mẫu đối chứng không mang gen chuyển (WT).
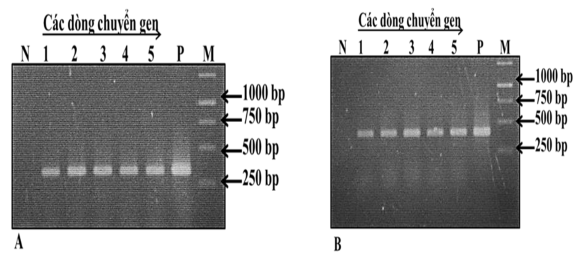
Hình 3.10. Sản phẩm khuếch đại bằng các cặp mồi đặc hiệu được điện di trên gel agarose 1.5% trong đệm TAE 1X
A: sự có mặt của gen bar trong các dòng rễ tơ; B: sự có mặt của gen mã hóa protein Cas9 trong các dòng rễ tơ; N: đối chứng âm (rễ tơ cảm ứng bởi chủng K599 không mang vector chuyển gen), 1-5: các dòng rễ tơ chuyển gen, P: đối chứng dương (plasmid pFGC5941-Gal), M: marker 1 kb ThermoScientific®
Kết quả điện di cho thấy, toàn bộ sản phẩm PCR của mẫu rễ tơ nghiên cứu xuất hiện các băng vạch DNA khác biệt so với rễ tơ không chuyển gen ở cả hai gen quan tâm (Hình 3.103). Điều này khẳng định có những thay đổi trong trình tự các gen quan tâm, đây có thể là kết quả của việc hình thành các đột biến định hướng do hoạt động của hệ thống CRISPR/Cas9.
Để kiểm tra đặc điểm của các đột biến, hai dòng rễ tơ số 3 và 4 được lựa chọn ngẫu nhiên để tiến hành giải trình tự vùng gen quan tâm (Hình 3.11). Kết quả cho thấy các đột biến mất đoạn khác nhau dao động từ -3 bp đến -25 bp đã xảy ra trên vùng định hướng tạo đột biến của hai gen quan tâm (Hình 3.119 và 3.11C).
Như vậy, hệ thống chỉnh sửa gen CRISPR/Cas9 được thiết kế đã hoạt động tốt với hệ thống cảm ứng rễ tơ trên giống đậu tương Việt Nam ĐT26.
Kết quả nghiên cứu cho thấy phương pháp cảm ứng tạo rễ tơ thông qua vi
khuẩn A. rhizogenes đã sử dụng thành công trên hai giống đậu tương có năng suất cao của Việt Nam (ĐT22 và ĐT26), hai giống đậu tương ĐT22 và ĐT26 có khả năng tiếp nhận tốt cả hai cấu trúc chuyển gen pZY102/gus và pFGC/gfp. Trong điều kiện phòng thí nghiệm của phòng Công nghệ tế bào thực vật, hiệu quả chuyển gen thông qua rễ tơ của hai giống đậu tương trong nước thể hiện ưu việt hơn so với hai giống đậu tương nước ngoài. Biểu hiện của gen chuyển cũng như hoạt động của hệ thống chỉnh sửa gen CRISPR/Cas9 đã được kiểm chứng hiệu quả với phương pháp nuôi cấy rễ tơ in vitro.
Hình 3.11. Kết quả phân tích các đột biến ghi nhận trên các dòng rễ tơ đậu tương chuyển gen
A: Phân tích sản phẩm khuếch đại gen GmGOLS03 và GmGOLS19 trên gel polyacrylamide 15% trong đệm TBE 1X theo phương pháp biến tính – hồi tính, các băng sai lệch kích thước chỉ xuất hiện ở các dòng chuyển gen (1-4), (WT) các dòng rễ tơ mang đột biến, M: marker 1 kb ThermoScientific®; B: Trình tự gen GmGOLS03 của các dòng rễ tơ chuyển gen tại vị trí chỉnh sửa đích; C: trình tự gen GmGOLS19 của các dòng rễ tơ chuyển gen tại vị trí chỉnh sửa đích
Như vậy, hệ thống cảm ứng tạo rễ tơ trong điều kiện in vitro sẽ được ứng dụng để đánh giá về cấu trúc chuyển gen và chỉnh sửa hệ gen trên cây đậu tương
trong các nội dung nghiên cứu tiếp theo của luận án. Kết quả này là cơ sở cho việc chuyển các cấu trúc chỉnh sửa hệ gen CRISPR/Cas9 vào cây đậu tương nhằm tạo các dòng đậu tương mang đột biến định hướng trên gen GmGOLS.
3.3 Tạo cây đậu tương đột biến gen mã hóa Galactinol synthase
Sau khi đã xây dựng thành công hệ thống chỉnh sửa hệ gen CRISPR/Cas9 nhằm gây tạo định hướng trên các gen mã hóa enzyme galactinol synthase, chúng tôi đã tiến hành kiểm tra hoạt động của hệ thống này thông qua hệ thống cảm ứng và chuyển gen thông qua rễ tơ. Kết quả khẳng định khả năng hoạt động và tính chính xác của các cấu trúc CRISPR/Cas9 đã thiết kế. Tiếp theo, hệ thống vector này được sử dụng để chuyển vào các giống đậu tương lựa chọn nhằm tạo dòng đậu tương triển vọng mang đột biến định hướng trên các gen quan tâm.
3.3.1. Tạo cây đậu tương chuyển gen thông qua vi khuẩn A. tumefaciens
Giống đậu tương ĐT26 được trồng phổ biến, có khả năng kháng bệnh gỉ sắt, đốm nâu và khả năng chịu ruồi đục thân, chống đổ khá, năng suất cao được đánh giá là giống ưu tú của Việt Nam, là đối tượng nghiên cứu được chọn để tạo cây đậu tương đột biến nhằm tăng chất lượng hạt, ứng dụng trong công tác phát triển giống mới. Giống đậu tương Mr được sử dụng như giống cây mô hình cho quy trình chuyển gen.
Chủng vi khuẩn A. tumefaciens AGL1 mang vector pFGC5941/G03-19 được sử dụng để chuyển gen vào đậu tương thông qua nốt lá mầm hạt trưởng thành của hai giống đậu tương ĐT26 và Mr theo phương pháp đã được tối ưu của Phòng Công nghệ tế bào thực vật - Viện CNSH [87] [90].
Với tổng lượng mẫu biến nạp là 1082, sau 2 lần chọn lọc liên tiếp ở giai đoạn cảm ứng tạo chồi với nồng độ glufosinate 6 mg/l và 3 lần chọn lọc ở giai đoạn kéo dài chồi với nồng độ glufosinate 3 mg/l đã thu được 14 chồi kéo dài với giống ĐT26 và 14 chồi với giống Mr, các chồi đạt chiều cao 2,5–3,5 cm và có các lá chính được cắt sang môi trường tạo rễ. Sau 7-10 ngày, các chồi có bộ rễ hoàn chỉnh được trồng trên giá thể TN1 bổ sung 25% TRiBAT.
Sau quá trình thích nghi sinh trưởng trong buồng sinh trưởng nhiệt độ 28oC, độ ẩm 80%, quang chu kỳ 16 giờ sáng/8 giờ tối, đã thu được tổng số 16 cây đậu tương hoàn chỉnh ngoài giá thể của hai giống nghiên cứu. Kết quả chuyển gen vào đậu tương
được trình bày ở Hình 3.12 và Bảng 3.2.

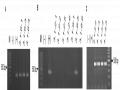
Hình 3.12. Minh họa quá trình chuyển gen vào đậu tương thông qua nốt lá mầm
A. Mảnh lá mầm đồng nuôi cấy 5 ngày, B. Mảnh lá mầm sau 14 ngày chọn lọc,
C. Mảnh lá mầm sau 28 ngày chọn lọc, D. Chồi kéo dài trên môi trường chọn lọc,
E. Lá cây DT 1.1 (+) với ppt 200 mg/l, F. Lá cây ĐT26 (-) với ppt 200 mg/l,
G. Cây chuyển gen 25 ngày tuổi
Bảng 3.2. Kết quả chuyển gen của giống ĐT26 và Mr
Số mẫu biến nạp | Số mẫu tạo đa chồi | Số chồi kéo dài | Số chồi tạo rễ | Số cây sống trên giá thể | |
ĐT26 | 606 | 300 | 14 | 8 | 8 |
Mr | 476 | 289 | 14 | 8 | 8 |
Có thể bạn quan tâm!
-
 Nghiên Cứu Biểu Hiện Gen Và Chỉnh Sửa Hệ Gen Trên Rễ Tơ Đậu Tương
Nghiên Cứu Biểu Hiện Gen Và Chỉnh Sửa Hệ Gen Trên Rễ Tơ Đậu Tương -
 Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9
Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9 -
 Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương
Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương -
 Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2
Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2 -
 Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2
Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2 -
 Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương
Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương
Xem toàn bộ 122 trang tài liệu này.
3.3.2 Sàng lọc cây chuyển gen bằng phết thuốc diệt cỏ và PCR
Việc chuyển gen thành công bước đầu được xác định thông qua phương pháp phết lá với thuốc diệt cỏ glufosinate nồng độ 200 mg/l, sau đó được xác nhận bằng
sàng lọc PCR sự có mặt của trình tự T-DNA sử dụng cặp mồi đặc hiệu cho gen pcoCas9 và vùng mở rộng 35SPPDK – pFGC trong vector chuyển gen, cụ thể tại Bảng phụ lục 1. Các dòng đậu tương T0 được phết trực tiếp glufosinate 200 mg/l trên bề mặt lá. Sau 3 ngày phết thuốc diệt cỏ, phần lá tại vị trí phết của cây đối chứng và một số dòng chuyển gen co lại, mất dần sắc tố xanh lục của lá và chuyển vàng; và sau 5 ngày phết, vị trí lá thử chất diệt cỏ chuyển sang vàng nâu, cháy khô (Hình 3.12F). Bên cạnh đó, một số dòng chuyển gen không xuất hiện dấu hiệu gây hại của chất diệt cỏ tại vị trí thử, lá không bị mất màu màu sắc (Hình 3.12E).
Tổng hợp kết quả sau khi sàng lọc bằng thuốc diệt cỏ, đã thu được 3 dòng đậu tương chuyển gen thế hệ T0 không mẫn cảm với glufosinate 200 mg/l, trong đó có 1 dòng thuộc giống ĐT26 (DT1.1) và 2 dòng thuộc giống Mr (M3.1 và M4.1) (Bảng phụ lục 2). Tất cả các dòng đậu tương phát triển tốt trên giá thể cũng được thu lá và tiến hành kiểm tra bằng phản ứng PCR với các cặp mồi đặc hiệu (Bảng phụ lục 1). Kết quả điện di sản phẩm PCR trên gel agarose 1% cho kết luận tương tự như kết quả sử dụng phương pháp phết lá với thuốc diệt cỏ (Bảng phụ lục 2).
Như vậy, chúng tôi đã chuyển thành công cấu trúc chỉnh sửa hệ gen vào hai giống đậu tương ĐT26 và Mr. Các dòng đậu tương mang cấu trúc CRISPR/Cas9 tiếp tục được sử dụng để xác định và phân tích các đột biến định hướng trên các gen GmGOLS ở các bước tiếp theo.
3.3.3 Xác định và phân tích các đột biến gen thu được trên cây đậu tương chuyển gen T0
Sau khi xác định sự có mặt của hai gen chỉ thị, chúng tôi khuếch đại đặc hiệu vùng gen GmGOLS03 và GmGOLS19 từ DNA các dòng chuyển gen T0 và tiến hành biến tính - hồi tính sản phẩm PCR trên gel polyacrylamide để xác định việc chỉnh sửa các gen định hướng.
Kết quả thể hiện ở Hình 3.13 đã xác định được 03 dòng đậu tương đột biến, trong đó ghi nhận đột biến đồng thời ở cả hai gen đích (GmGOLS03 và GmGOLS19) ở 3 dòng T0 được kiểm tra (D1.1, M3.1, M4.1). Các băng vạch có kích thước khác với băng vạch xuất hiện ở mẫu đối chứng được ghi nhận xuất hiện ở cả ba mẫu T0 được kiểm tra cho cả hai gen, cho thấy hiệu quả cao trong việc chỉnh sửa hệ gen đậu tương sử dụng cấu trúc CRISPR/Cas9 đã thiết kế.
Hình 3.13. Phân tích sản phẩm PCR của các dòng đậu tương đột biến gen thế hệ T0 bằng kỹ thuật biến tính - hồi tính trên gel polyacrylamide 15%.
Mr: cây đối chứng giống Mr; DT: cây đối chứng giống ĐT26; M3.1, M4.1:các dòng đột biến giống Mr; D1.1: dòng đột biến giống ĐT26; M: thang DNA 100 bp.
Các đột biến được phân tích thông qua tách dòng và giải trình tự vùng gen đích ở các cây T0. Tương thích với kết quả phân tích PAGE, dữ liệu giải trình tự cho thấy các đột biến khác nhau được xẩy ra ở hai gen GmGOLS (Hình 3.14). Kích thước của đoạn mất thay đổi từ ∆-7 bp đến ∆-77 bp. Dòng DT1.1 chứa các thể khảm (chimeric) cho cả gen GmGOLS03 và GmGOLS19. Hai mẫu tách dòng mang đột biến mất đoạn lớn (∆-77 và ∆-32 bp) cũng như không đột biến ở gen GmGOLS03 đã được xác định từ dòng DT1.1.
Ngoài ra, chúng tôi cũng tìm thấy alen kiểu dại và hai alen đột biến (∆-7 bp và
∆-23 bp) trong gen GmGOLS19 ở dòng DT1.1. Các đoạn mất dự kiến ở hai gen GmGOLS03 và GmGOLS19 cũng được quan sát thấy ở các dòng đậu tương chuyển gen M3.1 và M4.1 thuộc giống Mr. Điều đáng chú ý là tất cả ba dòng chuyển gen đều chứa đột biến mất đoạn ∆-23 bp giống hệt nhau giữa hai vị trí cắt Cas9 trong gen GmGOLS19. Ngoài ra, hầu hết các dạng đột biến mất đoạn được phát hiện (8/9) đều nằm giữa hai vị trí đích, thể hiện độ chính xác của cấu trúc CRISPR/Cas9 được thiết kế trong việc chỉnh sửa bộ gen đậu tương.
Hình 3.14. Trình tự của các vùng trình tự đích trên gen GmGOLS03 (A) và gen
GmGOLS19 (B) ở cây T0
Các trình tự đích (sgRNAs) được thể hiện bằng màu đỏ, các trình tự PAM được đánh dấu xanh nước biển. DT1.1: dòng đột biến giống ĐT26; M3.1, M4.1: các dòng đột biến giống Mr; a/b/c/d/e: các alen khác nhau ở mỗi dòng T0; ∆ thể hiện sự thay đổi trong trình tự đích: không thay đổi (0),mất nucleotide (-), thêm
nucleotide (+)
Như vậy, kết quả PAGE và phân tích trình tự chỉ ra rằng tất cả các dòng đậu tương chuyển gen T0 (3/3) được tạo ra từ hai giống ĐT26 và Mr đều mang đột biến gây ra bởi CRISPR/Cas9 trong gen GmGOLS03 và GmGOLS19. Ngoài locus