PCR chứng tỏ sự vắng mặt của alen đột biến Δ-22 bp và alen WT của gen GmGOLS03ở các dòng cây này (Hình 3.18C). Tuy nhiên, toàn bộ cây T2 của cả 3 dòng M4.1-2, M4.1-4 và M4.1-5 đều cho thấy băng vạch PCR đặc hiệu cho gen GmGOLS19(Hình 3.18D). Điều này khẳng định sự mặt của alen đột biến Δ-22 bp hoặc alen WT của gen GmGOLS19 trên các dòng cây này.
Kết quả phân tích trên phù hợp với sự phân ly của kiểu gen đột biến đã được xác định ở thế hệ T1 (Bảng 3.3). Tuy nhiên, với chỉ thị phân tử GOLS-seg F chưa phân biệt các dòng mang đột biến đồng hợp tử alen Δ-22 bp và dạng hai alen (Biallelic) -22/-33 bp trên gen GmGOLS03. Thế nên, chỉ thị phân tử GOLS-seg F1 được phát triển để nhận dạng hai dạng đột biến này.
Chỉ thị phân tử GOLS-seg F1
GOLS-seg F1 là chỉ thị phân tử được thiết kế để nhận biết đặc hiệu alen đột biến mất Δ-33 bp trên gen GmGOLS03. Chỉ thị phân tử này được dùng để sàng lọc các alen đột biến mất Δ-33 bp ở các dòng M3.1-2, M3.1-9 và M3.1-6 thuộc thế hệ T2.
Kết quả điện di sản phẩm PCR trên gel agarose 2% với các cây T2 của các dòng lựa chọn được trình bày trên Hình 3.19. Trong đó, toàn bộ cây T2 của dòng M3.1-6 đều có băng vạch DNA đặc hiệu, chứng tỏ sự di truyền của alen đột biến Δ- 33 bp của gen GmGOLS03 ở dạng đồng hợp tử (Hình 3.19A).
Sự di truyền và phân ly của alen này ở dòng M3.1-2 cũng được thể hiện rõ (Hình 3.19B). Sản phẩm PCR của chỉ thị GOLS-seg F1 với mồi G03R không ghi nhận trên các cây T2 của dòng M3.1-2. Kết hợp với kết quả phân tích của chỉ thị phân tử GOLS-seq F, chúng tôi khẳng định toàn bộ các cây T2 của dòng M3.1-2 đều mang kiểu gen đồng hợp tử của alen đột biến Δ-22 bp. Với dòng M3.1-9, các cây T2 (3.1- 9-1 và 3.1-9-6) mang kiểu gen đồng hợp tử của alen đột biến Δ-22 bp. Trong khi đó dòng 3.1-9-5 mang kiểu gen hai alen -22/-33 (biallelic).
Như vậy, với việc sử dụng hai chỉ thị phân tử GOLS-seg F và GOLS-seg F1, kiểu gen của các dạng đột biến Δ -22 bp và dạng đột biến Δ-33 bp có thể được ghi nhận và sàng lọc một cách chính xác.
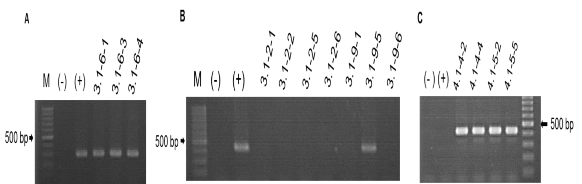
Hình 3.19. Kết quả phân tích sản phẩm PCR của chỉ thị phân tử GOLS-seg F1 và GOLS-seg F3 với các cây đột biến T2
A, B. Sản phẩm PCR khi kết hợp GOLS-seq F1 và mồi đặc hiệu G03 R; C. Sản phẩm PCR khi kết hợp GOLS-seq F3 và mồi đặc hiệu G03 R; (-). Đối chứng âm sử dụng nước cất; (+). Đối chứng dương là DNA đã xác định mang alen -33bp ;
M. Thang DNA chuẩn 100 bp
Chỉ thị phân tử GOLS-seg F3
GOLS-seg F3 được thiết kế để nhận biết đặc hiệu alen đột biến Δ-30 bp của gen GmGOLS03. Các cây đậu tương đột biến T2 của các dòng cây M4.1-4 và M4.1- 5 được kiểm tra sàng lọc bằng kết hợp chỉ thị phân tử GOLS-seg F3 với mồi đặc hiệu G03 R, kết quả được thể hiện trên Hình 3.19 C. Toàn bộ các cây T2 được phân tích đều cho một băng vạch DNA đặc hiệu, trong khi cây WT không ghi nhận sản phẩm PCR trong Hình 3.19 C.
Kết quả này cho thấy tính đặc hiệu của chỉ thị này trong phân tích sự di truyền và phân ly của alen đột biến Δ-30 bp. Tổng hợp kết quả phân tích di truyền và phân ly của các alen đột biến sử dụng 3 chỉ thị phân tử như trên, chúng tôi ghi nhận được kiểu gen của các cây T2 thu được từ các dòng T1 có đặc điểm di truyền khác nhau (Bảng 3.4).
Kết quả phân tích cho thấy việc sử dụng kết hợp các chỉ thị phân tử này có thể chỉ ra được kiểu gen đồng hợp tử, biallelic của các alen đột biến đã ghi nhận ở thế hệ T1. Do số lượng mẫu phân tích chưa đủ lớn, tỉ lệ phân ly ở một số dòng cây T1 còn chưa thể hiện rõ như theo lý thuyết. Tuy nhiên, việc sử dụng thành công các chỉ thị phân tử này trong nhận diện từng alen đột biến riêng lẻ cũng như sự tồn tại của hai dạng alen đột biến khác nhau (biallelic) sẽ là cơ sở quan trọng trong sàng lọc và duy
trì các dòng đột biến với các tính trạng tiềm năng trong các thế hệ tiếp theo ở quy mô và số lượng mẫu lớn hơn.
Cây đột biến T2 | ||
M3.1-2-1 | Homo -22 | WT |
M3.1-2-2 | Homo -22 | WT |
M3.1-2-5 | Homo -22 | WT |
M3.1-2-6 | Homo -22 | WT |
M3.1-6-1 | Homo -33 | Homo -22 |
M3.1-6-3 | Homo -33 | Homo -22 |
M3.1-6-4 | Homo -33 | Homo -22 |
M3.1-9-1 | Homo -22 | Homo -22 |
M3.1-9-5 | Biallelic (-33, -22) | Homo -22 |
M3.1-9-6 | Homo -22 | Homo -22 |
M4.1-2-3 | WT | WT |
M4.1-2-5 | WT | WT |
M4.1-2-8 | WT | WT |
M4.1-4-2 | Homo -30 | WT |
M4.1-4-4 | Homo -30 | WT |
M4.1-5-2 | Homo -30 | Homo-22 |
M4.1-5-5 | Homo -30 | Homo-22 |
Có thể bạn quan tâm!
-
 Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương
Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương -
 Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ
Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ -
 Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2
Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2 -
 Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương
Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương -
 Việc Lựa Chọn Trình Tự Mục Tiêu Trong Thiết Kế Cấu Trúc Chỉnh Sửa Gen Trên Đậu Tương
Việc Lựa Chọn Trình Tự Mục Tiêu Trong Thiết Kế Cấu Trúc Chỉnh Sửa Gen Trên Đậu Tương -
 Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 14
Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 14
Xem toàn bộ 122 trang tài liệu này.
Bảng 3.4 Tổng hợp kiểu gen của các dòng cây T2 sau khi sàng lọc với các chỉ thị phân tử
GmGOLS03
Kiểu gen
GmGOLS19
Ghi chú: Homo. Kiểu gen đồng hợp tử; Biallelic. Hai alen đột biến khác nhau; WT. Alen không đột biến
Nhằm kiểm tra khả năng phân biệt chính xác các dạng đột biến genGmGOLS với các chỉ thị phân tử đã được phát triển, chúng tôi lựa chọn một số dòng cây và tiến hành giải trình tự vùng DNA mang đột biến của hai gen GmGOLS03 và GmGOLS19, kết quả giải trình tự thể hiện ở Hình 3.20.
Kết quả giải trình tự trên hoàn toàn phù hợp với kết quả PCR và điện di trên gel agarose của các chỉ thị phân tử. Trong đó, các cây T2 của dòng M3.1-2 đều mang kiểu gen đồng hợp tử của alen đột biến -22 bp trên gen GmGOLS03. Các dòng cây T2 của dòng M4.1-4 và M4.1-5 mang alen đột biến Δ-30 bp trên gen GmGOLS03 ở dạng đồng hợp tử (Hình 3.20A). Với gen GmGOLS19, hai cây T2 thuộc dòng M4.1- 4 ghi nhận alen WT, trong khi alen đột biến Δ-22 bp xuất hiện ở dạng đồng hợp tử
trên các cây T2 được kiểm tra của dòng M4.1-5 (Hình 3.20B).
Hình 3.20. Kết quả giải trình tự vùng gen đột biến trên các cây T2 từ dòng 3.1 và 4.1 của thế hệ T0 giống Mr
A. Trình tự vùng đột biến trên gen GmGOLS03; B. Trình tự vùng đột biến trên gen GmGOLS19; Target 1(vùng tô vàng) và Target 2(vùng tô xanh): trình tự định
hướng tạo đổi biến bởi hệ thống CRISPR/Cas9; ∆: dạng đột biến; genotype: kiểu gen của các cây đột biến; Homo: kiểu gen đồng hợp tử;
WT: kiểu gen không đột biến
Giống đậu tương Mr được sử dụng như giống mô hình để kiểm chứng quy trình chuyển gen và hoạt động của cấu trúc vector chỉnh sửa gen cũng như phát triển hệ thống chỉ thị phân tử trong sàng lọc các đột biến mất đoạn có kích thước nhỏ. Tuy nhiên, yêu cầu về điều kiện sinh thái cũng như khả năng sinh trưởng của giống đậu tương này không phù hợp tốt với điều kiện canh tác đậu tương ở phía Bắc Việt Nam. Do vậy, để đảm bảo tính hiệu quả và tính chính xác trong việc đánh giá ảnh hưởng của đột biến định hướng trên gen GmGOLS tới sinh trưởng, phát triển và thành phần hạt đậu tương, chúng tôi lựa chọn các dòng đậu tương đột biến có nguồn gốc từ giống
ĐT26 sử dụng cho các phân tích nông sinh học tiếp theo.
3.5 Phân tích sinh trưởng phát triển và thành phần hạt của các dòng đậu tương mang đột biến định hướng
Như đã trình bày bên trên, nhằm phục vụ định hướng chọn tạo giống đậu tương Việt Nam có chất lượng tốt phục vụ công tác gieo trồng và chế biến trong tương lai, luận án tập trung nghiên cứu và phân tích sinh trưởng, phát triển, thành phần hạt của dòng đậu tương đột biến thu được của giống ĐT26 trong điều kiện nhà lưới ở miền Bắc nước ta.
3.5.1. Phân tích sinh trưởng, phát triển và hình thái của các dòng đậu tương mang đột biến
Lựa chọn các cây đậu tương đột biến đồng hợp T2 (thế hệ con của DT1.1-4, DT1.1-5, DT1.1-6, DT1.1-7, DT1.1-14) và cây wild-type ĐT26 để trồng trong điều kiện nhà lưới nhằm phân tích hình thái (Hình 3.21, Hình 3.22).

Hình 3.21. Hình thái của các dòng đậu tương đột biến trồng trong nhà lưới
A. Cây trồng sau 40 ngày; B. Lá của cây trồng sau 40 ngày
Kết quả thực tiễn ghi nhận không có sự khác biệt có ý nghĩa về hình thái cây giữa các dòng đột biến GmGOLS và cây không mang đột biến (WT-wild-type). Cây đột biến và cây WT cũng cho số lóng tương tự nhau (13±1). Số cành cấp 1 có sự thay đổi nhẹ giữa cây WT (5 ± 1) và dòng đột biến (4 ± 1), nhưng sự khác biệt này không có ý nghĩa thống kê (Hình 3.22A). Hơn nữa, chiều dài và chiều rộng lá trung bình của
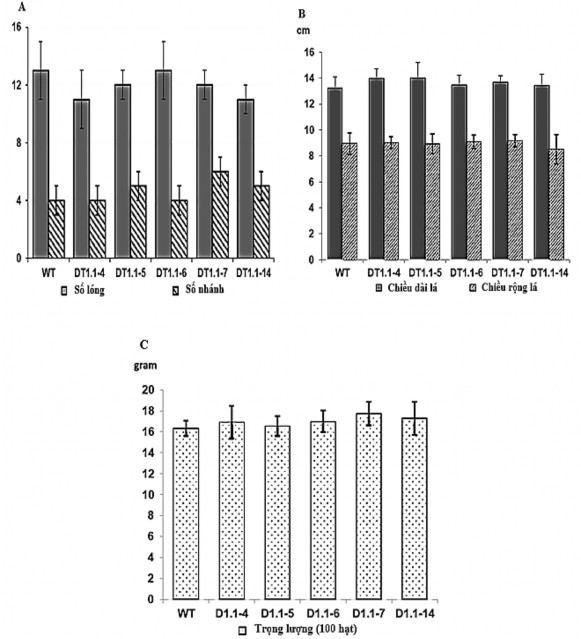
các dòng đột biến cũng tương đương với các cây WT, một lần nữa sự khác biệt này không có ý nghĩa thống kê (Hình 3.22B).
Hình 3.22. Biểu đồ thể hiện sự sinh trưởng và khối lượng hạt của các dòng đậu tương đột biến
Biểu đồ thể hiện sự sinh trưởng (A, B) và khối lượng 100 hạt (C) của các dòng đậu tương đột biến
Trong điều kiện nhà lưới, cây đậu tương đột biến GmGOLS được kiểm tra cho thấy khối lượng hạt không thay đổi so với cây wild-type (Hình 3.22C). Nhìn chung, những dữ liệu này chỉ ra rằng đột biến bất hoạt gen GmGOLS03 và GmGOLS19 không có ảnh hưởng đến sự sinh trưởng và phát triển của cây đậu tương trong điều
kiện nhà lưới.
3.5.2 Phân tích khả năng nảy mầm của các dòng đột biến gen
Theo các nghiên cứu trước đây cho thấy RFOs là nguồn năng lượng ảnh hưởng đến sự hạt nảy mầm của hạt, việc ức chế chuyển hóa RFOs làm giảm đáng kể khả năng nảy mầm của hạt [18]. Để đánh giá sức sống của hạt, các nhà nghiên cứu đã tiến hành thử nghiệm đánh giá khả năng nảy mầm của hạt trong điều kiện bình thường hoặc trong môi trường nhân tạo với các điều kiện nhiệt độ và độ ẩm cao, hay sử dụng phương pháp xử lý với 1-deoxygalactonjirimycin (DGJ) một chất ức chế α- galactosidase để nghiên cứu vai trò của RFOs trong sự nảy mầm của hạt [18].
Trong nghiên cứu này, hạt T3 từ dòng cây DT1.1 đột biến gen đơn GmGOLS03 và đột biến kép GmGOLS03/GmGOLS19 được tiến hành xử lý nảy mầm với nước và theo dõi động thái nảy mầm của hạt sau mỗi 24 giờ (Hình 3.23).
Kết quả tỉ lệ nảy mầm của các hạt trong thí nghiệm được quan sát và ghi nhận: sau 24 giờ, tỉ lệ nảy mầm của dòng cây mang đột biến đơn đạt 29±2% và 23±2% đối với đột biến kép, tỉ lệ này tương đối thấp so với đối chứng đạt 30±5%; sau 48 giờ tỉ lệ nảy mầm đạt 92±7% đối với đột biến đơn và 89±3% đối với đột biến kép vẫn thấp hơn so với hạt đối chứng đạt 94±3%. Tuy nhiên, sự khác biệt này không có ý nghĩa về mặt thống kê. Nhìn chung, tỉ lệ nảy mầm của tất cả các nhóm hạt trên đều ở mức ổn định trên 95% sau 96 giờ thí nghiệm, không tìm thấy sự khác biệt đáng kể nào về khả năng nảy mầm giữa hạt đột biến GmGOLS và hạt đối chứng ĐT26.
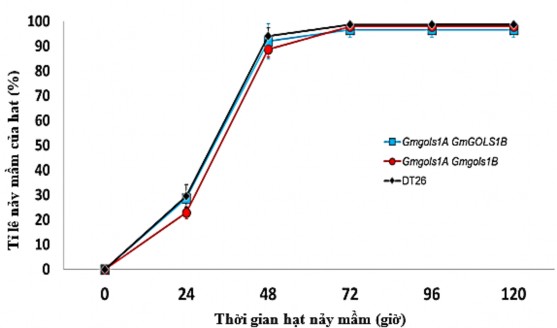
Hình 3.23. Khảo sát khả năng nảy mầm của hạt đậu tương đột biến gen
3.5.3 Phân tích thành phần của hạt của các dòng đậu tương mang đột biến
3.5.3.1 Phân tích các RFOs có trong hạt của các dòng đậu tương mang đột biến
Các nghiên cứu trước đây cho thấy GOLS là enzyme đầu tiên và đóng vai trò quan trọng trong quá trình chuyển hóa galactosyl liên quan đến việc chuyển hóa RFOs và quá trình sinh tổng hợp RFOs ở 20 loài thực vật. Enzyme này chịu sự điều phối của nhóm gen mã hoá GmGOLS [36]. Trên đậu tương có 6 gen mã hóa cho GOLS, trong đó Glyma.03G222000 (GmGOLS03) và Glyma.19G219100 (GmGOLS19 )có biểu hiện mạnh nhất trong quá trình phát triển của hạt (Hình 3.1). Bên cạnh đó, nồng độ RFOs chiếm hơn 50% tổng lượng đường hòa tan có trong hạt đậu tương [9]. Trong nghiên cứu này, bằng kỹ thuật CRISPR/Cas9 đã gây đột biến mất chức năng gen GmGOLS03 và gen tương đồng GmGOLS19, có biểu hiện mạnh nhất trong việc mã hóa cho GOLS. Để đánh giá sự tác động của hai gen này ảnh hưởng đến quá trình sinh tổng hợp nhóm đường RFOs, các thành phần có trong hạt trưởng thành của các dòng đậu tương mang đột biến tiềm năng được tiến hành phân tích.
Kết quả phân tích về thành phần cacbohydrat hòa tan, RFOs tổng số và hàm lượng của các thành phần RFOs (Hình 3.24 và 3.25) có trong hạt các dòng đột biến bằng phương pháp sắc ký lỏng khối phổ cho thấy:
So với hạt đối chứng, hạt của các dòng đột biến được kiểm tra đều có lượng đường RFOs và tổng hàm lượng carbohydrate hòa tan thấp hơn. Sự sụt giảm tổng lượng cacbohydrat hòa tan chủ yếu là do giảm stachyose và sucrose, hai thành phần chiếm 90% tổng lượng cacbohydrat hòa tan được định lượng trong hạt đối chứng.
Hàm lượng stachyose trong hạt của các dòng đột biến đơn gen giảm 41,4% xuống còn 34,86 mg/g khối lượng khô (p < 0,001) và giảm 35,4% xuống còn 38,46 mg/g khối lượng khô ở các dòng đột biến hai gen (p < 0,001) so với ở hạt đối chứng (59,5 mg/g). Tuy nhiên, không có sự khác biệt có ý nghĩa thống kê về hàm lượng stachyose giữa các dòng đột biến đơn gen và hai gen (p = 0,0679).
Hàm lượng sucrose ở hạt của các dòng đột biến đơn gen cũng giảm 25,4% xuống còn 37,4 mg/g khối lượng khô (p < 0,001). Tuy nhiên, ở các dòng đột biến hai gen không ghi nhận được sự thay đổi có ý nghĩa (giảm 9,4% xuống còn 45,4 mg/g, p= 0,1) so với hạt của dòng đối chứng (50,1 mg/g). Hàm lượng các đường thành phần của RFOs cũng ghi nhận được sự khác biệt đáng kể so với dòng đối chứng. Tất cả các dòng đột biến được thử nghiệm đều thể hiện sự tích lũy raffinose tăng lên, trung