trong các trong nghiên cứu nhân nhanh sinh khối tế bào, sinh tổng hợp các hợp chất thứ cấp, biểu hiện gen, phân tích chức năng gen trên nhiều loại cây trồng khác nhau. Trên đậu tương, các phương pháp cảm ứng rễ tơ được phát triển, sử dụng trong nghiên cứu về cơ chế cộng sinh và đặc biệt trong kiểm tra hoạt động của các cấu trúc chuyển gen.
1.4.2. Nghiên cứu biểu hiện gen và chỉnh sửa hệ gen trên rễ tơ đậu tương
Các hệ thống cảm ứng tạo rễ tơ đã được phát triển và tối ưu trên nhiều giống đậu tương khác nhau như Jack [80] William 82 và Zigongdongdou [59]. Cụ thể, CRISPR/Cas9 đã được áp dụng để tạo đột biến trong rễ tơ đậu tương Jack, tỉ lệ đột biến lên đến 95% đã được báo cáo [80]. Tuy nhiên, trong một nghiên cứu khác áp dụng CRISPR/Cas9 trong rễ tơ đậu tương giống William 82, tỉ lệ sửa đổi đã được báo cáo gần mức 54% trong 170 rễ tơ chuyển gen [59]. Gần đây, hệ thống nuôi cấy rễ tơ đã được ứng dụng trong nghiên cứu chức năng gen [81-82], đánh giá hiệu quả biểu hiện của RNAi vector và kiểm tra hoạt động của hệ thống CRISPR/Cas9 [59][80] [83]. So với hệ thống chuyển gen bền vững thông qua vi khuẩn A. tumefaciens, hệ thống cảm ứng rễ tơ thông qua vi khuẩn A. rhizogenes có thời gian chuyển gen ngắn và hiệu quả chuyển gen cao, tiết kiệm được chi phí.
Ở Việt Nam, các nghiên cứu về cảm ứng tạo rễ tơ đã được phát triển và ứng dụng trong nhân nhanh sinh khối của một số loại cây dược liệu. Điển hình như cảm ứng tạo dòng rễ tơ cây đan sâm (Salvia miltiorrhiza Bunge) nhờ vi khuẩn A. rhizogenes ATCC 15834, các dòng rễ tơ tạo ra có khả năng tăng trưởng nhanh và ổn định khi nuôi cấy trong môi trường không bổ sung chất điều tiết sinh trưởng, khối lượng rễ tơ tăng so với khối lượng rễ ban đầu đạt cao nhất (7,67 lần) sau 4 tuần khi nuôi cấy rễ tơ trên môi trường B5 đặc [84]. Hay nghiên cứu ảnh hưởng của các chất điều hoà sinh trưởng và các bộ phận cảm ứng tạo rễ tơ (mô sẹo, lá mầm và rễ cây con in vivo) cây xáo tam phân thông qua việc biến nạp A. rhizogenes K599 đã cho thấy tìm năng của việc ứng dụng phương pháp này trong nhân nhanh và tạo sinh khối ở cây dược liệu [85]. Trong phạm vi nghiên cứu của luận án này, hệ thống cảm ứng rễ tơ được xây dựng nhằm mục đích đánh giá hoạt động của gen chuyển và cấu trúc vector chuyển gen CRISPR/Cas9 trong tạo đột biến gen trên một số giống đậu tương ưu tú của Việt Nam.
1.5. Những nghiên cứu trong và ngoài nước có liên quan trực tiếp đến luận án
Hiện nay trên thế giới, các nghiên cứu điển hình liên quan đến việc thay đổi hàm lượng đường RFOs trong đậu tương bằng các phương pháp chọn dòng, lai tạo đột biến...gần đây nhất là việc ứng dụng công nghệ RNAi bước đầu đã thu được kết quả khả quan. Cụ thể, nghiên cứu của Bilyeu và cộng sự cho thấy giảm biểu hiện của các gen RS2 (Glyma06g18890) mã hóa hai enzyme raffinose synthase và stachyose synthase xúc tác trực tiếp cho phản ứng tạo thành raffinose và stachyose, kết quả làm tăng hàm lượng đường sucrose đồng thời nhóm đường đơn như raffinose và stachyose sẽ giảm xuống. Một số dòng đậu tương mang gen đột biến RS2 được khẳng định có chứa hàm lượng thấp raffinose trong hạt [38]. Nghiên cứu trên dòng đậu tương tạo được bằng công nghệ RNAi nhằm giảm biểu hiện của gen RS2 cũng ghi nhận sự giảm xuống của đường raffinose trong hạt đậu tương và tăng hiệu suất tiêu hóa và hấp thu năng lượng của gia cầm sử dụng loại hạt này [15]. Stachyose synthase là enzyme đóng vai trò quan trọng trong quá trình sinh tổng hợp starchyose. Các dòng đột biến tự nhiên cho thấy sự ức chế hoạt động của enzym này cũng làm tăng lượng đường trong hạt và giảm đáng kể hàm lượng starchyose trong hạt [39]. Điều này cho thấy ý nghĩa quan trọng và mối liên hệ mật thiết giữa các enzyme tham gia quá trình sinh tổng hợp RFOs và hàm lượng các đường RFOs và đường sucrose.
Tuy nhiên, nghiên cứu thay đổi hàm lượng RFOs thông qua việc tác động lên các gen mã hóa cho enzyme GOLS bằng công nghệ CRISPR/Cas9 nhằm giảm hàm lượng đường raffinose trong hạt đậu tương vẫn chưa được nghiên cứu cả trong và ngoài nước. Luận án nghiên cứu đột biến 2 trong 6 gen mã hóa cho enzyme GOLS bằng CRISPR/Cas9, nhằm tác động đến hàm lượng galactinol làm ảnh hưởng quá trình sinh tổng hợp RFOs. Kết quả nghiên cứu của luận án đã cho thấy sự thành công trong việc thiết kế cấu trúc chỉnh sửa gen CRISPR/Cas 9 có khả năng tạo đột biến định hướng trên 2 gen GmGOLS03và GmGOLS19, tạo được các dòng đậu tương mang đột biến định hướng có hàm lượng raffinose thành phần và nhóm đường khó tiêu họ raffinose giảm, đồng thời tăng hàm lượng sucrose trong hạt, thông qua kết quả nghiên cứu đã khẳng định được vai trò của 2 gen GmGOL03 và GmGOL19 đối với việc sinh tổng hợp đường RFOs trong hạt đậu tương.
CHƯƠNG 2
VẬT LIỆU, NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1 Vật liệu nghiên cứu
- Bốn giống đậu tương: Hai giống đậu tương ưu tú của Việt Nam ĐT22, ĐT26 được cung cấp bởi Trung tâm Nghiên cứu và Phát triển đậu đỗ - Viện Cây lương thực và Cây thực phẩm Việt Nam và hai giống đậu tương nước ngoài Maverick (Mr), William82 (WL 82) được cung cấp từ đại học Missouri-Colombia, MO, Hoa Kỳ.
Trong đó giống đậu tương ĐT26 được chọn tạo bởi Trung tâm Nghiên cứu và Phát triển Đậu đỗ thuộc Viện Cây lương thực và Cây thực phẩm – Viện Khoa học Nông nghiệp Việt Nam chọn lọc từ tổ hợp lai giữa ĐT2000 x ĐT12, có khả năng kháng bệnh gỉ sắt, đốm nâu và khả năng chịu ruồi đục thân, chống đổ khá. Giống ĐT26 thích hợp nhất trong vụ đông và vụ xuân và có thể nhân hạt ở vụ hè. Năng suất đạt trung bình ở độ ẩm 12% là 22-28 tạ/ha tùy thuộc vào mùa vụ và điều kiện thâm canh. Trong điều kiện thâm canh cao, ở diện tích hẹp, năng suất có thể đạt tới 30-32 tạ/ha. Trong nghiên cứu này giống đậu tương ĐT26 là giống định hướng cải biến di truyền tạo cây đột biến và ứng dụng phát triển. Giống Maverick (Mr) là vật liệu bổ sung dùng để kiểm tra qui trình chuyển gen đậu tương và giống William82 (WL 82) dùng cơ sở so sánh trình tự gen đích của giống đậu tương thí nghiệm.
- Chủng vi khuẩn A. rhizogenes K599 mang một trong hai cấu trúc chuyển gen pFGC/gfp, pZY102/gus và khuẩn A. tumefaciens AGL1 mang hệ thống vector chuyển gen CRISPR/Cas9 được dùng trong nghiên cứu do phòng Công nghệ tế bào thực vật- Viện Công nghệ sinh học cung cấp.
- Vector HBT-pcoCas9 được cung cấp từ phòng thí nghiệm Jen Sheen (RRID: Addgene_52254), vector pBlu/gRNA được cung cấp từ phòng thí nghiệm của Robert Stupar (RRID: Addgene_59188) và vector pFGC5941 (RRID: Addgene_84084) được cung cấp bởi Phòng thí nghiệm của giáo sư Stacey, Đại học Missouri-Columbia, Hoa Kỳ.
- Các mồi đặc hiệu và DNA oligonucleotide được đặt tổng hợp nhân tạo bởi
công ty TNHH MTV Sinh hóa Phù Sa (Cần Thơ, Việt Nam).
- Trang thiết bị máy móc: nồi hấp khử trùng, máy cất nước 2 lần, tủ âm (-4 đến
-200 C), tủ cấy, máy đo pH, máy ly tâm, máy PCR, pippet các loại... buồng sinh trưởng, nhà lưới, vườn ươm...
- Môi trường và hóa chất: các loại môi trường cơ bản: MS, YEP. Các hoa chất cơ bản: BAP, IAA, GA3...
2.2 Nội dung nghiên cứu
Đề tài nghiên cứu gồm 6 nội dung:
Nội dung 1: Thiết kế hệ thống chỉnh sửa gen CRISPR/Cas9 nhằm gây tạo đột biến gen GmGOLS trên đậu tương.
Nội dung 2: Phát triển hệ thống cảm ứng rễ tơ thông qua vi khuẩn A. Rhizogenes trên một số giống đậu tương Việt Nam, kiểm tra hoạt động của cấu trúc chuyển gen và chỉnh sửa gen CRISPR/Cas9.
Nội dung 3: Tạo cây đậu tương mang đột biến gen mã hóa Galactinol synthase thông qua hệ thống CRISPR/Cas9.
Nội dung 4: Phân tích sự di truyền của các đột biến định hướng và gen chuyển
Nội dung 5: Phân tích sinh trưởng phát triển và thành phần hạt của các dòng đậu tương mang đột biến định hướng.
Nội dung 6: Kiểm tra đột biến ngoài định hướng và lựa chọn dòng đột biến tiềm năng không mang gen chuyển.
2.3 Phương pháp nghiên cứu
2.3.1 Thiết kế vector chuyển gen mang hệ thống CRISPR/Cas9
- Phân tích thông tin về trình tự và biểu hiện gen Galactinol synthase: Dựa trên các nghiên cứu trước đây kết hợp với nguồn dữ liệu mở trên NCBI, Phytozome và SoyKB, trình tự hai gen mã hóa cho enzyme galactinol synthase có mức độ biểu hiện cao trên hạt đậu tương đã được xác định. Sử dụng chương trình tin sinh học (CRISPR- PLANT) và (CRISPR Design Tool), kết hợp với trình tự gen đã được lựa chọn để xác định trình tự định hướng (sgRNAs) theo phương pháp của Vibha Srivastava và cộng sự (2017) [86]. Từ 2-3 trình tự định hướng tối ưu với độ tương đồng cao về trình tự ở trên hai gen quan tâm sẽ được thiết kế. Khung vector chuyển gen thực vật chứa gen Cas9 nhận được từ nguồn Addgene.
- Các cấu trúc bao gồm trình tự định hướng sgRNA của gen mã hoá cho enzyme
Galactinol synthase và promoter U6 (Arabidopsis U6 promoter) được kết nối sử dụng hệ thống cloning vector (NEB® Golden Gate Assembly Kit -BsaI-HF®v2).
- Các cấu trúc mang trình tự định hướng và promoter U6 được ghép nối vào vector chuyển gen pFGC-Cas9 sử dụng hệ thống pFGC-Cas9-gateway được cung cấp bởi phòng thí nghiệm của giáo sư Stacey, đại học Missouri, Mỹ [87]. Cụ thể như sau: Bước 1: Ghép nối phân đoạn gen biểu hiện Cas9 (35S promoter-Cas9-Nos terminator) từ vector HBT-proCas9 sang vector đích pFGC5941 (-) thông qua các phản ứng cắt và nối ghép gen tại vị trí các enzyme cắt hạn chế XhoI và EcoRI, tạo
thành vector pFGC5941(-)/Cas9
Bước 2: PCR khuếch đại các phân đoạn phiên mã các gRNAs bao gồm: PstI/U6 promoter-gRNA1-gRNA scaffold/EcoRI và EcoRI/U6 promoter-gRNA2-gRNA scaffold/PstI bằng phản ứng overlap PCR sử dụng khuôn là vector pBlu-gRNA và các cặp mồi như đã nêu trong bảng phụ lục 1.
Bước 3: Nối ghép đồng thời 2 phân đoạn phiên mã 2 gRNA vào vector pFGC5941(-)/Cas9 tạo thành vector hoàn chỉnh pFGC5941(-)
/Cas9/gRNA1/gRNA2.
+ Xử lý vector pFGC5941(-)/Cas9 bằng PstI.
+ Xử lý đồng thời 2 phân đoạn PstI/U6 promoter-gRNA1-gRNA scaffold/EcoRI và EcoRI/U6 promoter-gRNA2-gRNA scaffold/PstI bằng cặp enzyme hạn chế PstI và EcoRI.
+ Tiến hành phản ứng ligation dưới xúc tác của enzyme T4-DNA ligase nối ghép đồng thời vector pFGC5941(-)/Cas9 đã được mở vòng và 2 phân đoạn gRNA đã xử lý enzyme cắt hạn chế.
Sơ đồ thiết kế của vector chuyển gen hoàn chỉnh được mô phỏng như Hình 3.4.
- Vector chỉnh sửa gen sau khi được hoàn thiện sẽ được chuyển vào chủng vi khuẩn A. rhizogenes và A. tumefaciens AGL1 do phòng Công nghệ tế bào thực vật cung cấp bằng phương pháp sốc nhiệt của David Neece (2013).
2.3.2. Cảm ứng rễ tơ thông qua vi khuẩn A. rhizogenes
Hệ thống rễ tơ được phát triển trong điều kiện in vitro nhằm tối ưu quy trình cảm ứng tạo rễ tơ trên đậu tương phục vụ cho mục đích kiểm tra hoạt động của cấu trúc chuyển gen và hiệu quả chỉnh sửa hệ gen thông qua hệ thống CRISPR/Cas9.
Bảng 2.1 Thành phần các loại môi trường trong nuôi cấy tạo rễ tơ in vitro đậu tương
Thành phần | |
Gieo hạt (GCM) | MS (Murashige and Skoog, 1962); 20 g/l sucrose; 3g/l phytagel, pH 5,6 |
Nuôi cấy khuẩn lạc | YEP (Yeast Extract Peptone); 12 g/l Bacto agar; kháng sinh (streptomycine, spectinomycine và kanamycine nồng độ (500 mg/l) tùy thời điểm, pH 7,0 |
Lây nhiễm | ½ MS; 20 g/l sucrose, pH 5,6 |
Nuôi cấy phát sinh rễ tơ (ICM) | MS; 30 g/l sucrose; 3,0 g/l phytagel; kháng sinh cefotaxime nồng độ (500 mg/l), pH 5,6 |
Chọn lọc rễ tơ | MS; 30 g/l sucrose; 3,0 g/l phytagel; kháng sinh cefotaxime nồng độ (250-500 mg/l); glufosinate (1-3 mg/l) |
Có thể bạn quan tâm!
-
 Tình Hình Sản Xuất Và Chọn Tạo Giống Đậu Tương
Tình Hình Sản Xuất Và Chọn Tạo Giống Đậu Tương -
 Cấu Tạo Và Mối Liên Hệ Của Các Đường Thuộc Họ Raffinose
Cấu Tạo Và Mối Liên Hệ Của Các Đường Thuộc Họ Raffinose -
![Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].
Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51]. -
 Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9
Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9 -
 Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương
Sơ Đồ Minh Họa Cấu Trúc Vector Chỉnh Sửa Gen Crispr/cas9 Được Thế Kế Để Chuyển Gen Vào Đậu Tương -
 Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ
Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ
Xem toàn bộ 122 trang tài liệu này.
Quy trình chuyển gen tạo rễ tơ theo phương pháp nốt lá mầm được xây dựng trên cơ sở nghiên cứu của Chen và cộng sự (2018) [81] có cải biến với thành phần các môi trường sử dụng trong nghiên cứu được trình bày ở Bảng 2.1.
- Chuẩn bị nguyên liệu biến nạp
Hạt đậu tương được chọn dùng làm nguyên liệu biến nạp là những hạt to, tròn đều, vỏ hạt đồng màu, nhẵn, không bị tổn thương; được đặt trong đĩa petri riêng cho từng giống. Các đĩa hạt được mở và đặt trong bình hút ẩm bằng thủy tinh trong tủ hút an toàn sinh học để được khử trùng bằng khí Clo (tạo thành từ 100 ml NaOCl 10% và 4 ml HCl 12N), đóng nhanh nắp bình và niêm phong bằng parafilm ngay sau đó. Hạt giống được khử trùng trong thời gian từ 18-20 giờ tùy theo giống để đảm bảo độ nảy mầm cho hạt.
Đĩa hạt sau khi khử trùng sẽ được đóng nắp và chuyển vào tủ cấy vô trùng. Hạt được gieo với số lượng 5 hạt cho 1 đĩa chứa 20 ml môi trường GCM, điều kiện nuôi cấy 26-28ºC, thời gian chiếu sáng 8 giờ/ngày. Lá mầm được tách từ cây mầm 3 ngày tuổi sẽ được dùng nguyên liệu cho quá trình biến nạp.
- Biến nạp nuôi cấy tạo rễ tơ
Chuẩn bị khuẩn và môi trường lây nhiễm: khuẩn A. rhizogenes gốc lưu trữ trong glycerol 25%, ở -80ºC được cấy trên môi trường tạo khuẩn lạc trong 2-3 ngày ở điều kiện tối, nhiệt độ 28ºC. Tiếp theo, các khuẩn lạc đơn được nuôi cấy trên môi trường nuôi cấy huyền phù vi khuẩn trong điều kiện lắc 250 vòng/phút, nhiệt độ 28ºC, qua đêm. Dịch nuôi khuẩn được ly tâm, thu sinh khối và hòa loãng về mật độ vi khuẩn OD660 đạt mức 0,6 trong môi trường lây nhiễm để tạo huyền phù vi khuẩn dùng cho biến nạp.
Lây nhiễm: sau 3 ngày gieo hạt, thân mầm và cuống lá được loại bỏ. Lá mầm được tách ra và gây tổn thương bằng dao cấy tại vị trí nốt lá mầm để làm nguyên liệu chuyển nạp. Tiếp đến, mẫu được ngâm trong huyền phù vi khuẩn khuẩn thời gian 30 phút. Sau lây nhiễm, mẫu được đồng nuôi cấy trên bề mặt giấy thấm ẩm trong đĩa petri 5 ngày trong điều kiện sáng hoàn toàn ở 24-26ºC.
Cảm ứng tạo rễ tơ: mảnh lá mầm sau khi đồng nuôi cấy sẽ được rửa khuẩn bằng dung dịch nước cất bổ sung cefotaxime nồng độ 500 mg/l và chuyển lên môi trường ICM cảm ứng tạo rễ tơ trong 5 ngày, điều kiện 26ºC, sáng hoàn toàn. Rễ tơ đậu tương có chiều dài từ 1,5-2 cm được cấy chuyển trên môi trường chọn lọc rễ tơ có chứa glufosinate 3,0 mg/l. Hệ rễ phát triển trên môi trường chọn lọc được thu thập và sử dụng cho đánh giá biểu hiện của gen chuyển cũng như các phân tích khác.
2.3.3. Kiểm tra sự có mặt và biểu hiện của gen chỉ thị và gen chọn lọc trong rễ tơ đậu tương
Đối với hệ rễ tơ hình thành từ cấu trúc mang gen chỉ thị gus sẽ được ngâm trong dung dịch X-Gluc và đặt trong tủ ổn nhiệt 37ºC qua đêm theo phương pháp của Jefferson và đồng tác giả [88]. Biểu hiện màu GUS (xanh lam) được quan sát, thống kê và chụp ảnh lưu giữ. Biểu hiện của gen gfp được kiểm tra bằng cách soi trực tiếp bằng kính hiển vi huỳnh quang (Oplympus- U-SPT (Japan-SZ X 12)), đoạn rễ tơ chứa cấu trúc chuyển gen sẽ phát sáng, độ phát sáng tùy thuộc vào biểu hiện của gen gfp. Các dòng rễ tơ in vitro được tách chiết DNA genome theo phương pháp CTAB của Doyle và cộng sự (1991).
Cặp mồi đặc hiệu Bar-F (5’-TACCATGAGCCCAGAACGACGCCC-3’);
Bar-R (5’-TACCATGAGCCCAGAACGACGCCC-3’) được sử dụng kiểm tra sự có mặt của gen chọn lọc bar và cặp mồi Cas9-F (5’- GCCCAAGAGGAACAGCGATAAGC-3’); Cas9-R (5’-CAGTTCGCCGGCA
GAGGCCAGC-3’) được sử dụng để kiểm tra sự có mặt của gen mã hóa protein Cas9 trong cấu trúc chuyển gen có trong rễ tơ in vitro.
Sản phẩm PCR được được kiểm tra và phân tích bằng phương pháp điện di trên gel agarose 1%.
2.3.4. Xác định và phân tích đột biến định hướng trên các gen đích của các dòng rễ tơ đậu tương
Gen đích được khuếch đại bằng phản ứng PCR với cặp mồi đặc hiệu cho
gen GmGOLS03: G03F/R (5’-TGACGGAAATGGCCATGCTCCTG-3’/5’- CCCCGTATATCTCCATGGCTTGG-3’) và gen GmGOLS 19: G19F/R(5’- TCTTGATTGAGTAAGGTGTGAG-3’/5’-GCGCCAGAGCATGGCAAGGAC-
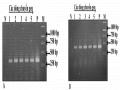
3’). Sản phẩm khuếch đại được điện di trên gel agarose 1% hoặc sử dụng cho phân tích biến tính hồi tính trên gel polyacrylamide 15% theo phương pháp của Zhou và cộng sự (2014) [89]. Cụ thể, các mồi đặc hiệu cho gen GmGOLS03 hoặc GmGOLS19 sẽ được dùng để khuếch đại các dòng có thể mang đột biến và dòng không mang đột biến (WT). Thông qua phương pháp biến tính hồi tính hỗn hợp sản phẩm PCR của các dòng đột biến và WT, các DNA sợi đơn của dòng đột biến và WT sẽ sự kết hợp như Hình 2.2 A, kết quả xuất hiện băng vạch khi điện di trên gel polyacrylamide 15% (Hình 2.2 B).
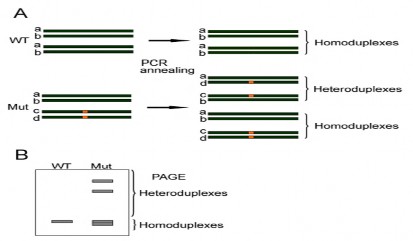
Phương thức tiến hành như sau: (1) PCR độc lập các mẫu mẫu DNA của dòng đậu tương mang gen đột biến và dòng không mang đột biến (WT). (2) Trộn sản phẩm PCR của WT với mỗi dòng đột biến tỉ lệ 1:1. (3) Biến tính hỗn hợp nhiệt độ 950C trong 5 phút, sau đó hạ nhiệt độ về nhiệt độ phòng. (4) Phân tích sản phẩm trên gel polyacrylamide 15%.
Hình 2.1. Sơ đồ minh họa nguyên lý kỹ thuật biến tính hồi tính dùng trong sàng lọc đột biến gen
A. Minh hoạ các sự bắt cặp của các sợi đơn DNA của dòng đột biến và WT khi xử lý biến tính và hồi tính nhiệt; B.Minh họa sản phẩm biến tính và hồi tính trên bản gel
polyacrylamide 15%, vạch màu thể hiện các điểm đột biến trên DNA
Sản phẩm PCR gen đích của các dòng rễ tơ tiếp tục được tinh sạch và chuyển sang vector nhân bản pJET1.2 (Thermo Scientific, Waltham, MA, USA) để giải trình tự bằng hệ thống ABI PRISM® 3100 Avant Genetic Analyzer với bộ giải trình tự


![Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].](https://tailieuthamkhao.com/uploads/2023/02/20/nghien-cuu-ung-dung-cong-nghe-crispr-cas9-trong-tao-dot-bien-gen-gmgols03-5-1-120x90.jpg)