Ngày 2: Cấy vi khuẩn trên bề mặt đĩa thạch MH có nồng độ kháng sinh khác nhau
- Dùng pipet Pasteur hút khoảng 0,5 ml huyền dịch (106 vi khuẩn/ml) cho vào mỗi giếng của bàn đinh, theo sơ đồ đã ghi số của các chủng:
1 | 2 | 3 | 4 | ||
5 | 6 | 7 | 8 | 9 | 10 |
11 | 12 | 13 | 14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 |
23 | 24 | 25 | 26 | 27 | 28 |
29 | 30 | Chủng chuẩn* | Chủng chuẩn* |
Có thể bạn quan tâm!
-
 Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 2
Tỷ lệ nhiễm và mang gen kháng Cephalosporin thế hệ 3 và Quinolon của các chủng Klebsiella gây nhiễm khuẩn hô hấp phân lập tại Bệnh viện Nhi Trung ương, 2009 - 2010 - 2 -
 Các Yếu Tố Làm Cho Vi Khuẩn Không Chịu Tác Dụng Của Thuốc Kháng Sinh
Các Yếu Tố Làm Cho Vi Khuẩn Không Chịu Tác Dụng Của Thuốc Kháng Sinh -
 Đề Kháng Thu Được Không Do Sinh Ra Enzym -Lactamase
Đề Kháng Thu Được Không Do Sinh Ra Enzym -Lactamase -
 Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif)
Hình Ảnh Minh Hoạ Giải Trình Tự Một Đoạn Dna (Nguồn: Sanger Cequencing Read Display.gif) -
 Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn:
Nuôi Cấy, Phân Lập, Xác Định Căn Nguyên Vi Khuẩn: -
 Đặt Khoanh Giấy Kháng Sinh Xác Định Men - Lactamase Phổ Rộng.
Đặt Khoanh Giấy Kháng Sinh Xác Định Men - Lactamase Phổ Rộng.
Xem toàn bộ 134 trang tài liệu này.
* Tùy theo loài vi khuẩn cần xác định MIC để chọn chủng chuẩn sao cho thích hợp
Dùng bộ phiên bản 32 chân đinh chấm vào giếng sau đó đặt lên đĩa thạch MH có các nồng độ kháng sinh khác nhau (nếu không có bộ cấy phiên bản, có thể dùng micropipet nhỏ 2 l/chủng lên mặt đĩa thạch theo sơ đồ).
- Sau khi đặt lên các đĩa thạch, chờ cho đĩa thạch khô (các giọt nước tại các chân đường cấy thấm vào thạch (khoảng 15-20 phút) cất vào tủ ấm 370C/18h, lật úp đĩa thạch. Đối với một số chủng cần thiết phải đặt các đĩa thạch trong điều kiện có C02
Ngày 3: Đọc kết quả
- Trước tiên đọc kết quả ở các đĩa thạch chứng và chủng chứng
- Đọc kết quả, lần lượt đọc từ đĩa thạch có nồng độ kháng sinh thấp nhất. Nồng độ MIC được xác định ở đĩa môi trường mà ở đó các vi khuẩn bị ức chế phát triển, nên mật độ vi khuẩn giảm hẳn chỉ còn 1-3 khuẩn lạc mọc.
- Kết quả MIC của các chủng với mỗi kháng sinh được ghi theo bảng mẫu .
- Ở nồng độ thấp nhất, không có vi khuẩn mọc thì kết quả được ghi nhận là: nhỏ hơn hoặc bằng nồng độ đó (). Trong trường hợp đến nồng độ cao nhất mà vẫn thấy vi khuẩn mọc thì kết quả được ghi nhận là lớn hơn nồng độ đó ().
- Kết quả MIC của các chủng sẽ được xác định theo ba mức độ nhạy cảm, dựa theo bảng chuẩn: nhạy cảm (Susceptible - viết tắt S), trung gian (Intermediate - viết tắt I) hoặc đề kháng (Resistante - viết tắt R).
Kỹ thuật xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn trong môi trường lỏng
Ngày 1: Chuẩn bị chủng( giống như kỹ thuật trong môi trường đặc)
Ngày 2: Cấy vi khuẩn trong môi trường có nồng độ kháng sinh khác nhau
- Pha loãng 0,1ml (100l) canh khuẩn non (sau khi để 370C/18h sẽ có huyền dịch vi khuẩn tương đương 108 vi khuẩn/ml) trong 9,9ml canh thang MH (pha loãng 100 lần để có huyền dịch vi khuẩn tương đương 106vi khuẩn/ml), chia 1,8ml vào các ống nghiệm đường kính 12mm. (Nếu nuôi cấy qua đêm bằng môi trường thạch, lấy vi khuẩn thuần khiết từ môi trường thạch thích hợp hoà vào 3 ml dung dịch đệm PBS hoặc nước muối sinh lý 0,9% để có độ đục bằng độ đục của ống Mc Farland 0,5 – tương đương 108 vi khuẩn/ml, sau đó lại pha loãng 1/100 trong canh thang MH và chia vào các ống nghiệm như trên).
- Thêm 0,2 ml nước cất hoặc nước muối sinh lý vô trùng vào 1 ống nghiệm (chứng âm).
- Thêm 0,2 ml kháng sinh đã pha theo bảng pha các đậm độ kháng sinh ở trên (phần 3.2.1.2.) vào mỗi ống nghiệm, phân phối từ nồng độ kháng sinh thấp nhất đến nồng độ cao nhất. Lắc kỹ từng ống nghiệm.
- Đặt vào tủ ấm 370C/18h. Ngày 3: Đọc kết quả
- Lắc kỹ từng ống nghiệm trước khi đọc kết quả.
- Đọc kết quả ở ống chứng âm trước để kiểm tra xem chủng vi khuẩn có phát triển tốt hay không, nếu vi khuẩn phát triển tốt mới tiếp tục đọc kết quả, nếu không mọc tốt phải làm lại thí nghiệm.
- Đọc kết quả ở các chủng chứng (chủng chuẩn quốc tế), so sánh kết quả MIC của các chủng này với bảng chuẩn.
- Xác định nồng độ MIC: Đọc kết quả bắt đầu từ ống nghiệm có nồng độ kháng sinh thấp nhất. Nồng độ MIC được tính ở ống nghiệm có nồng độ kháng sinh thấp nhất có thể ức chế được sự phát triển của vi khuẩn (bằng mắt thường nhìn thấy nồng độ vi khuẩn mọc thay đổi rõ từ đục nhiều chuyển sang đục ít)
- Kết quả MIC của các chủng với mỗi kháng sinh được ghi theo bảng mẫu
- Trong trường hợp đến nồng độ cao nhất mà vẫn thấy vi khuẩn mọc thì kết quả được ghi nhận là lớn hơn nồng độ đó ().
- Kết quả MIC của các chủng sẽ được so sánh với nồng độ ranh giới để phân biệt 3 mức độ nhạy cảm, kháng hay ở mức độ trung gian: nhạy cảm (Susceptible - viết tắt S), trung gian (Intermediate - viết tắt I), kháng (Resistante – viết tắt R).
Kỹ thuật xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn bằng băng giấy Etest [24], [44]
Etest là một kỹ thuật phối hợp của hai kỹ thuật xác định tính nhạy cảm kháng sinh: kỹ thuật khoanh giấy khuếch tán trên thạch và kỹ thuật pha loãng kháng sinh trong thạch. Etest là kỹ thuật khuếch tán kháng sinh từ băng giấy trên thạch cho phép xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn (MIC). Etest cho kết quả nhanh, rất dễ thực hiện. Đặc biệt thuận lợi cho việc xác định nồng độ MIC của những vi khuẩn khó bảo quản và đòi hỏi nhiều yếu tố trong môi trường phát triển như: H. influenzae, S. pneumoniae, Campylobacter…
Các bước tiến hành
- Chuẩn bị một đĩa thạch MH (đường kính 90mm) đã được láng huyền dịch vi khuẩn giống như các điều kiện trong kỹ thuật khoanh giấy kháng sinh khuếch tán.
- Đặt băng Etest lên đĩa thạch (sau khi lấy băng Etest từ tủ lạnh, nên để ở nhiệt độ phòng 20 phút), phần nồng độ kháng sinh cao nhất gần sát mép hộp lồng, tối đa 6 băng /hộp lồng 90mm.
- Đặt đĩa thạch trong tủ ấm 370C/18-24h, các điều kiện về CO2 tùy theo loại vi khuẩn.
- Đọc kết quả nồng độ MIC: dựa vào vòng ức chế vi khuẩn cắt vào băng giấy ở vị trí nào, đó sẽ là điểm xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn phát triển.
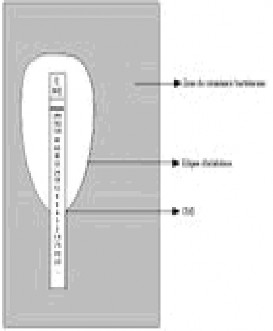
Hình 1.6. Cách xác định kết quả MIC bằng Etest [108]
Vùng vi khuẩn phát triển
Vòng ức chế hình elip Kết quả MIC
1.5.2. Các kỹ thuật xác định cơ chế kháng kháng sinh
1.5.2.1. Kỹ thuật tiếp hợp trên mặt thạch
Kỹ thuật này được thực hiện theo tác giả Kratz (1983).
• Mục đích: xác định khả năng lan truyền các R-plasmid có chứa các gen mã hóa sự kháng kháng sinh qua tiếp xúc trực tiếp.
• Nguyên lý: chủng vi khuẩn hoang dại ban đầu (chủng cho) có chứa các R- plasmid mang các gen mã hoá sự kháng kháng sinh, cho tiếp xúc với chủng chuẩn (chủng nhận) không chứa plasmid và nhạy cảm với các kháng sinh mà chủng cho đề kháng nhưng chứa gen kháng loại kháng sinh khác nằm trên nhiễm sắc thể mà vi khuẩn cho không có. Nếu có sự lan truyền R-plasmid qua tiếp hợp sẽ tạo ra các vi khuẩn thể tiếp hợp có đặc tính: chứa R-plasmid có gen mã hóa sự kháng kháng sinh. Những vi khuẩn này sẽ mọc được trên môi trường chọn lọc có hai kháng sinh: một kháng sinh vi khuẩn cho đề kháng và một kháng sinh vi khuẩn nhận đề kháng.
• Phương pháp:
. Chủng cho: vi khuẩn hoang dại kháng với các kháng sinh
. Chủng nhận: Là chủng chuẩn đã biết trước không có gen kháng trên Plasmid
. Nuôi cấy chủng cho và chủng nhận trong canh thang BHI ở 370C/18h.
. Cấy kiểm tra chủng cho và chủng nhận trên môi trường thạch thích hợp có một kháng sinh để kiểm tra kiểu cách kháng kháng sinh
. Trộn 2 ml vi khuẩn cho và 2 ml vi khuẩn nhận (tỷ lệ 1:1).
. Ly tâm 2000 vòng/phút x 15 phút, lấy cặn (0,1 ml) nhỏ lên đĩa thạch nuôi cấy thích hợp, sao cho không còn dung dịch lỏng trên mặt thạch.
. Ủ 370C/5 h.
. Hoà lại vi khuẩn trên mặt thạch vào 4 ml dung dịch đệm PBS. Lấy 0,2 ml huyền dịch này cấy lên các đĩa môi trường chọn lọc có hai kháng sinh(một vi khuẩn cho kháng và một vi khuẩn nhận kháng).
. Đọc kết quả: các vi khuẩn thể tiếp hợp mọc trên môi trường chọn lọc có hai kháng sinh sẽ cho khuẩn lạc có mầu đặc chưng của vi khuẩn nhận.
. Kiểm tra kiểu cách đề kháng của vi khuẩn thể tiếp hợp bằng kỹ thuật sao chép.
. Kiểm tra tính chất sinh vật hóa học của vi khuẩn thể tiếp hợp trên môi trường sinh vật hóa học (nó phải mang đầy đủ đặc tính sinh vật hóa học của chủng nhận là E.coli):
Glucose: + H2S :
Lactose: + Hơi : +
Ure : Indol: +
Manit: + Di động: +
Simmon citrat: LDC:
1.5.2.2. Kỹ thuật PCR (Polymerase Chain Reaction) [40].
Kỹ thuật PCR được Karl Mullis người Mỹ thực hiện vào năm 1985
Phương pháp tiến hành: Phản ứng PCR là một chuỗi nhiều chu kỳ nối tiếp nhau, mối chu kỳ gồm 3 bước:
- Bước 1: Là giai đoạn biến tính (denaturation).
- Bước 2: Giai đoạn bắt cặp (annealing-Ta).
- Bước 3: Giai đoạn tổng hợp hay kéo dài (extension).
Sau mỗi chu kỳ các chuỗi DNA mới tạo thành tiếp tục được dùng làm khuôn cho sự tổng hợp các DNA mới trong chu kỳ tiếp theo. Sản phẩm cuối của sản phẩm PCR là những
đoạn DNA chuỗi đôi có chiều dài bằng khoảng cách giữa hai đoạn gen mồi và hai đầu tận cùng của sản phẩm được xác định bởi đầu tận 5' của 2 đoạn gen mồi.
Sản phẩm PCR được kiểm tra trên gel agarose 1,5-3%, chạy cùng với marker để so sánh đối chiếu độ lớn của đoạn DNA cần quan tâm.
*PCR đa thành phần (multiplex PCR): là phương pháp PCR sử dụng đồng thời nhiều cặp mồi đặc hiệu khác nhau để nhân các đoạn DNA đặc trưng khác nhau trên một phân tử DNA hoặc trên các phân tử DNA khác nhau [40], [105].
1.5.2.3. Phương pháp Real-Time PCR [40], [105]
Ngoài 2 phương pháp như giải trình tự gen và PCR, hiện nay nhiều tác giả đã sử dụng phương pháp Real-Time PCR để phát hiện các đột biến gen. Trong kỹ thuật PCR sau khi hoàn tất khuếch đại đoạn DNA đích, phải điện di sản phẩm PCR trên gel agarose để kiểm tra xem có vạch sản phẩm khuếch đại đúng kích thước hay không? Còn Real-time PCR là kỹ thuật PCR mà kết quả khuếch đại DNA đích hiển thị được ngay sau mỗi chu kỳ nhiệt của phản ứng. Do đặc điểm này nên người làm thí nghiệm không cần phải làm tiếp các bước thí nghiệm khác để xác định có sản phẩm khuếch đại đích hay không. Như vậy có thể nói Real-time PCR là kỹ thuật nhân bản DNA đích trong ống nghiệm thành tỷ bản sao dựa vào các chu kỳ nhiệt và kết quả khuếch đại trong ống phản ứng được hiển thị cùng lúc với phản ứng khuếch đại xảy ra để người làm thí nghiệm có thể thấy được. Tuy vậy, kỹ thuật này đòi hỏi phải có một hệ thống thiết bị máy móc hiện đại, độ tin cậy cao thì kết quả mới chính xác.
Scort và cs (2006), Mitrofanov và cs (2008), sử dụng phương pháp Real-Time PCR để phát hiện các đột biến 185delAG; 5382insC trên gen BRCA1 và 6174delT gen BRCA2 ở người Ashkenazi . Kết quả thể hiện ở hình 1.8
Hình 1.7. Phát hiện các đột biến 158delAG, 5382insC và 6174delT bằng Real-Time PCR (Scort và cs, 2006).
1, Số chu kỳ của phản ứng PCR; 2, Chu kỳ nhiệt các đột biến và dạng bình thường
1.5.2.4. Kỹ thuật phương pháp lai phân tử [40 ], [105]:
ADN đã khuếch đại bằng PCR được mở vòng xoắn, phân tách thành sợi đơn và cắt bằng enzym giới hạn nuclease (enzym cắt đặc hiệu cho ADN);i) điện di xung trường (PFGE) để tách các đoạn ADN đã bị cắt; ii) Các đoạn ADN được chuyển sang màng lai nitrocellulose; iii) Các đoạn ADN trên màng được lai với mẫu dò đặc hiệu dựa theo nguyên lý bổ xung ADN; iv) Cố định và phát hiện sự có mặt của phân tử lai ADN- mẫu dò được đánh dấu bằng biotin với mối liên kết chắc chắn với avadin. Avadin hỗn hợp với phosphatase kiềm dưới tác dụng của chất nền sinh mầu tạo ra mầu tím của sản phẩm.
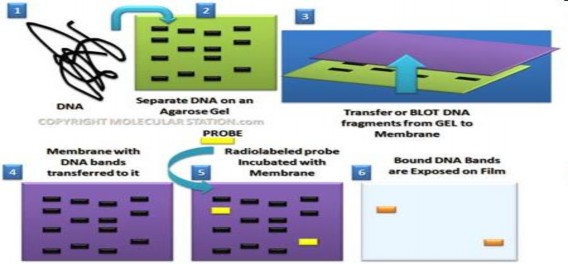
Hình 1.8. Kỹ thuật Southern Blot
1.5.2.5. Kỹ thuật giải trình tự gen
Từ những năm 1977 một số phương pháp giải trình tự gen đã được phát minh như: Giải trình tự gen theo phương pháp hóa học (Alan Maxam và Walter Gilbert) và giải trình tự gen bằng enzyme hay phương pháp Dideoxy (Frederick Sanger 1977).
Nguyên lý chung của hai phương pháp là đều tạo ra các đoạn oligonucleotide có chiều dài khác nhau và có xác suất xuất hiện như nhau trong phản ứng. Sau đó các trình tự này được phân tích bằng điện di trên gel polyacrilamid và kết quả được đọc trên bản phóng xạ tự ghi hoặc nhờ máy dò tự động.
Máy giải trình tự gen tự động được thiết kế trên nguyên tắc sử dụng dideoxynucleotid (dNTP). Với các máy thế hệ sau này người ta dùng 4 màu huỳnh quang khác nhau để đánh dấu 4 loại dNTP. Nhờ vậy phản ứng giải trình tự có thể thực hiện trong một ống nghiệm và chỉ cần điện di trên 1 hàng chứ không phải trên 4 hàng như trước đây. Đối với phương pháp này, mỗi khi có một vạch điện di đi qua, phân tử dNTP cuối cùng ở đầu 3’ của đoạn DNA sẽ phát ra một màu huỳnh quang tương ứng, máy sẽ ghi nhận màu sắc và chuyển về máy tính phân tích. Dựa vào màu huỳnh quang, máy sẽ nhận diện được các nucleotid, từ đó biết được trình tự của DNA đích [17]. Phương pháp này giúp phát hiện chính xác các đột biến xuất hiện ở gen BRCA1 và BRCA2.