Glyma.19G219100, Glyma.03G229800, Glyma.20G094500, Glyma.10G145300,
Glyma.19G227800) được nhóm lại cùng nhau tạo thành ba cặp tương đồng là AtGOLS1, AtGOLS2 và AtGOLS3. Trong đó, biểu hiện của Glyma.03G222000 (GmGOLS03) tăng mạnh khi hạt chín và cho thấy mức độ biểu hiện ở hạt cao nhất trong số tất cả các gen GmGOLS [91]. Gen GmGOLS03 kích thước 2478 bp nằm trên chromosome 3 gồm 3 exon mã hóa cho đoạn polypeptide 339 axit amin. Glyma.19G219100 (GmGOLS19) kích thước 2176 bp nằm trên chromosome 19 gồm 3 exon mã hóa cho đoạn polypeptide 339 axit amin. Bên cạnh đó, gen GmGOLS19 có mức độ biểu hiện tương đương với gen GmGOLS03 ở đầu giai đoạn phát triển của hạt (tức là cho đến giai đoạn R6) nhưng giảm xuống ở các giai đoạn phát triển sau. Các dữ liệu này chỉ ra rằng gen GmGOLS03 có khả năng là gen mã hóa chính cho enzyme galactinol synthase tham gia vào quá trình sinh tổng hợp RFOs trong quá trình phát triển hạt đậu tương. Do đó, trong nghiên cứu này, chúng tôi đã gây đột biến genGmGOLS03 và gen tương đồng với gen GmGOLS03 là gen GmGOLS19 bằng hệ thống CRISPR/Cas9 để kiểm tra chức năng của GmGOLS trong quá trình sinh tổng hợp RFOs trong hạt đậu tương.
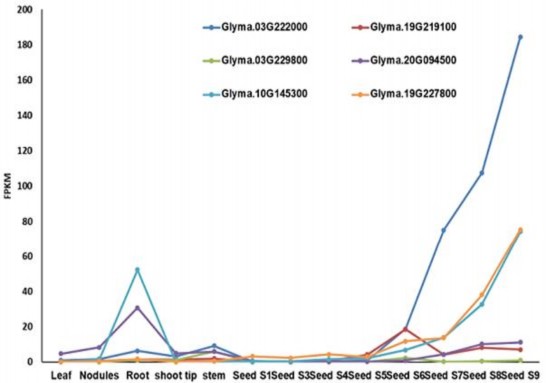
Hình 3.2. Phân tích transcriptomics cho GOLS trong đậu tương
Dữ liệu được lấy từ atekb.org
Căn cứ vào dữ liệu của thí nghiệm trước, chúng tôi đã chọn một giống đậu tương
ưu tú của Việt Nam (ĐT26) và giống Mr làm vật liệu để gây đột biến có mục tiêu. Sử dụng trình tự bộ gen giống đối chứng Williams 82 và kết quả giải trình tự sơ bộ cho thấy các trình tự các gen GmGOLS03 và GmGOLS19 trong giống Mr và ĐT26 tương đồng 100% với các trình tự tương ứng trong bộ gen giống đối chứng William 82 [92]. Dựa trên các trình tự đã khai thác được trên hai giống vật liệu, hai trình tự
RNA định hướng (sgRNAs) đã được chọn từ các vị trí đích tiềm năng trên GmGOLS03 và GmGOLS19. Hai trình tự đích này giống nhau và nằm trong exon 2 của cả hai gen GmGOLS (Hình 3.3A và 3.3B)
Hình 3.3. Cấu trúc gen GmGOLS và vị trí của các trình tự gRNA
A. Trình tự sgRNA và PAM trên gen đích; B. Cấu trúc gen GmGOLS03,
GmGOLS19, vị trí các gRNA và vị trí các cặp mồi sử dụng trong phân tích xác định các đột biến.
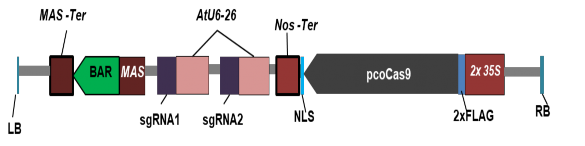
Sau khi xác định được các sgRNA, trình tự mã hóa các sgRNA này được tổng hợp nhân tạo và ghép nối vào vector chuyển gen đã chứa trình tự mã hóa protein Cas9 để tạo thành cấu trúc chuyển gen hoàn chỉnh như Hình 3.4.
Hình 3.4. Sơ đồ minh họa cấu trúc vector chỉnh sửa gen CRISPR/Cas9 được thế kế để chuyển gen vào đậu tương
3.2 Kiểm tra hoạt động của cấu trúc chuyển gen và chỉnh sửa gen CRISPR/Cas9 thông qua hệ thống cảm ứng rễ tơ
Như đã đề cập ở bên trên, nhằm kiểm tra và đánh giá khả năng tạo đột biến định hướng trên gen quan tâm của các cấu trúc CRISPR/Cas9 đã thiết kế được, chúng tôi tiến hành thiết lập hệ thống chuyển gen thông qua rễ tơ trên một số giống đậu tương lựa chọn. Tiếp theo, các cấu trúc chỉnh sửa gen sẽ được chuyển vào các dòng rễ tơ và đánh giá khả năng gây tạo đột biến. Mục đích của công việc này là đảm bảo khả năng hoạt động và tính hiệu quả của các cấu trúc đã thiết kế trước khi tiến hành chuyển gen ổn định vào các giống đậu tương lựa chọn để tạo dòng đột biến định hướng.
3.2.1 Phát triển hệ thống cảm ứng tạo rễ tơ trong điều kiện in vitro trên một số giống đậu tương
Để ứng dụng hệ thống cảm ứng rễ tơ trong nghiên cứu hoạt động của cấu trúc chuyển gen và chỉnh sửa hệ gen trên giống đậu tương Việt Nam, chúng tôi phát triển và tối ưu hóa quy trình cảm ứng tạo rễ tơ in vitro trên cơ sở các điều kiện tại phòng thí nghiệm trong nước.
3.2.1.1 Đánh giá hiệu quả cảm ứng rễ tơ của một số giống đậu tương
Quá trình xây dựng hệ thống cảm ứng tạo rễ tơ trong điều kiện in vitro được tiến hành cho hai giống đậu tương có nguồn gốc ngoài nước là Williams 82 (WL82), Marverick (Mr) và hai giống đậu tương được trồng phổ biến tại Việt Nam là giống ĐT22, ĐT26. Chủng vi khuẩn A. rhizogenes K599 mang một trong hai cấu trúc chuyển gen (pZY102/gus, pFGC/gfp) được sử dụng trong các thí nghiệm chuyển gen vào rễ tơ đậu tương. Kết quả ghi nhận về chỉ tiêu tỉ lệ mẫu tạo rễ tơ sau 5 ngày nuôi cấy trên môi trường cảm ứng tạo rễ cho thấy, cả bốn giống đậu tương thí nghiệm được biến nạp khuẩn K599- pFGC/gfp có tỉ lệ mẫu phát sinh rễ tơ đạt mức cao (Hình 3.5).
Quan sát mẫu đặt trên môi trường cảm ứng tạo rễ, tại vị trí tạo tổn thương nhận thấy, mô sẹo cảm ứng sinh rễ xuất hiện ngay ở ngày thứ nhất (Hình 3.6). Sau 5 ngày cảm ứng tạo rễ, tỉ lệ tạo rễ tơ từ cấu trúc mang gen gfp trên giống ĐT22 đạt 100% và WL82 đạt 98,33% (Hình 3.7). Trong khi đó, tỉ lệ này của giống Mr là 95% và ĐT26 chỉ đạt 93,33%. Với cấu trúc mang gen chỉ thị gus, tỉ lệ tạo rễ tơ cao nhất của hai giống ĐT22 và WL82 khi biến nạp chỉ đạt mức 95%. Tỉ lệ này giảm xuống 88,33% với giống ĐT26 và 61,67% ở giống Mr. Kết quả này cho thấy giống đậu tương cũng
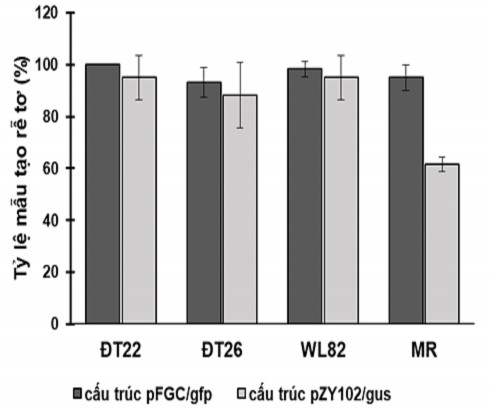
như cấu trúc chuyển gen có ảnh hưởng trực tiếp tới tỉ lệ mẫu tạo rễ tơ in vitro trong biến nạp sử dụng vi khuẩn A. rhizogenes (Hình 3.5 và Hình 3.7).
Hình 3.5. Tỉ lệ tạo rễ tơ của các giống đậu tương chuyển gen
Cấu trúc pZY102/gus mang gen chỉ thị gus; cấu trúc pFGC/gfp mang gen chỉ thị gfp
Hình 3.6. Cảm ứng tạo rễ tơ của các giống đậu tương thí nghiệm với cấu trúc pFGC/gfp trên môi trường đồng nuôi cấy
A. Mô sẹo hình thành tại vị trí tổn thương sau thời gian đồng nuôi cấy; B. Rễ tơ cảm ứng trên môi trường tạo rễ

Hình 3.7. Cảm ứng tạo rễ tơ của các giống đậu tương thí nghiệm với cấu trúc pFGC/gfp sau 5 ngày trên môi trường cảm ứng tạo rễ
A. Rễ tơ của giống Mr; B. Rễ tơ giống ĐT26; C. Rễ tơ giống WL82;
D. Rễ tơ giống ĐT22
Bên cạnh đó, số rễ tơ trung bình của hai giống đậu tương trong nước ĐT22 và ĐT26 cho thấy sự khác biệt có ý nghĩa về mặt thống kê so với hai giống nước ngoài WL82 và Mr. Sau 10 ngày nuôi cấy trên môi trường cảm ứng tạo rễ tơ, giống ĐT22 và ĐT26 biến nạp với khuẩn mang cấu trúc pZY102/gus có số rễ tơ trung bình đạt lần lượt là 38,32 và 30,67 rễ/mẫu; và biến nạp với khuẩn mang cấu trúc pFGC/gfp số rễ tơ trung bình đạt là 35,13 rễ/mẫu và 31,03 rễ/mẫu.
Trong khi đó, giống đậu tương Mr và WL82 có số rễ tơ trung bình tạo ra thấp khi biến nạp với cả hai chủng khuẩn thí nghiệm. Cụ thể, số rễ trung bình thấp nhất thu được ở giống WL82 với 20,3 rễ/mẫu khi biến nạp với cấu trúc pZY102/gus và 18,32 rễ/mẫu với cấu trúc pFGC/gfp.
Tổng hợp kết quả trên cho thấy giống đậu tương ĐT22 tỉ lệ ra rễ cũng như số rễ tơ trung bình được tạo ra từ quá trình cảm ứng chuyển ở cả hai cấu trúc pZY102/gus và pFGC/gfp đạt tỉ lệ cao nhất. Hiệu quả cảm ứng tạo rễ tơ in vitro thấp nhất là giống WL82.
Từ kết quả nghiên cứu của thí nghiệm này, quy trình cảm ứng tạo rễ tơ in vitro
cho các giống đậu tương nghiên cứu được thiết lập như Hình 3.8.

Hình 3.8. Quy trình cảm ứng tạo rễ tơ in vitro trên các giống đậu tương thí nghiệm
A. Khử trùng hạt bằng khí Clo, thời gian 16-20 giờ; B. Hạt nảy mầm trên môi trường MS sau 04 ngày, trong điều kiện nhiệt độ 26ºC, ánh sáng 8 giờ/ngày; C.
Lá mầm sau khi tạo tổn thương và nhiễm khuẩn; D. Đồng nuôi cấy mẫu lá mầm trong 5 ngày trên giấy thấm ẩm; E. Cảm ứng tạo rễ tơ đậu tương từ lá mầm; F. Rễ tơ hình thành; G. Rễ tơ phát triển sau 10 ngày trên môi trường cảm ứng tạo rễ
Chuẩn bị
- Hạt khử trùng khí Clo (18-20 giờ). Gieo hạt trên MS (3-4 ngày).
- Vi khuẩn: nuôi khuẩn lạc trên thạch 48 giờ, chuyển sang nuôi phục hồi OD660 = 0,8-1 từ 6-8 giờ. Nuôi huyền phù khuẩn qua đêm OD660 = 0,8-1, ly tâm 3500 vòng/10 phút, thu và hoà cặn ½ MS khuẩn dùng biến nạp
Cảm ứng tạo rễ tơ
- Mẫu hạt nảy mầm: cắt và tách 2 lá mầm, hủy phần chồi mầm, tạo tổn thương mặt trong lá mầm dọc theo phần trụ mầm. Ngâm mẫu với dịch hoà khuẩn trong 30 phút
- Đồng nuôi cấy: chuyển mẫu lên đĩa peptri chứa giấy thấm ẩm, nuôi cấy trong điều kiện sáng 8 tiếng/ngày, nhiệt độ 24-260C.
- Tạo rễ tơ: sau 5 ngày đồng nuôi cấy, chuyển mẫu lên môi trường nuôi cấy tạo rễ tơ tiếp tục nuôi cấy trong điều kiện sáng hoàn toàn, nhiệt độ 24-260C, 5-10 ngày theo dõi sự xuất hiện của rễ
Thu rễ và kiểm tra sự có mặt của gen chuyển
5-10 ngày theo dõi sự xuất hiện của rễ
3-4 ngày
5 ngày
5-10 ngày
13-19 ngày
Các bước chi tiết của quy trình cụ thể như sau:
3.2.1.2 Đánh giá biểu hiện của gen chuyển trên các dòng rễ tơ đậu tương
Sau khi hoàn thiện quy trình cảm ứng tạo rễ tơ, chúng tôi tiến hành kiểm tra khả năng nhận gen chuyển của các dòng rễ tơ sử dụng các gen chỉ thị màu (gen gus) và chỉ thị huỳnh quang (gfp). Các vector mang gen chỉ thị được chuyển vào vi khuẩn
A. rhizogenes và sử dụng cho chuyển gen vào rễ tơ của các dòng đậu tương nghiên cứu. Các dòng rễ tơ hình thành sẽ được sử dụng cho các phân tích hóa sinh và phân tử tiếp theo.
Kiểm tra, đánh giá sự có mặt của gen chỉ thị trong rễ tơ đậu tương được nuôi cấy trên môi trường chọn lọc
Đánh giá sự phát triển của rễ tơ in vitro trên môi trường chọn lọc: rễ tơ của bốn giống đậu tương được biến nạp gen với cấu trúc pZY102/gus và pFGC/gfp được cắt thành từng đoạn có chiều dài từ 1,5-2 cm và nuôi cấy trên môi trường chọn lọc chứa hoạt chất chọn lọc glufosinate (1-3 mg/l) để đánh giá sự có mặt và hoạt động của gen chuyển, do các cấu trúc chuyển gen đều có chứa gen bar kháng thuốc trừ cỏ.
Tỉ lệ mẫu rễ tơ sống và có biểu hiện gen chỉ thị được thu thập sau 5 ngày nuôi cấy được ghi nhận ở bảng 3.1. Số liệu thống kê ở bảng 3.1 cho thấy, rễ tơ của hai giống đậu tương ĐT22 và ĐT26 được biến nạp với cấu trúc pZY102/gus và pFGC/gfp có tỉ lệ sống cao trên môi trường chọn lọc chứa glufosinate. Trong đó, giống ĐT26 có tỉ lệ sống đạt 91,67% đối với cả với cấu trúc pZY102/gus và pFGC/gfp. Thêm vào đó, chiều dài trung bình của rễ tơ từ giống ĐT26 biến nạp cấu trúc chuyển gen pZY102/gus là 4,67 cm và với cấu trúc biến nạp pFGC/gfp là 3,79 cm. Như vậy, giống đậu tương của Việt Nam ĐT26 có rễ tơ tăng trưởng nhanh hơn giống Mr ở cả hai cấu trúc chuyển gen, cụ thể đạt 2,39 cm với pZY102/gus và 2,15 cm với pFGC/gfp (Bảng 3.1).
Bên cạnh đó, giống ĐT22 cũng cho kết quả sống tốt trên môi trường chọn lọc, đạt tỉ lệ sống 81,48% với cấu trúc pZY102/gus và 89,26% với cấu trúc pFGC/gfp. Tuy nhiên, chiều dài trung bình của rễ trên môi trường chọn lọc của giống ĐT22 biến nạp pZY102/gus và pFGC/gfp đều ngắn hơn so với giống ĐT26 (Bảng 3.1).
Hai giống đậu tương nhập nội WL82 và Mr có hệ rễ tơ phát triển kém trên môi trường nuôi cấy chứa glufosinate ở cả hai cấu trúc chuyển gen pZY102/gus và pFGC/gfp. Cụ thể, tỉ lệ mẫu sống trên môi trường chọn lọc của giống WL82 mang cấu trúc pZY102/gus đạt 60% và ở giống Mr chỉ đạt 50%. Mặc dù ở cấu trúc chuyển
gen pFGC/gfp, giống Mr cho tỉ lệ rễ sống đạt 75% nhưng vẫn thấp so với hai giống đậu tương của Việt Nam.
Bảng 3.1 Tỉ lệ mẫu sống và các mẫu biểu hiện gen chỉ thị trên môi trường chọn lọc
Tỉ lệ rễ sống trên môi trường chọn lọc (%) | Tỉ lệ rễ có biểu hiện gen chỉ thị (%) | Số rễ trung bình tạo thành (rễ/mẫu) sau 10 ngày nuôi cấy | Chiều dài trung bình của rễ trên môi trường chọn lọc (cm) | |||||
Cấu trúc Giống | pZY102/ gus | pFGC/ gfp | gus | gfp | pZY102 /gus | pFGC/ gfp | pZY102/ gus | pFGC/ gfp |
ĐT22 | 81,48a | 89,26a | 68,10a | 76,05a | 38,32a | 35,13a | 2,57b | 2,88b |
ĐT26 | 91,67a | 91,67a | 72,33a | 79,80a | 30,67ab | 31,03ab | 4,67a | 3,79a |
WL82 | 60,00b | 48,15b | 38,07b | 43,80b | 20,30c | 18,32c | 2,43b | 2,77b |
Mr | 50,00b | 75,00a | 40,27b | 45,83b | 28,20bc | 26,06b | 2,39b | 2,15b |
Có thể bạn quan tâm!
-
![Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].
Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51]. -
 Nghiên Cứu Biểu Hiện Gen Và Chỉnh Sửa Hệ Gen Trên Rễ Tơ Đậu Tương
Nghiên Cứu Biểu Hiện Gen Và Chỉnh Sửa Hệ Gen Trên Rễ Tơ Đậu Tương -
 Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9
Chuyển Gen Tạo Cây Đậu Tương Mang Cấu Trúc Crispr/cas9 -
 Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ
Kiểm Tra Hoạt Động Của Cấu Trúc Chỉnh Sửa Gen Crispr/cas9 Trên Các Dòng Rễ Tơ -
 Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2
Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2 -
 Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2
Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2
Xem toàn bộ 122 trang tài liệu này.
Ghi chú: Trong cùng một cột, các số có chữ theo sau giống nhau thì khác biệt không có ý nghĩa thống kê theo phép thử Duncan 1 %, mức 0,05.
Trong nghiên cứu này, lá mầm đậu tương 3 ngày tuổi được dùng làm nguyên liệu biến nạp gen, toàn bộ phần cuống lá mầm được loại bỏ trước khi tạo tổn thương và nhiễm khuẩn. Hiệu quả cảm ứng tạo rễ tơ và tỉ lệ chuyển gen có biến động giữa các giống đậu tương nghiên cứu (Bảng 3.1 và Hình 3.5). Tỉ lệ chuyển gen cao nhất mà thí nghiệm thu được là 79,8% với giống ĐT26 khi sử dụng cấu trúc mang gen gfp. Tỉ lệ cảm ứng tạo rễ tơ cũng đạt trên 90% với giống đậu tương này.
Như vậy, cũng giống như nghiên cứu phát triển rễ tơ trong điều kiện in vivo, chúng tôi nhận thấy, yếu tố giống có ảnh hưởng trực tiếp tới hiệu quả cảm ứng tạo rễ tơ và chuyển gen. Bên cạnh đó, tuổi lá mầm cũng như cách thức chuẩn bị mẫu lá mầm khi lây nhiễm khuẩn cũng đóng vai trò quan trọng tới hiệu quả chuyển gen thông qua rễ tơ trên đậu tương.
Kết quả nội dung nghiên cứu này đã khẳng định hệ thống cảm ứng tạo rễ tơ in vitro được xây dựng trên các giống đậu tương nghiên cứu có hiệu quả tốt trong kiểm tra hoạt động của cấu trúc chuyển gen và sự biểu hiện của gen chuyển. Đây là cơ sở để chúng tôi tiếp tục ứng dụng hệ thống này trong kiểm tra hoạt động của hệ thống chỉnh sửa hệ gen CRISPR/Cas9 đã được xây dựng nhằm gây tạo đột biến định hướng

![Quá Trình Hoạt Động Của Cơ Chế Crispr/cas Ở Vi Khuẩn Chống Lại Sự Xâm Nhập Của Dna Ngoại Lai [51].](https://tailieuthamkhao.com/uploads/2023/02/20/nghien-cuu-ung-dung-cong-nghe-crispr-cas9-trong-tao-dot-bien-gen-gmgols03-5-1-120x90.jpg)