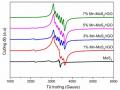
MoS2 xuất hiện tù và thấp hơn, đặc biệt ở mặt (002) so với các pic của MoS2 đơn chất do có sự xen phủ các lớp rGO giữa các tinh thể MoS2 trong quá trình hình thành compozit.
Giữa các mẫu compozit thủy nhiệt ở các nhiệt độ khác nhau, các pic xuất hiện trong mẫu MoS2/rGO-180oC sắc nét hơn so với các mẫu thủy nhiệt ở các nhiệt độ khác. Điều này có thể được giải thích là do khi nhiệt độ tăng từ 140-180C, các tinh thể của MoS2 và cấu trúc liên kết compozit giữa MoS2 với rGO hình thành càng nhiều và chắc chắn, độ tinh thể cao [176]. Mặt khác, nhiệt độ càng tăng cũng thúc đẩy quá trình phân tán của các tấm MoS2 trên mạng lưới rGO làm cho độ tinh thể của các mẫu compozit càng được cải thiện. Tuy nhiên, khi nhiệt độ tăng cao quá (đến 200C), các tinh thể MoS2 hình thành quá nhiều, kết tụ lại thành khối lớn, làm cho pic tù đi. Cụ thể ở mẫu MoS2/rGO-200oC thì các pic không còn sắc nét và chân pic rộng hơn. Điều này cũng trùng hợp với nhận định của Li và cộng sự khi nghiên cứu về ảnh hưởng của nhiệt độ thủy nhiệt đến độ tinh thể trong mẫu vật liệu MoS2/graphen [177].
Các đặc trưng dao động liên kết hóa học trong cấu trúc của vật liệu compozit MoS2/rGO-T được xác định bằng phổ hồng ngoại FTIR và thể hiện trên hình 3.28.
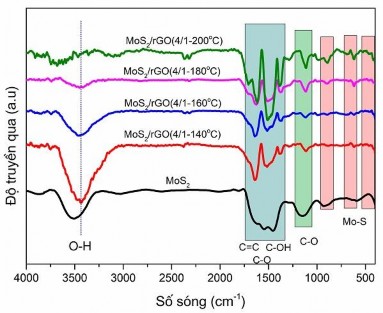
Hình 3.28. Phổ IR của các mẫu MoS2 và MoS2/rGO(4/1-T)
Kết quả ở hình 3.28 cho thấy, các giá trị pic đặc trưng cho các nhóm chức Mo-S, C-OH, C-O, C=C, O-H ở các số sóng khác nhau (như đã đề cập ở phần phân
tích phổ IR ở hình 3.18) đều xuất hiện trong các mẫu compozit có nhiệt độ thủy nhiệt thay đổi từ 140oC đến 200oC. Trong số này, mẫu compozit MoS2/rGO-180oC có cường độ pic giảm hơn so với các mẫu khác thể hiện đã hình thành các tương tác chặt chẽ giữa MoS2 và rGO, giảm bớt các liên kết dao động của các nhóm chức trong rGO riêng rẽ. Bên cạnh đó, cường độ pic ở 3200 – 3700 cm-1 giảm rò rệt khi nhiệt độ thủy nhiệt tăng do ở nhiệt độ cao làm bay hơi nước mạnh, giảm số nhóm hydroxyl hấp phụ vật lý [178].
Ảnh hưởng của nhiệt độ thủy nhiệt đến hình thái học bề mặt vật liệu MoS2/rGO-T được thể hiện qua ảnh SEM hình 3.29.

Hình 3.29. Ảnh SEM của các mẫu MoS2/rGO-140oC (a), MoS2/rGO-160oC (b), MoS2/rGO-180oC (c) và MoS2/rGO-200oC (d)
Quan sát hình 3.29a có thể thấy, ở nhiệt độ thủy nhiệt 140C, bắt đầu có sự hình thành các vảy MoS2 trên các lớp rGO, tuy nhiên chưa nhiều. Khi nhiệt độ tăng lên đến 160C, các vảy hình thành nhiều hơn và xen vào các lớp rGO, làm giảm đi độ xốp của vật liệu (hình 3.29b). Đến khi thủy nhiệt ở 180C, các vảy MoS2 hình thành nhiều hơn và gần như xen phủ hết các lớp rGO, làm cho khó quan sát các lớp rGO riêng rẽ (hình 3.29c). Xu hướng chung là nhiệt độ càng tăng thì các lớp vảy MoS2 xuất hiện nhiều hơn và càng co cụm lại. Đến 200C thì các lớp MoS2 xuất hiện dày đặc, xếp chồng lên nhau che phủ các tấm rGO, đưa vật liệu trở thành các
khối đặc chắc (hình 3.29d). Điều này phù hợp với nhận định từ kết quả phân tích giản đồ XRD (hình 3.27) như đã trình bày ở trên.
Để củng cố thêm nhận định này, diện tích bề mặt riêng và đường kính mao quản của các mẫu vật liệu thủy nhiệt ở các nhiệt độ khác nhau đã được xác định theo phương pháp hấp phụ và giải hấp phụ vật lý N2. Kết quả thể hiện trên hình 3.30.
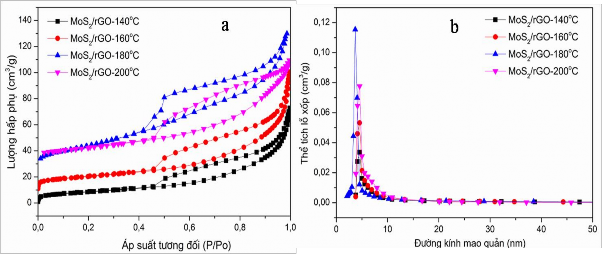
Hình 3.30. Đường đẳng nhiệt hấp phụ-giải hấp phụ N2 ở 77K (BET) (a) và đường phân bố kích thước mao quản (b) của các mẫu vật liệu MoS2/rGO(4/1-T) với T = 140oC, 160oC, 180oC và 200oC
Đường đẳng nhiệt hấp phụ-giải hấp phụ N2 ở 77K của các mẫu vật liệu MoS2 và MoS2/rGO (4/1-T) được mô tả trên hình 3.30a cho thấy vật liệu có cấu trúc mao quản trung bình, và đường kính mao quản tập trung trong khoảng 3-5 nm. Diện tích bề mặt riêng các mẫu tăng dần theo nhiệt độ thủy nhiệt từ 30,3 m2/g (mẫu MoS2/rGO (4/1 - 140oC)) lên 37,5 m2/g (mẫu MoS2/rGO (4/1 - 160oC)) và cao nhất đến 88,1 m2/g (mẫu MoS2/rGO (4/1-180oC). Nhưng khi nhiệt độ tăng tiếp đến 200C, diện tích bề mặt riêng của vật liệu lại giảm xuống còn 44,8 m2/g (mẫu MoS2/rGO (4/1 - 200oC)). Điều này có thể do ở nhiệt độ thấp khả năng hình thành các liên kết giữa MoS2 với rGO còn ít nên diện tích bề mặt riêng thấp. Khi tăng nhiệt độ thủy nhiệt, liên kết MoS2 với rGO hình thành càng nhiều và phân bố MoS2 trong các lớp rGO đều hơn, ổn định hơn, dẫn đến diện tích bề mặt riêng tăng. Điều đó khẳng định rằng, khi đưa MoS2 phân tán lên trên nền rGO đã làm giảm sự kết tụ của các lớp MoS2, cải thiện được diện tích bề mặt riêng của vật liệu. Kết quả này
phù hợp với nhận định về ảnh SEM đã được phân tích ở trên. Tuy nhiên, khi nhiệt độ tăng cao quá (200C), các liên kết MoS2 với rGO hình thành nhiều hơn, các vảy MoS2 có xu hướng co cụm lại, dẫn đến giảm diện tích bề mặt riêng của tổ hợp.
Khả năng hấp thụ ánh sáng của các vật liệu trong vùng ánh sáng khả kiến được đặc trưng bằng phổ UV-Vis-DRS. Kết quả được trình bày trong hình 3.31.
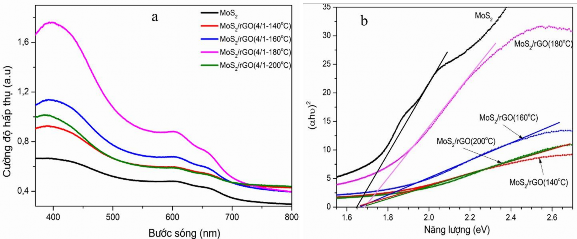
Hình 3.31. Phổ UV-Vis-DRS (a) và năng lượng vùng cấm được xác định bằng hàm Kubelka-Munk (b) của MoS2/rGO (4/1-T)
Kết quả ở hình 3.31a cho thấy, các mẫu compozit có khả năng hấp thụ ánh sáng trải dài từ 350 nm (vùng tử ngoại) đến 700 nm (vùng ánh sáng khả kiến). Trong các mẫu compozit này đều xuất hiện các pic đặc trưng của MoS2 và rGO như một số nghiên cứu khác cũng đã đề cập [153],[96]. Bên cạnh đó, các pic này cũng cho thấy có sự tách lớp của MoS2 đa lớp thành dạng ít lớp hơn trong môi trường thủy nhiệt và có sự chuyển đổi năng lượng vùng cấm gián tiếp (indirect band gap) sang trực tiếp (direct band gap) [170]. Điều đó cho thấy khả năng hấp thụ ánh sáng của các mẫu compozit MoS2/rGO nhạy hơn so với mẫu MoS2 đơn chất, dẫn đến khả năng tăng hoạt tính quang xúc tác của vật liệu compozit [172]. Các pic xuất hiện trong khoảng 600 – 700 nm ở mẫu MoS2/rGO (4/1-180oC) thể hiện rò ràng hơn so với các mẫu compozit thủy nhiệt ở các nhiệt độ còn lại. Điều này bắt nguồn từ sự hình thành ngày càng nhiều các liên kết giữa MoS2 và rGO trong compozit khi nhiệt độ thủy nhiệt tăng dâng, làm biến đổi cấu trúc điện tử ban đầu của MoS2. Tuy nhiên, khi nhiệt độ tăng cao quá, sự co cụm các lớp MoS2, phân bố không đồng đều trong các lớp rGO sẽ dẫn đến giảm khả năng hấp thụ ánh sáng của vật liệu. Từ kết
quả đo UV-Vis-DRS, dựa vào hướng dẫn cách tính năng lượng vùng cấm [173] và Hàm Kubelka-Munk [174], năng lượng vùng cấm của các mẫu compozit thủy nhiệt ở các nhiệt độ khác nhau đã được xác định. Kết quả được thể hiện trên hình 3.31b và bảng 3.4.
Bảng 3.4. Giá trị Eg của các mẫu vật liệu compozit MoS2/rGO (4/1-T)
MoS2 | MoS2/rGO (4/1-140oC) | MoS2/rGO (4/1-160oC) | MoS2/rGO (4/1-180oC) | MoS2/rGO (4/1-200oC) | |
Eg (eV) | 1,65 | 1,67 | 1,68 | 1,69 | 1,68 |
Có thể bạn quan tâm!
-
 Ảnh Tem Và Hrtem Của Rgo Ở Nhiệt Độ Nung 200 O C (A), 400 O C(B) Và 600 O C(C)
Ảnh Tem Và Hrtem Của Rgo Ở Nhiệt Độ Nung 200 O C (A), 400 O C(B) Và 600 O C(C) -
 Đường Đẳng Nhiệt Hấp Phụ-Giải Hấp Phụ N 2 Ở 77K (Bet) (A) Và Đường Phân Bố Kích Thước Mao Quản Của Các Mẫu Vật Liệu Mos 2 (B)
Đường Đẳng Nhiệt Hấp Phụ-Giải Hấp Phụ N 2 Ở 77K (Bet) (A) Và Đường Phân Bố Kích Thước Mao Quản Của Các Mẫu Vật Liệu Mos 2 (B) -
 Đường Đẳng Nhiệt Hấp Phụ-Giải Hấp Phụ (A) Và Đường Phân Bố Kích Thước Mao Quản (B) Của Các Mẫu Vật Liệu Mos 2 /rgo(180 O C-X) Với X =2/1, 4/1
Đường Đẳng Nhiệt Hấp Phụ-Giải Hấp Phụ (A) Và Đường Phân Bố Kích Thước Mao Quản (B) Của Các Mẫu Vật Liệu Mos 2 /rgo(180 O C-X) Với X =2/1, 4/1 -
 Phổ Epr Của Các Mẫu Compozit X%mn-Mos 2 /rgo (X = 1%mn, 3%mn, 5%mn Và 7%mn) Với Các Hàm Lượng Biến Tính Khác Nhau
Phổ Epr Của Các Mẫu Compozit X%mn-Mos 2 /rgo (X = 1%mn, 3%mn, 5%mn Và 7%mn) Với Các Hàm Lượng Biến Tính Khác Nhau -
 Phổ Eis Của Mos 2 (Am), Mos 2 /rgo (Cm) Và Mn-Mos 2 /rgo (Dm)
Phổ Eis Của Mos 2 (Am), Mos 2 /rgo (Cm) Và Mn-Mos 2 /rgo (Dm) -
 Ảnh Hưởng Của Ph Đến Quá Trình Quang Phân Hủy Rhb Trên Xúc Tác Mos 2 /rgo
Ảnh Hưởng Của Ph Đến Quá Trình Quang Phân Hủy Rhb Trên Xúc Tác Mos 2 /rgo
Xem toàn bộ 192 trang tài liệu này.
Kết quả ở bảng 3.4 cho thấy năng lượng vùng cấm của vật liệu compozit MoS2/rGO thay đổi không đáng kể và chỉ lớn hơn một chút so với dạng MoS2 ban đầu. Khi cấu trúc compozit hình thành càng rò ràng, sẽ càng cải thiện được tốc độ chuyển điện tích trong quá trình quang xúc tác, giúp giảm tốc độ tái tổ hợp giữa electron-lỗ trống quang sinh, cải thiện hiệu quả quang xúc tác của vật liệu.
3.3.2.2. Ảnh hưởng của nhiệt độ thủy nhiệt đến hoạt tính quang xúc tác của vật liệu compozit MoS2/rGO
Các mẫu MoS2/rGO (4/1-T) (T = 140oC, 160oC, 180oC, 200oC) được thử hoạt tính trong phản ứng quang phân hủy RhB ở các điều kiện tương tự như đã mô tả trong mục 3.3.1.2. Kết quả được thể hiện trên hình 3.32a và 3.32b.
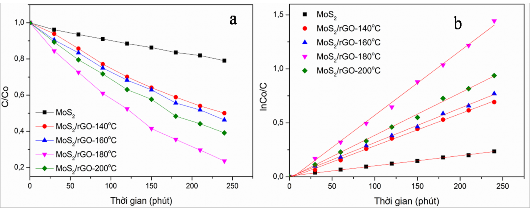
Hình 3.32. Sự phân hủy RhB dưới vùng ánh sáng khả kiến (a) và mô hình động học Langmuir-Hinshelwood (b) của các mẫu vật liệu compozit MoS2/rGO (4/1-T)
(Điều kiện: CRhB = 20 mg/L, m xúc tác = 0,1g, 400 ml dung dịch RhB, đèn compact 40W)
Kết quả ở hình 3.32a cho thấy hoạt tính quang xúc tác phân hủy RhB của các mẫu compozit giảm dần theo thứ tự từ MoS2/rGO-180oC > MoS2/rGO-200oC > MoS2/rGO-160oC > MoS2/rGO-140oC tương ứng với các hiệu suất phân hủy 76,4%
> 60,8% > 53,7% > 50%. Điều này có thể giải thích trên cơ sở diện tích bề mặt riêng của các mẫu vật liệu. Ở điều kiện thủy nhiệt 180C, diện tích bề mặt riêng của compozit MoS2/rGO (4/1-180oC) cao nhất (88,1 m2/g), gấp 6 lần so với vật liệu MoS2 đơn chất (14,8 m2/g), đồng thời mẫu cũng thể hiện khả năng hấp thụ tốt ánh sáng trong vùng nhìn thấy. Kết quả sau 4 giờ chiếu sáng, hiệu suất phân hủy RhB dưới vùng ánh sáng khả kiến của các mẫu compozit lớn hơn rất nhiều so với mẫu MoS2 đơn chất (20%). Như vậy, việc tổng hợp thành công compozit MoS2/rGO đã làm giảm được tốc độ tái tổ hợp giữa electron-lỗ trống quang sinh và cải thiện đáng kể hoạt tính quang xúc tác của vật liệu.
Để so sánh tốc độ phản ứng phân hủy RhB trên các vật liệu compozit thủy nhiệt ở các nhiệt độ khác nhau, mô hình động học Langmuir-Hinshelwood cũng được sử dụng [179]. Kết quả được trình bày ở hình 3.32b cho thấy sự phù hợp của quá trình xúc tác quang của các mẫu đối với mô hình đã áp dụng. Hằng số tốc độ phản ứng tương ứng với quá trình xúc tác của từng mẫu được thống kê ở bảng 3.5.
Bảng 3.5. Dữ liệu của các mẫu compozit MoS2/rGO (4/1-T) từ mô hình động học Langmuir-Hinshelwood
kapp (phút-1) | Hệ số hồi quy R2 | |
MoS2/rGO(4/1-140oC) | 0,0029 | 0,998 |
MoS2/rGO(4/1-160oC) | 0,0032 | 0,996 |
MoS2/rGO(4/1-180oC) | 0,0059 | 0,996 |
MoS2/rGO(4/1-200oC) | 0,0039 | 0,997 |
MoS2 | 0,0009 | 0,996 |
Kết quả cho thấy phản ứng quang phân hủy RhB trên mẫu MoS2/rGO(4/1- 180oC) có hằng số tốc độ cao nhất (kapp = 0,0059) chứng tỏ quá trình diễn ra nhanh hơn nhiều so với các mẫu compozit ở các nhiệt độ thủy nhiệt còn lại cũng như mẫu MoS2 đơn chất. Hằng số tốc độ này cũng cao hơn so với kết quả nghiên cứu của
Zhang và cộng sự (k = 0,00378) [179]. Điều đó càng khẳng định rằng rGO đóng một vai trò rất quan trọng trong việc cải thiện được hiệu quả quang xúc tác của MoS2.
Từ các kết quả thực nghiệm trên đây có thể thấy tỷ lệ thành phần MoS2/rGO là 4/1 và nhiệt độ thủy nhiệt là 180oC là các điều kiện phù hợp nhất để tổng hợp compozit MoS2/rGO cho quang xúc tác phân hủy RhB. Điều kiện này sẽ được sử dụng cho nghiên cứu tiếp theo về biến tính tổ hợp bằng kim loại chuyển tiếp Mn.
3.4. Kết quả tổng hợp vật liệu Mn-MoS2/rGO
3.4.1. Đặc trưng cấu trúc vật liệu Mn-MoS2/rGO
Hình 3.33 thể hiện giản đồ XRD của MoS2 và x%Mn-MoS2/rGO với các hàm lượng khác nhau (x= 1%Mn, 3%Mn, 5%Mn và 7%Mn).
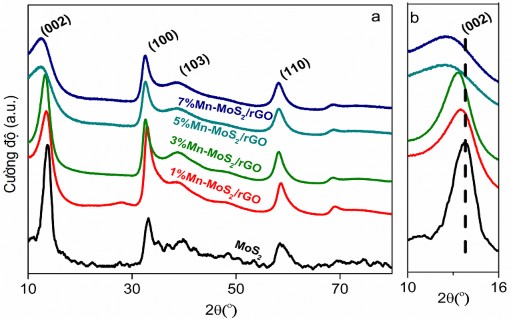
Hình 3.33. Giản đồ XRD của MoS2 và X%Mn-MoS2/rGO (X = 1%Mn, 3%Mn, 5%Mn và 7%Mn) (a) và các mẫu XRD với độ rộng pic của mặt (002) (b)
Kết quả ở hình 3.33a cho thấy khi biến tính Mn vào MoS2/rGO với các hàm lượng Mn khác nhau đều xuất hiện các pic ở ![]() =14,1; 33,6; 39,84 và 58,1o tương ứng với các mặt (002), (100), (103) và (110) và giống với đặc trưng của pha hexagonal 2H-MoS2 [157]. Một điều cần lưu ý ở đây là pic tại
=14,1; 33,6; 39,84 và 58,1o tương ứng với các mặt (002), (100), (103) và (110) và giống với đặc trưng của pha hexagonal 2H-MoS2 [157]. Một điều cần lưu ý ở đây là pic tại ![]() = 26o không được quan sát thấy trong các mẫu compozit x%Mn-MoS2/rGO là do sự xếp chồng của các lớp MoS2 làm che phủ bề mặt của rGO [180]. Hơn nữa, không có pic nào thể
= 26o không được quan sát thấy trong các mẫu compozit x%Mn-MoS2/rGO là do sự xếp chồng của các lớp MoS2 làm che phủ bề mặt của rGO [180]. Hơn nữa, không có pic nào thể
hiện cho sự hình thành MnS, cũng như không xuất hiện các pic pha lạ nào khác so với mẫu không biến tính [181, 182]. Trong các mẫu compozit, cường độ của các pic giảm cùng với sự tăng của hàm lượng MoS2. Đặc biệt, cường độ các pic ở mặt (002) của các mẫu biến tính đều có cường độ thấp hơn và tù hơn so với mẫu MoS2 (hình 3.33b). Ngoài ra, vị trí pic đặc trưng cho mặt (002) có sự dịch chuyển nhẹ sang vùng góc thấp hơn, trong khoảng ![]() = 10-16o, khi tăng dần hàm lượng Mn đưa vào.
= 10-16o, khi tăng dần hàm lượng Mn đưa vào.
Sự mở rộng này có thể giải thích do bán kính ion của Mn2+ (0,067 nm) lớn hơn so
với Mo4+ (0,065 nm) ở số phối trí 6 nên khi thay thế vào mạng lưới MoS2 đã làm giãn khoảng cách các mặt [183], [182]. Điều này cho phép khẳng định rằng đã biến tính thành công Mn vào cấu trúc MoS2/rGO để tạo compozit Mn-MoS2/rGO.
Các đặc trưng liên kết hóa học trong cấu trúc của vật liệu biến tính với Mn và không biến tính được xác định thông qua phổ hồng ngoại FT-IR như thể hiện trên hình 3.34.
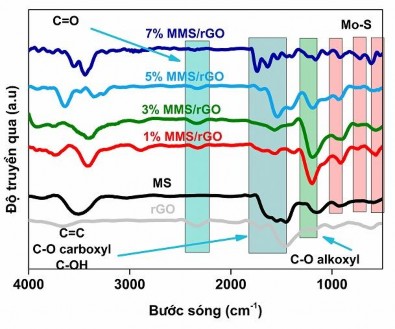
Hình 3.34. Phổ IR của các mẫu MoS2 và X%Mn-MoS2/rGO (X = 1%Mn, 3%Mn, 5%Mn và 7%Mn) với các hàm lượng biến tính khác nhau
Kết quả ở hình 3.34 cho thấy các pic ở số sóng khoảng 450 cm-1, 530 cm-1 và 920 cm-1 đặc trưng cho liên kết Mo-S [162],[163],[164], cho thấy có sự tồn tại của MoS2 trong vật liệu. Đối với rGO, pic ở 1178 cm-1 thể hiện cho dao động C-O (alkoxy) [180],[163],[184]; các pic ở 1619, 1224 cm-1 đặc trưng cho dao động C=C