61
điều kiện chiếu sáng khác nhau có ý nghĩa rất lớn cho sự phát sinh hình thái, phát sinh phôi. Đường đối với cơ thể thực vật là yếu tố không thể thiếu trong cung cấp năng lượng và khung carbon cho sự phát triển của tế bào. Đường còn giúp điều hòa áp suất thẩm thấu, bảo vệ tính toàn vẹn của màng tế bào, quyết định hình dạng và sự phát triển của tế bào [12].
Bảng 3.3. Ảnh hưởng của nồng độ đường và điều kiện chiếu sáng đến sự tạo phôi vô tính trực tiếp từ mô lá, ở môi trường SH, 60 NSC
Nồng độ sucrose (g/L) | Tỷ lệ mẫu tạo phôi (%) | Số phôi/mẫu | |
Sáng | 10 | 91,11c* | 23,19c |
30 | 94,44b | 28,56b | |
50 | 98,89a | 35,95a | |
70 | 87,78d | 18,72d | |
Tối | 10 | 78,89f | 10,08g |
30 | 82,22e | 11,28f | |
50 | 90,00cd | 15,93e | |
70 | 71,11g | 9,72g |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá
Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá -
 Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi
Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi -
 Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc.
Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc. -
 Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc. -
 Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc. -
 Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc.
Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc.
Xem toàn bộ 180 trang tài liệu này.
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0, 05 trong phép thử Duncan. Số liệu (%) được chuyển đổi sang dạng
(x+0,5)1/2 khi xử lý thống kê.
Đã ghi nhận được công trình công bố đường ở nồng độ 50 g/L thúc đẩy khả năng phát sinh phôi vô tính từ mô sẹo phôi hợp tử cây dược liệu quan trọng Terminalia chebula [114]. Nồng độ đường 50 g/L là nồng độ tối ưu cho sự phát sinh phôi vô tính sâm Ngọc Linh (Panax vietnamensis) [74]. Ở họ Ngũ gia bì, nhiều kết quả nghiên cứu cho thấy đường được sử dụng như vừa là tác nhân tạo áp suất thẩm thấu cao và chất dinh dưỡng đã tạo ảnh hưởng rất tích cực lên quá trình tạo phôi, ví dụ [36] đã cải thiện được chất lượng và tần số tạo phôi Panax quinquefolius trực tiếp qua kết hợp tiền xử lý (pretreatment) mẫu lá mầm với tác nhân đường (342,3 g/L, ở 4oC) với nuôi cấy mẫu sau đó trên môi trường cảm ứng tạo phôi có nồng độ đường cao (70 g/L); ngoài ra, Kim và cộng sự (2010) cũng đã ghi nhận tần số tạo phôi đơn Panax ginseng trực tiếp (ở 2 giống Yun-Poong và Chun-Poong) cao nhất khi mảnh lá mầm phôi non được nuôi cấy trên môi trường MS có 70 g/L đường và tần số tạo
62
phôi đơn tăng cao khi xử lý gây co nguyên sinh (plasmolysis) mẫu bằng đường (0,1
– 0,5 – 1 M, trong 24 h) trước khi cấy mẫu vào môi trường [115].

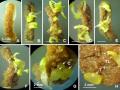
Hình 3.5. Phôi vô tính phát sinh trực tiếp từ mảnh lá ở môi trường SH, có đường và điều kiện sáng, tối, 60 NSC
A,B,C,D. Phôi hình thành ở môi trường SH có sucrose 10, 30, 50 và 70 g/L, điều kiện sáng. E,F,G,H. Phôi hình thành ở môi trường SH có sucrose 10, 30, 50 và 70 g/L, điều kiện tối. Thanh ngang 10 mm.
3.1.1.4. Ảnh hưởng của tỷ lệ nước dừa đến sự tạo phôi vô tính trực tiếp từ mô lá
Qua tối ưu hóa các yếu tố đã khảo sát, môi trường SH có 5 mg/L NAA và 0,25 mg/L BA, 50 g/L đường được sử dụng làm môi trường nuôi cấy để xác định nồng độ thích hợp của nước dừa (%) cho sự cảm ứng tạo phôi vô tính từ mảnh lá nuôi ở điều kiện chiếu sáng ở 4000 lux.
Kết quả cho thấy ở 60 NSC, nghiệm thức có tỷ lệ nước dừa 10% đã có ảnh hưởng tích cực nhất so với các nồng độ còn lại, tất cả mẫu cấy đều tạo phôi, với 39,50 phôi/mẫu (Bảng 3.4; Hình 3.6), nghiệm thức có tỷ lệ nước dừa 5% và 10% không có khác biệt thống kê về chỉ tiêu số mẫu tạo phôi nhưng có sự khác biệt về số phôi/mẫu. Các mẫu cấy ở môi trường có tỷ lệ nước dừa cao 15%, 20% làm giảm khả năng tạo phôi vô tính (tỷ lệ mẫu tạo phôi là 95,56%, 94,44%), số phôi/mẫu giảm rõ rệt ở nghiệm thức có 20% nước dừa (29,78 phôi/mẫu). Ở nghiệm thức đối chứng không bổ sung nước dừa và nghiệm thức có tỷ lệ nước dừa 15% không khác biệt về thống kê về số phôi/mẫu nhưng khác biệt rõ về tỷ lệ mẫu tạo phôi. Như vậy, khi bổ sung nước dừa với các tỷ lệ khác nhau đã có tác động rõ rệt đến kết quả tạo phôi vô tính.
Bảng 3.4. Ảnh hưởng của tỷ lệ nước dừa đến sự tạo phôi vô tính trực tiếp từ mảnh lá, ở môi trường SH, 60 NSC.
Tỷ lệ mẫu tạo phôi (%) | Số phôi/mẫu | |
0 | 98,89b* | 35,95c |
5 | 100,00a | 38,19b |
10 | 100,00a | 39,50a |
15 | 95,56c | 35,19c |
20 | 94,44d | 29,78d |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0, 05 trong phép thử LSD. Số liệu (%) được chuyển đổi sang dạng
(x+0,5)1/2 khi xử lý thống kê.
Theo Prades và cộng sự (2012) [116], trong nước dừa xanh có chứa đường, vitamin, muối khoáng, acid amin và một số phytohormone quan trọng nhất là cytokinin. Cũng theo các tác giả trên, IAA tham gia vào nhiều quá trình liên quan đến tăng trưởng và phát triển của thực vật, sự di chuyển phân cực của auxin tạo lượng auxin cực đại (auxin maximum)/gradient về nồng độ nhằm điều hòa nhiều quá trình sinh lý dẫn đến sự phát sinh hình thái trong đó có phát sinh phôi vô tính. Trong nước dừa cũng có nhiều loại cytokinin khác nhau như trans-zeatin, trans-zeatin riboside- 5’- monophosphate, kinetin riboside, kinetin, N6-isopentenyladenine,...- có tác dụng trong phân chia tế bào, làm chậm sự lão hóa, tăng khả năng biến dưỡng,.. và như vậy cũng kích thích tăng trưởng thực vật. Do đó, khi bổ sung nước dừa vào môi trường với lượng phù hợp sẽ làm tăng khả năng tạo và phát triển phôi, chồi/cây. Khierallah và Hussein (2013) đã sử dụng nước dừa trong nghiên cứu và kết luận nước dừa 20% (v/v) rất thích hợp cho tạo phôi vô tính Phoenix dactylifera (date palm) [77]. Ở họ Ngũ gia bì trong đó có loài NGBCC đã ghi nhận được ảnh hưởng tích cực của nước dừa (10%) lên quá trình hình thành phôi từ mô sẹo/mô sẹo có khả năng sinh phôi sâm Ngọc Linh - Panax vietnamensis [117].
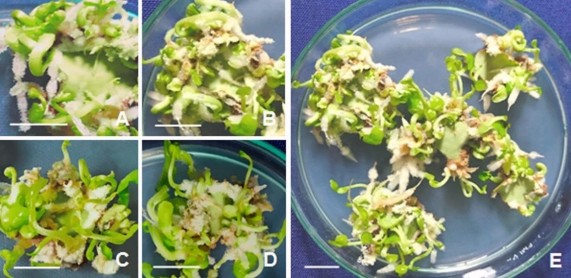
Hình 3.6. Phôi vô tính phát sinh trực tiếp từ mảnh lá ở môi trường SH, có bổ sung nước dừa, 60 NSC.
A,B,C,D. Mảnh lá tạo phôi ở môi trường SH có nước dừa 5%, 10%, 15%, 20%; E.
Đĩa cấy mảnh lá tạo phôi trên môi trường SH có 10% nước dừa. Thanh ngang 10 mm.
3.1.1.5. Tạo cây con hoàn chỉnh từ phôi vô tính
Trong quá trình nuôi cấy tái sinh, trước và sau giai đoạn trưởng thành hầu hết các phôi tiếp tục sinh trưởng dẫn đến phát triển thân, lá mầm, rễ mầm, chồi/lá bình thường (Hình 3.7A). Ngược lại, bên cạnh dạng phôi vô tính hình thái tiêu biểu cũng đã ghi nhận được trường hợp phôi tái sinh (với số lượng không đáng kể) có hình dạng bất thường như phôi dính nhau ở phần lá mầm/thân, không có rễ mầm, chồi không phát triển (Hình 3.7B,C).

Hình 3.7. Phôi bình thường và một số dạng bất thường của phôi vô tính
A. Hình thái phôi bình thường; B. Hình thái phôi có lá mầm dị dạng, rễ mầm phát triển bình thường; C. Các phôi dính nhau với lá mầm dị dạng, có chung phần thân và không có rễ mầm. Thanh ngang 5 mm.
Sự phân chia tế bào ở vùng mô phân sinh xảy ra trước khi có sự biệt hóa của cực chồi và lá mầm, nếu sự phân bào vẫn tiếp tục sau khi hình thành sơ khởi lá mầm,
dẫn đến hình thành phôi bất thường có hai hay nhiều phôi dính lại với nhau (Hình 3.7C). Miekle và cộng sự, (1995) cho rằng, các lá mầm hợp nhất như vậy cũng là đặc điểm của phôi soma dạng sừng thường được phục hồi từ nuôi cấy tế bào, có thể là auxin ngoại sinh hiện diện trong môi trường có thể đủ làm nhiễu loạn sự vận chuyển bình thường của auxin trong phôi ở giai đoạn hình cầu, làm cho sự phát triển lá mầm bình thường bị ngăn cản [108].
Phôi phát triển với 2 lá thật nhỏ ban đầu (Hình 3.8A) được nuôi cấy trên môi trường MS và ½MS [54] không bổ sung chất ĐHST để so sánh khả năng tạo cây hoàn chỉnh. Kết quả cho thấy, cây con ở hai môi trường này phát triển khá khác biệt ở 90 NSC. Chiều cao cây, số lá, số rễ và chiều dài rễ trung bình của cây ở môi trường
½MS, MS lần lượt là 2,63 cm; 5,2; 7,3; 9,6 cm; là 2,58 cm; 4,9; 6,5 và 6,9 cm, theo thứ tự (không trình bày bảng số liệu). Như vậy, môi trường ½MS là thích hợp cho việc tạo cây con hoàn chỉnh từ phôi vô tính (Hình 3.8C). Điểm đặc biệt là các lá thật hình thành ban đầu ở cây con đều là các lá đơn, sau đó mới tạo các lá kép có thùy (lá đơn) đặc trưng (Hình 3.8B,C).

Hình 3.8. Tạo cây con từ phôi vô tính trên môi trường MS, ½MS không có chất ĐHST.
A. Vật liệu phôi dùng thí nghiệm tạo cây con; B,C. Cây con từ phôi nuôi cấy trên môi trường MS, ½MS.
Điểm đặc biệt ở NGBCC là phôi có thể tạo chồi khá thuận lợi trên môi trường không bổ sung chất ĐHST; theo chúng tôi, có thể do phôi không ở trạng thái ngủ/hưu miên (dormancy) như ở một số trường hợp khác như phôi các dòng Panax ginseng đột biến [41] và dòng lai khác loài giữa Panax ginseng và Panax quinquefolius [118]
- đều cần được nuôi cấy trên môi trường có GA3 (5 mg/L); và cũng cần được nuôi trên môi trường có bổ sung BA (1 mg/L), NAA (0,2 mg/L) đối với Coriandrum sativum [119]. Qua thử nghiệm nuôi cấy ban đầu 200 phôi, ghi nhận được số phôi tạo chồi (sau ~ 3 tháng nuôi) là 196 (tỷ lệ 98%). Theo Sliwinska và cộng sự (2008), môi
66
trường ½MS không bổ sung chất ĐHST là thích hợp cho sự tạo cây từ phôi chỉ trong một lần nuôi cấy đối với Đinh lăng Polyscias filicifolia [54].
3.1.1.6. Trồng cây con ở chậu đất

Hình 3.9. Trồng cây từ phôi vô tính ra chậu đất ở vườn ươm
A. Bình cây chuẩn bị đưa ra trồng ở vườn ươm, ở 90 NSC; B,C. Cây từ phôi ở chậu đất vườn ươm sau 3 - 6 tháng trồng. D. Cây sau 12 tháng trồng.
Các cây con (nuôi trong bình tam giác chứa môi trường ½MS) (Hình 3.9A) được đem trồng ra chậu chậu đất, kết quả cho thấy các lá mầm dần thoái hóa, cây có tỷ lệ sống rất cao (≥ 95%) tính đến thời điểm 3 tuần sau trồng và cây có sinh trưởng/kiểu hình bình thường trong điều kiện vườn ươm; số lá chét ban đầu thường thấp hơn so với cây mẹ, tăng dần ở thời gian sau đó (Hình 3.9B,C).
3.1.2. Tạo phôi vô tính gián tiếp
3.1.2.1. Tạo phôi vô tính gián tiếp qua mô sẹo mảnh lá (10 x 10 mm)
Tạo mô sẹo
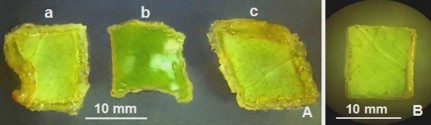
Hình 3.10. Ảnh hưởng của cách cấy mảnh lá đến hiệu quả tạo mô sẹo.
A. Cấy mặt trên mảnh lá tiếp xúc với môi trường (a,c), cấy mặt dưới mảnh lá tiếp xúc với môi trường (b); B. Mảnh lá nuôi cấy trên môi trường SH không có 2,4-D.
Trước khi bố trí thí nghiệm tạo mô sẹo, tiến hành thử nghiệm ảnh hưởng của 02 cách cấy mảnh lá (trên môi trường SH có 2 mg/L 2,4-D) đến hiệu quả tạo mô sẹo đã được thực hiện; một là, cấy mặt trên mảnh lá (có màu xanh đậm, sáng bóng) tiếp
xúc với môi trường; hai là, cấy mặt dưới mảnh lá (màu xanh nhạt, mờ) trên mặt môi trường.
Kết quả cho thấy cách cấy thứ nhất cho kết quả tạo nhiều mô sẹo hơn ở mép cắt (Hình 3.10Aa,c) so với cách cấy thứ hai (Hình 3.10Ab), có thể do mặt trên lá tiếp xúc với môi trường nên sự hấp thu chất dinh dưỡng ở môi trường tốt hơn, đồng thời mặt dưới lá có nhiều khí khổng, sự trao đổi khí thuận lợi hơn. Không ghi nhận sự hình thành mô sẹo trường hợp nuôi cấy mảnh lá trên môi trường không bổ sung 2,4- D (Hình 3.10B). Do vậy, cách đặt mẫu mặt trên lá tiếp xúc với môi trường được sử dụng cho nghiên cứu tiếp theo.

Hình 3.11. Tạo mô sẹo từ mảnh lá (10 x 10 mm) nuôi cấy trên môi trường SH. A,B,C. Mảnh lá tạo mô sẹo ở môi trường có 2,4-D 1, 2, 3 mg/L, 20 NSC; D,E,F. Mảnh lá tạo mô sẹo (và rễ) ở môi trường có 2,4-D 1, 2, 3 mg/L, 40 NSC; G,H,I. Cụm mô sẹo (sau bỏ rễ, cấy chuyền) trên môi trường có 2,4-D 1, 2, 3 mg/L, 60 NSC (thanh ngang 10 mm).
Đã ghi nhận nhiều công bố kết quả nghiên cứu như tạo mô sẹo Coffea arabica [120], tạo phôi Coffea arabica và Coffea canephora [121], và kể cả tạo chồi Petunia hybrida [122] và Sinningia speciosa [123] từ mảnh lá sử dụng thao tác cấy mẫu theo cách này. Ngược lại, cấy đặt mặt dưới mảnh lá Malus sieversii tiếp xúc với môi trường lại cho kết quả tạo mô sẹo và tái sinh chồi tốt hơn [124]. Như vậy, cách cấy phụ thuộc vào loài thực vật nghiên cứu và ở NGBCC, cấy mặt trên mảnh lá tiếp xúc với môi
trường đã tạo ảnh hưởng tích cực đến quá trình tạo mô sẹo và nhìn chung phù hợp với các kết quả công bố chung như đã nêu trên.
Kết quả thí nghiệm tạo mô sẹo cho thấy, ở 20 ngày sau cấy, mô cấy đã tăng kích thước, mô sẹo hình thành ở xung quanh mép cắt của tất cả các mẫu cấy mảnh lá trên môi trường có bổ sung 2,4-D (tỷ lệ 100%); hiệu quả cao nhất ở 3 mg/L 2,4-D, ít nhất ở nghiệm thức có 1 mg/L 2,4-D (Hình 3.11A,B,C). Ngày thứ 40 sau nuôi cấy, nhận thấy các mẫu cấy hình thành khá nhiều rễ ngắn có nhiều lông hút, đầu rễ tròn, nhiều nhất ở 1 mg/L 2,4-D (Hình 3.11D,E,F). Mẫu cấy sau khi cắt bỏ rễ, cấy chuyền vào môi trường tạo mô sẹo trong 20 ngày tiếp theo, kết quả cho thấy mô sẹo hình thành trên khắp bề mặt của mảnh lá, hình thành nhiều ở các mẫu cấy trên môi trường có 2,4-D ở nồng độ 2 và 3 mg/L), mô sẹo phát triển kém ở 1 mg/L 2,4-D. Các mẫu cấy ở 2 mg/L 2,4-D, ghi nhận có sự hình thành một số cụm mô hơi cứng, màu hơi vàng/trắng tương tự mô sẹo có KNSP, (Hình 3.12H); mô sẹo xốp hơn ở 3 mg/L 2,4- D (Hình 3.12I). Như vậy, việc cắt bỏ rễ đã tạo điều kiện thuận lợi cho sự hình thành mô sẹo.
Bảng 3.5. Ảnh hưởng của 2,4-D đến sự hình thành mô sẹo có KNSP, ở môi trường SH, 30NSC.
Tỷ lệ (%) mẫu tạo mô sẹo có KNSP | Số cụm mô sẹo có KNSP/mẫu | |
1 | 100 | 2,20b* |
2 | 100 | 3,43a |
3 | 100 | 1,87c |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0,05 trong phép thử LSD.
Theo tài liệu, đối với cây một và hai lá mầm, 2,4-D có tác dụng rất hiệu quả đến sự hình thành mô sẹo từ nhiều loại vật liệu nuôi cấy khác nhau như mảnh lá/lá mầm, đoạn thân/trụ mầm/rễ, phôi non,… ở nhiều đối tượng thực vật khác nhau [125][126]. Tương tự, đối với một số loài thuộc họ Ngũ gia bì [127], mô sẹo hình thành có nhiều dạng khác nhau như xốp/cứng và màu sắc khác nhau như trắng đục/trắng trong, hơi vàng/vàng. Ở NGBCC khoảng dao động nồng độ 2,4-D để tạo mô sẹo, nhận được với các dạng mô sẹo và màu sắc khác nhau phù hợp với kết quả nghiên cứu chung ở lĩnh vực này.