69
Sau 30 ngày cấy các mảnh mô sẹo để tạo mô sẹo có KNSP, kết quả cho thấy có sự hình thành các cụm mô sẹo hơi cứng, màu vàng sáng/hơi đục hình thành trên bề mặt cụm mô sẹo nuôi cấy, đây là các cụm mô sẹo có KNSP, số lượng cụm mô sẹo hình thành khác nhau tùy thuộc nồng độ 2,4-D nhiều nhất ở 2 mg/L 2,4-D (3,43), thấp nhất ở 3 mg/L 2,4-D (1,87) (Bảng 3.5, Hình 3.12A,B,C).
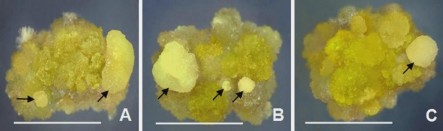
Hình 3.12. Ảnh hưởng của 2,4-D đến sự hình thành mô sẹo có KNSP, ở môi trường SH, 30 NSC.
A,B,C. Cụm mô sẹo có KNSP (vị trí mũi tên) hình thành trên môi trường có 2,4-D 1; 2; 3 mg/L (thanh ngang 10 mm)
Trong nghiên cứu tạo/duy trì/phát triển sinh khối mô sẹo có khả năng sinh phôi ở nhiều loài thực vật thì auxin ở dạng riêng lẻ hoặc kết hợp với cytokinin là yếu tố mang tính quyết định, và loại mô có khả năng tái sinh này có vai trò rất quan trọng đối với nghiên cứu tái sinh cây theo con đường tạo phôi vô tính (somatic embryogenesis) [68][128][129], kể cả theo con đường tạo chồi. Mô sẹo có KNSP có thể hình thành ngay ở lần nuôi cấy đầu tiên hoặc/và ở một số lần cấy chuyền nuôi cấy tiếp theo. Theo Von Arnold và cộng sự (2002), sự khác biệt giữa mô sẹo có KNSP và mô sẹo không có KNSP dễ ghi nhận, dựa trên hình thái, màu sắc; mô sẹo có KNSP là thể mô mang các cụm tế bào có khả năng sinh tiền phôi (proembryogenic masses - PEMs) [68]. Mô sẹo có KNSP (embryogenic) là thể mô cứng, trắng hơi vàng, ở dạng cụm/hạt và phát triển chậm – khác với mô sẹo không có KNSP thường có cấu trúc xốp, phát triển nhanh, màu trắng/xám [130]. Theo Gaoyin và cộng sự (2020), ở mô sẹo có khả năng sinh phôi có sự tích lũy lượng IAA nội sinh, đường hòa tan, tinh bột và protein cao – cơ sở quan trọng về năng lượng cho quá trình tạo phôi so với mô sẹo không có khả năng sinh phôi [12]. Như đã trình bày, ở NGBCC, sự phát sinh mô sẹo có KNSP được ghi nhận sau giai đoạn cấy chuyền mô sẹo có thể do ở lần nuôi cấy đầu tiên sự hiện diện của rễ tái sinh đã gây hạn chế sự hình thành loại mô này. Từ các
70
kết quả trên đây, mảnh lá được nuôi cấy trên môi trường có 2 mg/L 2,4-D để thu mô sẹo có KNSP phục vụ nghiên cứu tái sinh phôi ở giai đoạn tiếp theo.
Tạo phôi từ mô sẹo mảnh lá (10 x10 mm) trên môi trường đặc
Từ kết quả thí nghiệm trên thu được các cụm mô sẹo có KNSP (Hình 3.13A) sử dụng làm vật liệu tạo phôi, được nuôi cấy trên môi trường SH có 0,25 mg/L BA kết hợp với NAA (1, 2, 3, 4, 5 mg/L). Quan sát mẫu sau 30 ngày cấy, kết quả cho thấy ở tất cả các cụm mô sẹo có KNSP trên môi trường nuôi cấy SH đều có hiện tượng tái sinh phôi (tỷ lệ 100%), số phôi hình thành nhiều nhất ở môi trường có 2 – 3mg/L NAA tương ứng số phôi tái sinh/cụm là 15,5; 15,8 ít nhất ở môi trường có NAA 1 mg/L với số phôi/cụm mô sẹo là 7,2. Ở nghiệm thức có 2, 3 mg/L NAA không có sự khác biệt về thống kê cả hai chỉ tiêu theo dõi, nhưng khác biệt so với các nghiệm thức còn lại (Bảng 3.6, Hình 3.13).
Bảng 3.6. Ảnh hưởng của NAA và BA đến sự tạo phôi từ mô sẹo mảnh lá (10 x 10 mm), ở môi trường SH, 30 NSC.
BA (mg/L) | Số cụm mô sẹo có KNSP dùng nuôi cấy | Số phôi tái sinh/cụm | Đánh giá định tính về phôi tái sinh | |
1 | 0,25 | 30 | 7,20d* | Phôi dài, rễ phôi ngắn |
2 | 0,25 | 30 | 15,50a | Phôi dài, rễ phôi ngắn |
3 | 0,25 | 30 | 15,80a | Phôi ngắn, rễ phôi ngắn có lông hút |
4 | 0,25 | 30 | 10,80b | Phôi ngắn; một số phôi có rễ dài, nhiều lông hút |
5 | 0,25 | 30 | 9,50c | Phôi rất ngắn, nhiều rễ có lông hút trên cụm phôi; cụm có nhiều mô sẹo |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi
Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi -
 Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc.
Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc. -
 Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc
Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc -
 Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc. -
 Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc.
Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc. -
 Tạo Cây Con Từ Phôi Vô Tính Nuôi Lỏng Lắc Trong Môi Trường Ms, ½Ms
Tạo Cây Con Từ Phôi Vô Tính Nuôi Lỏng Lắc Trong Môi Trường Ms, ½Ms
Xem toàn bộ 180 trang tài liệu này.
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0,05 trong phép thử LSD.
Tương tự trường hợp tạo mô sẹo có KNSP, cũng sử dụng auxin (2,4-D/NAA) kết hợp với cytokinin (BA/kinetin) trong tạo phôi vì cytokinin thường giúp kích thích phôi hình thành và phát triển; trong một số trường hợp, sự tạo phôi và sự trưởng thành của phôi được ghi nhận trong điều kiện sử dụng cùng nồng độ chất điều hòa sinh trưởng [131]. Tuy nhiên, ở đa số trường hợp tạo phôi, mô sẹo có khả năng sinh phôi
71
cần được nuôi cấy trên môi trường có nồng độ auxin giảm hoặc không bổ sung auxin [132]. Theo hướng này, auxin NAA (có hoạt tính sinh lý thấp hơn 2,4-D) thường được sử dụng nhằm kích thích tái sinh phôi và kích thích phát triển phôi tiếp tục sau khi đã hình thành và ở nghiên cứu này, auxin NAA được lựa chọn sử dụng phục vụ nghiên cứu tái sinh phôi. Tương tự như ở nghiên cứu của Gaoyin và cộng sự (2020) [12]. Theo Yu và cộng sự (2017) [99], tuy ở điều kiện nuôi cấy có nồng độ auxin cao nhưng ở khối mô sẹo luôn có sự phân bố không đồng đều của auxin theo không gian (spatial) do sự di chuyển phân cực của auxin có khác nhau ở các vị trí khác nhau, do vậy có thể xảy ra hiện tượng biệt hóa từng phần/toàn phần khi ở điều kiện thuận lợi (ví dụ chuyển sang nuôi cấy sử dụng nồng độ auxin thấp, hoặc dùng loại auxin nuôi cấy phù hợp) – các cấu trúc như phôi/rễ bất định có thể được tái sinh.

Hình 3.13. Tái sinh phôi từ mô sẹo có khả năng sinh phôi trên môi trường đặc SH, 30 NSC và hình thái giải phẫu phôi tái sinh từ mô sẹo.
A. Vật liệu mô sẹo có KNSP (vị trí mũi tên); B,C,D,E,F. Phôi tái sinh trên môi trường có NAA 1; 2; 3; 4; 5 mg/L; G,H. Phôi bước đầu hình thành (vị trí mũi tên) từ cụm mô sẹo có KNSP và hình thái giải phẫu phôi tương ứng (vạch chéo đen chỉ vị trí cắt thu lát mỏng tế bào phục vụ nhuộm màu kép); I. Cụm mô sẹo xốp không có KNSP.
Đến nay đã ghi nhận nhiều nghiên cứu tạo phôi hiệu quả khi kết hợp 2,4-D và BA/kinetin, như trường hợp tạo phôi Passiflora mollissima từ mô sẹo lá mầm trên môi trường MS có 4,5 μM 2,4-D và 4,5 μM BA [133]. Với Psoralea corylifolia, sự kết hợp NAA và BA rất quan trọng đối với tạo mô sẹo có KNSP (từ vật liệu trụ dưới lá mầm) với NAA (2,7 - 10,8 µM), BA 2,2 µM và tái sinh phôi từ mô sẹo với NAA 1,4 µM, BA 2,2 µM [134]. Sự kết hợp của NAA (0,5 - 5 mg/L) với BA 0,5 mg/L luôn cần thiết đối với tạo phôi vô tính trực tiếp từ mảnh lá/lá mầm Solanum nigrum [135]. Tương tự, tổ hợp NAA và BA cũng rất thích hợp để tạo phôi từ mô sẹo lá Citrullus colocynthis [136], mô sẹo phôi hạt non Tapiscia sinensis [94], mô sẹo phôi hợp tử non Picea abies và P. omorika [137]. Kết quả thí nghiệm cho thấy, lần nữa NAA đã chứng tỏ rất thích hợp cho tái sinh phôi gián tiếp từ mô sẹo với nồng độ 2 mg/L và cytokinin BA cũng rất cần thiết cho quá trình tái sinh phôi với nồng độ sử dụng là 0,25 mg/L – tương tự như ở nghiên cứu tạo phôi trực tiếp từ mảnh lá.
Quan sát cấu trúc giải phẫu phôi
Khảo sát hình thái giải phẫu phôi tái sinh từ cụm mô sẹo có khả năng sinh phôi (Hình 3.13G) bằng phương pháp nhuộm hai màu và quan sát mẫu vật dưới kính hiển vi đã được thực hiện. Kết quả cho thấy phôi cầu hình thành trên bề mặt khối mô sẹo với lớp biểu mô đặc trưng (Hình 3.13H). Qua khảo sát tế bào học, Sakr và Sayed (2018) kết luận phôi Oryza sativa có nguồn gốc từ một số tế bào phôi ở phần ngoài của các cụm mô sẹo phôi hợp tử đang phát triển sinh khối trên môi trường MS có (2
- 2,5 mg/L) 2,4-D [138]. Ở trường hợp tạo phôi Carica papaya từ mô sẹo lá mầm phôi hạt, phôi tái sinh bắt nguồn từ các cấu trúc dạng cầu có có khả năng sinh tiền phôi (pre-embryogenic globular structures) hình thành từ các tế bào vùng bề mặt và dưới bề mặt của cụm mô sẹo [139]. Tương tự, các tiền phôi Tapiscia sinensis hình thành từ lớp tế bào bề mặt (surface layer) và dưới bề mặt hoặc bên trong (internally) của cụm mô sẹo có KNSP [94]. Như vậy, theo chúng tôi, phôi NGBCC tạo từ mô sẹo có KNSP cũng bắt nguồn từ hoạt động phân chia của loại mô tế bào đặc trưng tương tự như ở kết quả nghiên cứu của các tác giả nêu trên và cơ sở sinh lý của quá trình tạo phôi là do sự di chuyển phân cực của auxin, làm thay đổi lập trình di truyền của tế bào mô sẹo dẫn đến sự hình thành tế bào mang tính toàn thế - có khả năng tái sinh cơ quan [15].

Hình 3.14. Các dạng phát triển của phôi tái sinh từ mô sẹo mảnh lá, cây con hoàn chỉnh từ phôi.
A. Phôi cầu đơn; B. Phôi dạng tim; C. Giai đoạn đầu của phôi dạng thủy lôi; D,E. Phôi thủy lôi đơn và cụm 2 phôi thủy lôi phát triển; F,G,H. Phôi có lá mầm và rễ mầm phát triển đến giai đoạn trưởng thành; I. Cây con hoàn chỉnh từ phôi với lá mầm, lá thật (đơn và kép), rễ cọc điển hình và nhiều rễ phụ
Tương tự như ở quá trình nghiên cứu tạo phôi trực tiếp từ mảnh lá, trong quá trình tái sinh phôi từ mô sẹo, cũng đã ghi nhận được đầy đủ các dạng phát triển khác nhau của phôi như phôi dạng cầu (Hình 3.14A), dạng tim (Hình 3.14B), dạng thuỷ lôi (Hình 3.14C,D,E), dạng bước đầu có lá mầm, rễ mầm (Hình 3.14F,G) và dạng phôi trưởng thành (Hình 3.14H). Phôi trưởng thành phát triển bình thường thành cây con qua nuôi cấy tiếp tục trên môi trường ½MS không bổ sung chất điều hòa sinh trưởng (Hình 3.14I).
Tạo phôi từ mô sẹo mảnh lá (10 x10 mm) trong môi trường lỏng
Từ vật liệu là các cụm mô sẹo có KNSP (Hình 3.15A), nuôi cấy tái sinh phôi trong môi trường lỏng lắc cũng đã được thực hiện dùng môi trường SH có 2 mg/L NAA và 0,25 mg/L BA (kế thừa từ thí nghiệm trên). Kết quả cho thấy, phôi hình thành dần theo thời gian ở 7, 10, 14 và 30 NSC (Hình 3.15B,C,D,E,F,G).
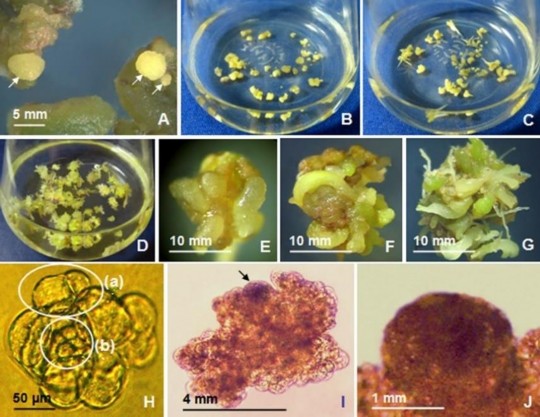
Hình 3.15. Tạo phôi từ mô sẹo có KNSP bằng phương pháp nuôi lỏng lắc, hình thái cụm tế bào phân chia, cụm mô tạo phôi.
A. Các cụm mô sẹo có KNSP làm vật liệu tạo phôi (vị trí mũi tên); B,C,D. Bình nuôi các cụm mô sẹo có KNSP giai đoạn mới cấy, 7 NSC, 30 NSC; E,F,G. Cận cảnh tạo phôi từ cụm mô sẹo có KNSP ở 10, 14, 30 NSC; H. Hình thái cụm tế bào phân chia theo hướng tạo phôi (vòng tròn (a) chỉ vị trí tế bào phân chia không cân xứng và vòng tròn (b) chỉ vị trí cụm tế bào nhỏ đẳng kính); I. Phôi dạng cầu hình thành ở giai đoạn đầu ở cụm mô có KNSP (vị trí mũi tên); J. Phôi dạng cầu phát triển (các hình H,I,J được chụp dưới kính hiển vi với độ phóng đại 50X, 20X, 20X, theo thứ tự)
Quan sát hình thái cụm tế bào/cụm mô (có nguồn gốc mô sẹo có khả năng sinh phôi) nuôi lỏng lắc
Trong quá trình theo dõi, quan sát mô sẹo nuôi lỏng lắc, ghi nhận được hai hiện tượng xảy ra có thể liên quan đến sự tạo phôi, một là, sự phân chia tế bào không đối xứng (asymmetric division/ unequal division pattern) dẫn đến sự hình thành hai tế bào không cùng kích cỡ (Hình 3.15Ha) – tương tự như ở trường hợp hình thành phôi hợp tử và nhiều trường hợp hình thành phôi vô tính [68]; hai là, sự hình thành cụm tế bào tròn nhỏ, đẳng kính (isometric), có vách dày (Hình 3.15Hb). Grzebelus và cộng sự (2012) đã ghi nhận được hiện tượng phân chia tế bào không đối xứng ở
nuôi cấy tế bào trần có nguồn gốc từ mô lá, trụ dưới lá mầm Daucus carota dẫn đến sự hình thành cụm đa bào (multi-cell colonies) có kết cấu chặt (tightly packed), tế bào dạng tròn, tế bào chất đậm đặc ở 5 – 10 NSC, với kích cỡ nhỏ hơn tế bào ban đầu; sau đó các cụm này phát triển thành cụm tiền phôi (proembryonic mass), tạo phôi cầu ở 21 – 28 NSC và phôi có lá mầm ở 30 – 60 NSC [140]. Iantcheva và cộng sự (2004) đã nghiên cứu chi tiết sự phân chia không đối xứng của quần thể tế bào đơn (100 - 200 µm) Medicago falcata đối chứng và chuyển gen (gusA) và kết luận hầu hết các tế bào có sự phân chia không đối xứng (~ 80%, 50 – 75% tế bào phân chia không đối xứng ở đối chứng và chuyển gen, theo thứ tự, ở ngày thứ 15 sau cấy) đều dẫn đến tạo phôi cầu ở giai đoạn sau cấy 20 ngày, tạo phôi trưởng thành và tạo cây con ở ngày thứ 15 – 20 sau cấy sau khi được cấy chuyển sang môi trường thích hợp [67]. Trong quần thể tế bào huyền phù Coffea arabica cv. Catimor, các tế bào dạng tròn, kích thước nhỏ, vách dày, tế bào chất đậm đặc có phân sự chia tế bào theo kiểu không đối xứng cũng dẫn đến tạo phôi [109].
Theo Friml và cộng sự (2003), ở Arabidopsis thaliana, sau sự phân chia lần thứ nhất không đối xứng thành hai tế bào gốc (basal) to và tế bào ngọn (apical) nhỏ, auxin di chuyển phân cực từ tế bào gốc đến tế bào ngọn - kích hoạt chương trình di truyền chuyển dịch tế bào ngọn sang quá trình tạo phôi [141].
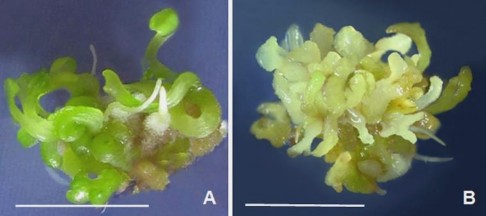
Hình 3.16. So sánh kết quả tái sinh phôi ở môi trường SH đặc và lỏng, 30 NSC.
A,B. Cụm phôi tái sinh trên môi trường đặc, lỏng (thanh ngang 10 mm).
Tuy không bố trí thí nghiệm so sánh hiệu quả phương pháp nuôi cấy tái sinh nhưng bước đầu so sánh kết quả tái sinh phôi ở môi trường SH có 2 mg/L NAA và 0,25 mg/L BA đã được thực hiện. Kết quả cho thấy phôi tái sinh từ mô sẹo nuôi lỏng lắc đạt số lượng gần gấp đôi (21,4) số phôi tái sinh trên môi trường đặc (12,6) (Hình
76
3.16A,B), có thể do sự hấp thu nước, chất dinh dưỡng, chất điều hòa sinh trưởng của mô tế bào trong môi trường lỏng tốt hơn [142]. Kết quả tái sinh phôi tích cực trong môi trường lỏng tạo điều kiện cho thí nghiệm nhân phôi quy mô lớn phục vụ nhân giống, nghiên cứu sản xuất hợp chất thứ cấp,...
3.1.2.2. Tạo phôi vô tính gián tiếp qua mô sẹo mảnh lá (3 x 10 mm)
Tạo mô sẹo
Tương tự trường hợp tạo mô sẹo từ mảnh lá (10 x 10 mm), các mảnh lá kích thước nhỏ (3 x 10 mm) cũng được nuôi cấy tạo mô sẹo trên môi trường SH có 2,4-D với các nồng độ khác nhau (0, 1, 2, 3 mg/L).

Hình 3.17. Mô sẹo hình thành từ mảnh lá (3 x 10 mm) ở môi trường SH có 2,4-D, 20 – 30 NSC.
A,B,C,D. Môi trường ĐC, có 2 mg/L 2,4-D ở 20 NSC, có 1 mg/L 2,4-D 30 NSC, có 2 mg/L 2,4-D 30 NSC; E. Cận cảnh sự hình thành các cụm mô sẹo nhỏ có KNSP/phôi cầu (ô vuông được phóng to thành hình E); F. Môi trường có 3 mg/L 2,4-D. Cụm mô sẹo nhỏ có KNSP, MSSP (mô sẹo sinh phôi - mũi tên đen); vị trí phôi cầu (mũi tên trắng).
Sau 20 ngày nuôi cấy, mô sẹo hình thành nhiều ở vị trí vết cắt (Hình 3.17B), đặc biệt không có hiện tượng tái sinh rễ như ở nuôi cấy mảnh lá. Ở ngày 30 sau nuôi