tiếp từ mảnh lá NGBCC đã trải qua tuần tự 04 dạng phát triển của phôi.
Quan sát sự phát sinh phôi từ mảnh lá NGBCC nhận thấy, các hình dạng khác nhau và các giai đoạn phát triển của phôi cùng xuất hiện trên cùng mẫu cấy (Hình 3.1C1,C2), điều đó chứng tỏ quá trình phát sinh phôi không đồng bộ và các tế bào khi đủ điều kiện sẽ phát sinh phôi.
Sau 60 ngày nuôi cấy, ở môi trường không bổ sung NAA/IBA, các mẫu cấy đều không phát sinh hình thái, không xuất hiện phôi, mẫu cấy hóa nâu và chết sau đó, điều đó chứng tỏ lượng chất ĐHST nội sinh ít không đủ cảm ứng phát sinh phôi. Tất cả các mẫu cấy trên môi trường ½MS, MS, B5, SH có bổ sung IBA (1; 2; 3; 4; 5; 6 mg/L), đều không ghi nhận được cấu trúc phôi xuất hiện trong suốt 60 ngày nuôi cấy (không trình bày số liệu). Ngược lại, các nghiệm thức bổ sung NAA (1; 2; 3; 4; 5; 6 mg/L) vào môi trường nuôi cấy đều có cảm ứng tạo phôi vô tính theo hướng tích cực (Hình 3.2). Điều đó chứng tỏ, sự cảm ứng tạo phôi của mảnh lá NGBCC đối với mỗi loại auxin trong môi trường nuôi cấy là khác nhau và cần có loại auxin ngoại sinh thích hợp là NAA, còn IBA hoàn toàn không thích hợp cho sự cảm ứng tạo phôi.
Kết quả (Bảng 3.1) cho thấy, tỷ lệ mẫu tạo phôi và số phôi/mẫu tăng khi tăng nồng độ NAA (1 – 5 mg/L) trong môi trường nuôi cấy, khi tăng nồng độ 6 mg/L NAA thì tỷ lệ mẫu tạo phôi và số phôi/mẫu đều giảm. Khi xét các mức nồng độ NAA và các loại môi trường khoáng, nhận thấy môi trường ½MS có bổ sung 1 mg/L NAA có tỷ lệ mẫu tạo phôi (%) và số phôi/mẫu thấp nhất (24,44% và 6,18 phôi/mẫu). Các chỉ tiêu này đạt giá trị cao nhất khi môi trường SH có bổ sung 5 mg/L NAA với tỷ lệ mẫu tạo phôi 88,89% và 19,95 phôi/mẫu (Hình 3.2L). Kết quả này có ý nghĩa khác biệt về thống kê so với tất cả các nghiệm thức còn lại. Điều đó chứng tỏ, tỷ lệ mẫu tạo phôi (%) và số phôi/mẫu chịu ảnh hưởng bởi các mức nồng độ của loại auxin thích hợp (NAA) và loại môi trường khoáng phù hợp. Như vậy, nồng độ 5 mg/L NAA là tối ưu để kích thích tạo phôi đạt hiệu quả cao nhất từ mảnh lá NGBCC, trong môi trường nuôi cấy có hàm lượng và thành phần khoáng thích hợp là SH.
Sự cảm ứng phát sinh phôi từ mô lá NGBCC chỉ ở những nghiệm thức có bổ sung NAA, số phôi phát sinh ít hoặc nhiều tùy thuộc nồng độ NAA sử dụng, điều này cho thấy vai trò của auxin ngoại sinh là mang tính quyết định. Qua vết thương của mẫu cấy làm tăng sự hấp thụ auxin ngoại sinh, sự hiện diện của auxin ngoại sinh (NAA) trong tế bào làm tăng IAA nội sinh thông qua quá trình tổng hợp IAA nội
sinh, sự gia tăng của IAA nội sinh không thể thiếu để thay đổi chương trình di truyền dẫn đến phát sinh phôi, sự cân bằng nội môi của các auxin rất quan trọng cho cảm ứng tạo phôi [90]. Sự khác nhau về loại và nồng độ auxin ngoại sinh áp dụng trong mối tương tác với sinh tổng hợp auxin nội sinh có vai trò quan trọng trong phát sinh phôi vô tính [88][89]. Vai trò của auxin ngoại sinh và sự vận chuyển phân cực của auxin, đóng vai trò quan trọng trong sự phát sinh phôi vô tính, điều này được Verma và cộng sự (2018) chứng minh trong nghiên cứu tác động của auxin ngoại sinh đến phát sinh phôi vô tính trực tiếp của Digitalis trojana [14].
Như vậy, auxin trong đó có NAA là yếu tố truyền tín hiệu cảm ứng phát sinh phôi, có vai trò quan trọng kênh thông tin tế bào - làm tế bào biến đổi đến trạng thái cuối cùng đã được chương trình hóa là phát sinh phôi vô tính [65]. Tuy nhiên khả năng đáp ứng tạo phôi của mô thực vật khác nhau đối với các loại auxin trong môi trường là khác nhau [70].
Môi trường nuôi cấy là một trong những yếu tố quan trọng nhất trong nuôi cấy in vitro, chứa thành phần và hàm lượng các chất khoáng cần thiết cho sự phát sinh phôi. Trong thí nghiệm này, sử dụng các môi trường khoáng thường sử dụng trong nghiên cứu phát sinh phôi vô tính ở họ Ngũ gia bì là MS, B5, SH [72][71][38] và
½MS. Kết quả sau 60 ngày nuôi cấy, phôi phát sinh cao nhất ở môi trường SH và thấp nhất ở môi trường ½MS, điều đó chứng tỏ thành phần và hàm lượng chất khoáng có tác động đến sự phát sinh phôi và môi trường khoáng SH thích hợp nhất cho cảm ứng tạo phôi trực tiếp từ mô lá NGBCC.
Như vậy, hiệu quả phát sinh phôi chịu ảnh hưởng bởi loại, nồng độ auxin thích hợp, hàm lượng và thành phần khoáng của môi trường nuôi cấy, trong đó auxin có vai trò quyết định. Trong nghiên cứu này, tỷ lệ % mẫu tạo phôi và số phôi/mẫu nhiều nhất ở môi trường nuôi cấy SH có 5 mg/L NAA. Đây là nghiên cứu đầu tiên thực hiện thành công tạo phôi vô tính trực tiếp từ mảnh lá NGBCC.
Thí nghiệm này, 2,4-D cũng đã được bố trí thực hiện trên NGBCC nhưng với kết quả âm tính trong tạo phôi, chỉ ghi nhận được hiện tượng hình thành mô sẹo.
Theo một số tác giả, kiểu gen thực vật [109], loại môi trường khoáng cơ bản [110], một số thành phần khoáng đơn lẻ [111], công thức môi trường nuôi cấy bao gồm chất ĐHST,..[112][70] có ảnh hưởng quan trọng đến sự hình thành phôi vô tính trực tiếp/gián tiếp.
Bảng 3.1. Ảnh hưởng của NAA và môi trường khoáng đến sự tạo phôi vô tính trực tiếp từ mô lá ở 60 NSC.
Môi trường khoáng | Tỷ lệ mẫu tạo phôi (%) | Số phôi/mẫu | |
0 | ½MS | 0.00q* | 0,00r |
1 | ½MS | 24,44p | 6,18v |
2 | ½MS | 33,33o | 6,29u |
3 | ½MS | 42,22n | 7,02s |
4 | ½MS | 52,22l | 7,74n |
5 | ½MS | 56,67k | 8,71k |
6 | ½MS | 46,67m | 7,16p |
0 | MS | 0.00q | 0,00r |
1 | MS | 57,78k | 6,58t |
2 | MS | 61,11j | 7,29p |
3 | MS | 66,67gh | 8,67k |
4 | MS | 75,56c | 10,00h |
5 | MS | 78,89b | 11,69e |
6 | MS | 68,89f | 9,07j |
0 | B5 | 0.00q | 0,00r |
1 | B5 | 47,78m | 7,11st |
2 | B5 | 51,11l | 7,47p |
3 | B5 | 56,67k | 8,36l |
4 | B5 | 65,56hi | 9,19i |
5 | B5 | 73,33d | 12,48d |
6 | B5 | 64,44i | 10,23g |
0 | SH | 0.00q | 0,00r |
1 | SH | 60.00j | 7,89m |
2 | SH | 67,78fg | 9,11ij |
3 | SH | 71,11e | 11,27f |
4 | SH | 78,89b | 15,24b |
5 | SH | 88,89a | 19,95a |
6 | SH | 74,44cd | 13,57c |
Có thể bạn quan tâm!
-
 Cơ Sở Khoa Học Của Sự Hình Thành Rễ Bất Định
Cơ Sở Khoa Học Của Sự Hình Thành Rễ Bất Định -
 Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá
Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá -
 Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi
Ảnh Hưởng Của Khối Lượng Phôi Nuôi Cấy Đến Sự Tăng Trưởng Sinh Khối Phôi -
 Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc
Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc -
 Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc. -
 Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Xem toàn bộ 180 trang tài liệu này.
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0,05 trong phép thử Duncan. Số liệu (%) được chuyển đổi sang dạng arcsin √𝑥
khi phân tích thống kê.

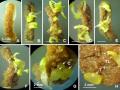
Hình 3.2. Mảnh lá tạo phôi ở môi trường ½MS, MS, B5, SH có NAA, 60 NSC.
A,B,C,D. Môi trường ½MS, MS, B5, SH có 3 mg/L NAA; E,F,G,H. Môi trường
½MS, MS, B5, SH có 4 mg/L NAA; I,J,K,L. Môi trường ½MS, MS, B5, SH có 5 mg/L NAA; thanh ngang 10 mm.
Khác với cảm ứng tạo phôi trực tiếp, quá trình tạo phôi gián tiếp có thể gây ra biến dị dòng soma ở chuỗi DNA do trải qua giai đoạn mô sẹo [113]. Do vậy, theo chúng tôi tạo phôi trực tiếp rất có ý nghĩa trong nhân giống cây trồng – nghiên cứu dựa trên nguyên tắc đồng nhất về mặt di truyền.
Quan sát cấu trúc giải phẫu phôi
Khảo sát cấu trúc giải phẫu phôi bằng phương pháp nhuộm hai màu đối với 03 thể phôi (cầu, trái tim, thủy lôi) đã được thực hiện. Quan sát dưới kính hiển vi, đã ghi nhận được lớp tế bào biểu bì (epidermis) đặc trưng ở cả 03 dạng phôi, và sự hiện diện của mạch dẫn ở cấu trúc phôi dạng thủy lôi (Hình 3.3).
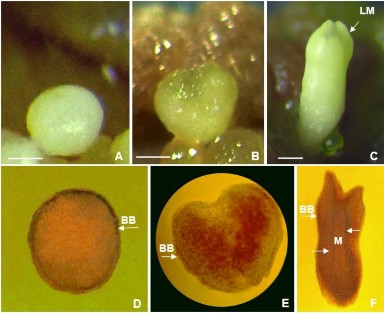
Hình 3.3. Các giai đoạn phát triển của phôi vô tính và hình thái giải phẫu phôi tương ứng.
A,B,C. Dạng phôi cầu, phôi tim, phôi thủy lôi; D,E,F. Hình thái giải phẫu tương ứng dạng phôi cầu, phôi tim, phôi thủy lôi, (LM: Lá mầm, BB: Biểu bì, M: Mạch; thanh ngang 1 mm).
3.1.1.2. Ảnh hưởng của sự kết hợp NAA và BA đến sự tạo phôi vô tính trực tiếp từ mô lá
Phân tích số liệu (Bảng 3.2) cho thấy, môi trường nuôi cấy có NAA được bổ sung BA với các mức nồng độ (0,25; 0,5; 1 mg/L) thì kết quả tạo phôi có khác biệt về thống kê giữa các nghiệm thức. Điều đó chứng tỏ, sự kết hợp của NAA và BA có ảnh hưởng đến sự phát sinh phôi. Nhận thấy, khi sử dụng BA (0,25; 0,5; mg/L) kết hợp với NAA (3, 4, 5 mg/L) mô lá có biểu hiện đáp ứng tích cực, các chỉ tiêu theo dõi đều cao hơn khi môi trường nuôi cấy bổ sung auxin (NAA) riêng lẻ, không kết hợp với BA, cụ thể tỷ lệ mẫu cấy tạo phôi và số phôi/mẫu tăng, cao nhất ở nghiệm thức có 5 mg/L NAA kết hợp với 0,25 mg/L BA (tỷ lệ mẫu tạo phôi là 94,44% và 28,56 phôi/mẫu), cao hơn nghiệm thức đối chứng 5 mg/L NAA (tỷ lệ mẫu tạo phôi 88,89% và 19,95 phôi/mẫu). Nhưng các nghiệm thức có NAA (3, 4, 5 mg/L) khi bổ sung 1 mg/L BA, thì mẫu cấy tạo phôi chậm, tỷ lệ tạo phôi và số phôi/mẫu đều giảm, thấp nhất ở nghiệm thức có 5 mg/L NAA và 1 mg/L BA (tỷ lệ mẫu tạo phôi 57,78% và 9,67 phôi/mẫu). Như vậy, khi bổ sung BA với nồng độ tối ưu đã phát huy vai trò của NAA trong quá trình phân bào và phát sinh phôi vô tính trực tiếp với hiệu quả
cao nhất. Từ kết quả trên cho thấy, sự hiện diện của auxin (NAA) kết hợp với cytokinin (BA) là cần thiết cho quá trình phát sinh phôi NGBCC, sự tương tác này có tác động tích cực và hiệu quả khi nồng độ của chất ĐHST thích hợp (Hình 3.4D,E). Bảng 3.2. Ảnh hưởng của kết hợp NAA và BA đến sự tạo phôi vô tính trực tiếp từ mảnh lá, ở môi trường SH, 60 NSC.
BA (mg/L) | Tỷ lệ mẫu tạo phôi (%) | Số phôi/mẫu | |
3 | 0 | 71,11g* | 11,27h |
4 | 0 | 78,89e | 15,24e |
5 | 0 | 88,89c | 19,95b |
3 | 0,25 | 75,56f | 15,78e |
4 | 0,25 | 82,22d | 18,83c |
5 | 0,25 | 94,44a | 28,56a |
3 | 0,5 | 72,22g | 12,67g |
4 | 0,5 | 80,00e | 18,00d |
5 | 0,5 | 91,11b | 20,67b |
3 | 1 | 67,78h | 10,67i |
4 | 1 | 65,56i | 14,33f |
5 | 1 | 57,78j | 9,67j |
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0,05 trong phép thử Duncan. Số liệu (%) được chuyển đổi sang dạng arcsin √𝑥
khi phân tích thống kê.
Trong nuôi cấy in vitro, đa số các thực vật (có khuynh hướng tái sinh phôi) đều có nhu cầu auxin và cytokinin nhằm đáp ứng tạo phôi vô tính. Auxin ngoại sinh/bổ sung giúp điều hòa và cân bằng lượng auxin nội sinh [70], cytokinin cùng với auxin kích thích sự phân bào, và cả hai có tác động cộng hưởng đối với nhiều quá trình sinh học ở thực vật và mô nuôi cấy, do vậy cũng có vai trò quan trọng trong tạo phôi [82]. Ở NGBCC, tổ hợp NAA và BA ở nồng độ thích hợp đã cho kết quả tạo phôi tích cực - phù hợp với nhận định chung về vai trò kết hợp của auxin và cytokinin đối với tạo phôi như đã nêu trên.

Hình 3.4. Mảnh lá tạo phôi trực tiếp ở môi trường SH có NAA và BA, 60 NSC. A,B,C. Môi trường SH có 4 mg/L NAA và BA 0,25; 0,5; 1 mg/L; D,E,F. Môi trường SH có 5 mg/L NAA và BA 0,25; 0,5; 1 mg/L. Thanh ngang 5 mm.
Kết quả tác động tích cực của BA đối với sự hình thành phôi NGBCC ở nghiên cứu này phù hợp với kết quả nghiên cứu của Kharwanlang và cộng sự (2016a) khi bổ sung thêm kinetin/BA (0,25 – 5 mg/L) vào môi trường dùng tạo phôi Panax pseudoginseng [71]. Trong nuôi cấy in vitro, đa số các thực vật (có khuynh hướng tái sinh phôi) đều có nhu cầu auxin và cytokinin nhằm đáp ứng tạo phôi vô tính. Auxin ngoại sinh/bổ sung giúp điều hòa và cân bằng lượng auxin nội sinh [70], cytokinin cùng với auxin kích thích sự phân bào và cả hai có tác động cộng hưởng đối với nhiều quá trình sinh học ở thực vật và mô nuôi cấy và do vậy cũng có vai trò quan trọng trong tạo phôi [82]. Từ nuôi cấy mảnh lá mầm phôi hợp tử Cucumis sativa trên môi trường có BA ở điều kiện chiếu sáng, Li và cộng sự (2007) nhận thấy BA, ngoài tác động làm tăng kích thước mảnh lá mầm cũng đã làm tăng hàm lượng cytokinin nội sinh [5]. Qua nghiên cứu mối liên quan giữa hàm lượng chất ĐHST nội sinh với các giai đoạn phát triển khác nhau của phôi vô tính từ nuôi cấy mô phôi hợp tử Ormosia henryi, Gaoyin và cộng sự (2020) [12] nhận thấy hàm lượng auxin đạt cao ở giai đoạn phát triển và sự phân cực của phôi (tỷ lệ IAA/CKs, AUX/CKs cao), và hàm
lượng cytokinin cũng cao ở giai đoạn trưởng thành và nẩy mầm của phôi (tỷ lệ IAA/CKs, AUX/CKs giảm).
Như vậy, chất ĐHST ngoại sinh có vai trò không thể thay thế trong cảm ứng tạo phôi vô tính và nồng độ của chúng ảnh hưởng đến sự cân bằng chất ĐHST nội sinh trong đó có cytokinin, giúp điều hòa sự tăng trưởng và phát sinh hình thái. Ở NGBCC, tổ hợp NAA và BA ở nồng độ thích hợp đã cho kết quả tạo phôi tích cực - phù hợp với nhận định chung về vai trò kết hợp của auxin và cytokinin đối với tạo phôi như đã nêu trên.
3.1.1.3. Ảnh hưởng của nồng độ đường và điều kiện chiếu sáng đến sự tạo phôi vô tính trực tiếp từ mô lá
Kết quả sau 60 ngày nuôi cấy (Bảng 3.3, Hình 3.5) cho thấy, nồng độ sucrose 50 g/L ở trường hợp chiếu sáng đã có ảnh hưởng tích cực nhất đến sự phát sinh phôi vô tính (Hình 3.5C) so với các trường hợp nồng độ sucrose còn lại và so với trường hợp để mẫu trong tối, tỷ lệ mẫu tạo phôi và số phôi/mẫu lần lượt là 98,89% và 35,95 phôi/mẫu. Khi nồng độ sucrose cao đã làm tăng khả năng giữ nước của môi trường, tế bào nhận nước từ môi trường kém thuận lợi - mô khô hơn do vậy kích thích sinh lý tế bào biến đổi mạnh, tạo thuận lợi cho quá trình phát sinh phôi. Khi nồng độ sucrose ở môi trường nuôi cấy tăng cao 70 g/L làm tỷ lệ mẫu tạo phôi và số phôi/mẫu giảm (tương ứng là 87,78% và 18,72 phôi/mẫu), do áp suất thẩm thấu tăng cao nên tế bào bị ‘sốc’ thiếu nước, sinh lý tế bào bị ức chế, trao đổi chất giảm. Khi nồng độ sucrose giảm còn 10 g/L thì quá trình tạo phôi giảm rõ rệt, phát sinh hình thái chậm dù vẫn ở điều kiện sáng. Nghiệm thức có 50 g/L sucrose ở điều kiện tối không khác biệt về mặt thống kê so với nghiệm thức 10 g/L sucrose ở điều kiện sáng khi xét về tỷ lệ % mẫu tạo phôi, nhưng số phôi/mẫu có khác biệt rõ. Như vậy, với các mức nồng độ sucrose khác nhau trong điều kiện chiếu sáng khác nhau đã có ảnh hưởng khác biệt lên hiệu quả phát sinh phôi vô tính trực tiếp từ mô lá NGBCC, ở điều kiện chiếu sáng phát sinh phôi hiệu quả hơn trong điều kiện tối hoàn toàn, vì ở điều kiện chiếu sáng có ảnh hưởng đến quang hợp của mẫu cấy.
Trong điều kiện nuôi cấy in vitro, mô và tế bào thực vật sống chủ yếu theo phương thức dị dưỡng hoặc bán dị dưỡng nhờ điều kiện ánh sáng nhân tạo và lục lạp có khả năng quang hợp, mẫu cấy chủ yếu sử dụng dinh dưỡng từ môi trường nuôi cấy. Vì vậy, việc bổ sung đường vào môi trường nuôi cấy và bố trí mẫu cấy ở những