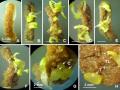
Hình 3.29. Tạo cây con từ phôi vô tính nuôi lỏng lắc trong môi trường MS, ½MS
A. Vật liệu phôi đơn nuôi cấy tạo cây; B,C. Phôi nuôi trong môi trường MS, ½MS ở 14 NSC; D,E. Phôi đơn trong môi trường MS, ½MS ở 14 NSC; F. Cụm phôi mới cấy chuyển sang môi trường đặc ½MS. G,H,I. Phôi nuôi cấy trên môi trường đặc ½MS ở 15, 30 và 60 NSC; J,K,L. Cây từ phôi trồng ra đất ở 7, 30, 45 ngày sau trồng.
Việc sử dụng môi trường có hàm lượng khoáng thấp (½MS), không hoặc có bổ sung chất ĐHST với nồng độ thấp và lượng đường thấp (10 – 20 g/L) nhằm nuôi phôi nhằm mục đích tạo cây được ghi nhận là mang tính quyết định.. Môi trường
½MS cũng đã được kết luận là phù hợp đối với phôi Brassica oleracea L. var. Italica (từ nuôi cấy trong môi trường lỏng) nhằm tạo chồi (½MS, 1 mg/L BA) và tạo cây trên môi trường đặc (½MS không có chất điều hòa sinh trưởng) [169]. Phôi mang chồi Ranunculus sceleratus (chưa có rễ, 1 - 2 cm) cũng được cấy chuyển sang môi trường ½MS, ½vit B5, 10 g/L đường để tạo rễ và phát triển thành cây con [170]. Nói chung, việc sử dụng môi trường có hàm lượng khoáng thấp, giảm thiểu hàm lượng/không sử dụng chất điều hòa sinh trưởng và đường là nguyên tắc nuôi cấy phổ biến ở giai đoạn này [68][149], và nuôi cấy phôi nhằm tạo cây ở NGBCC là phù hợp với các nghiên cứu.
3.2.3. Quan sát cấu trúc giải phẫu phôi sơ cấp và phôi thứ cấp
Khảo sát hình thái giải phẫu mô tế bào phôi bắt đầu có lá mầm phát sinh từ thân (trụ dưới lá mầm) phôi sơ cấp nuôi cấy trên môi trường đặc (Hình 3.30A), phôi cầu tạo từ thân phôi sơ cấp nuôi cấy trong môi trường lỏng (Hình 3.30D), phôi cầu hình thành từ lá mầm (Hình 3.30H) và rễ phôi sơ cấp (Hình 3.30J) đã được thực hiện. Từ kết quả thu được, theo chúng tôi, phôi thứ cấp phát sinh từ sự phân chia của một/vài/nhiều tế bào/lớp tế bào bên ngoài thuộc vùng vỏ (cortex) của thân phôi sơ cấp (Hình 3.30B,C,E,F), cũng không ghi nhận được sự thay đổi nhiều của mô tế bào
ở gần/vị trí mạch dẫn. Tương tự, phôi thứ cấp phát sinh từ lá mầm có nguồn gốc từ lớp biểu mô của lá mầm phôi sơ cấp (Hình 3.30I) và phôi thứ cấp từ rễ có nguồn gốc từ biểu mô vùng vỏ rễ phôi sơ cấp (Hình 3.30K).
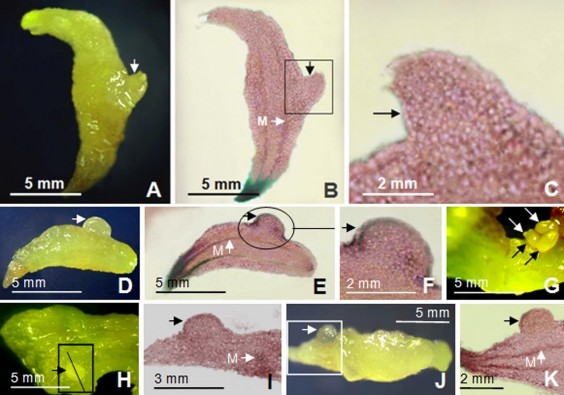
Hình 3.30. Hình thái giải phẫu của phôi sơ cấp và thứ cấp.
A,B,C. Phôi thứ cấp hình thành trên thân phôi sơ cấp ở môi trường đặc, hình thái giải phẫu tương ứng. D,E,F. Phôi thứ cấp hình thành trên thân phôi sơ cấp ở môi trường lỏng, hình thái giải phẫu tương ứng. G,H,I. Phôi thứ cấp hình thành từ lá mầm phôi sơ cấp ở mặt dưới, mặt trên, hình thái giải phẫu tương ứng, (vạch đen chỉ vị trí cắt thu lát mỏng tế bào); J,K. Phôi thứ cấp hình thành ở phần rễ phôi sơ cấp, hình thái giải phẫu tương ứng, hình vuông chỉ vị trí vùng rễ khảo sát; mũi tên đen/trắng chỉ vị trí phôi thứ cấp; M: mạch dẫn ở thân phôi, ở lá mầm và rễ phôi; hình chụp dưới kính hiển vi soi nổi với độ phóng đại 20X)
Sukhada và cộng sự (2010) đã sử dụng kỹ thuật hóa mô để khảo sát sự hình thành phôi thứ cấp từ phôi sơ cấp chuối (cv. Nanjangud Rasbale) (tái sinh từ mô sẹo có khả năng sinh phôi từ hoa đực non nuôi cấy trên môi trường MS có 18,10 μM 2,4- D, 5,37 μM NAA và 5,71 μM IAA) với kết quả đã ghi nhận được phôi thứ cấp hình thành trực tiếp từ lớp biểu bì (epidermis) của phôi sơ cấp, không qua trung gian giai đoạn mô sẹo theo hai cách, một là, phôi thứ cấp có nguồn gốc từ tế bào đơn biểu mô
95
của phôi cầu sơ cấp non; hai là, phôi thứ cấp có nguồn gốc từ nhiều tế bào biểu mô lá mầm của phôi sơ cấp trưởng thành [171]. Trong nghiên cứu tạo phôi NGBCC, đã ghi nhận được sự hình thành phôi cầu thứ cấp cấp 2 (tertiary) ở mặt dưới của lá (Hình 3.30G, vị trí mũi tên trắng) từ phôi cầu thứ cấp cấp 1; theo chúng tôi, phôi này cũng có thể có nguồn gốc từ tế bào biểu mô phôi cầu tương tự kết luận của các tác giả vừa nêu trên.
Phôi thứ cấp Arabidopsis thaliana (L.) Heynh hình thành trực tiếp từ lớp tế bào bề mặt và dưới bề mặt, mặt trên lá mầm phôi hợp tử non nuôi cấy trên môi trường B5 có 5 µM 2,4-D [172]; tương tự, ở Dendrobium cv. Chiengmai Pink, phôi thứ cấp phát sinh từ các lớp tế bào biểu bì mặt trên, ở vị trí đầu lá và gần vị trí cắt của đoạn lá mầm phôi sơ cấp (1 tháng tuổi, nuôi cấy trên môi trường ½MS có 1 mg/L TDZ) [91]. Và ở Pistacia vera, phôi hình thành có nguồn gốc tế bào biểu mô hoặc dưới biểu mô của lá [173].
Cũng qua khảo sát mô tế bào, Wang và cộng sự (2014) cho rằng ngoài tái sinh phôi theo cách thông qua mô sẹo, các tiền phôi đa bào (multicellular proembryos) cũng được hình thành trực tiếp từ lớp tế bào bề mặt (surface layer) của phôi non Tapiscia sinensis qua nuôi cấy trên môi trường MS có bổ sung 1 mg/L 2,4-D, 0,5% than hoạt tính [94].
Xu và cộng sự (2019) đã ghi nhận được sự hình thành trực tiếp phôi thứ cấp Ranunculus sceleratus từ bề mặt các loại mẫu cấy nh mảnh lá (1 – 1,5 cm2), đoạn thân và đoạn rễ (1 - 2 cm) của cây mầm (2 tuần tuổi, cao 4 – 5 cm, có nguồn gốc phôi hợp tử) nuôi cấy trên môi trường MS có nồng độ NAA cao (10 mg/L) [170]. Phôi thứ cấp hình thành trực tiếp từ đoạn rễ (~ 8 mm) cây mầm (7 ngày tuổi, từ phôi hợp tử Brassica oleracea L. var. Italica) nuôi cấy trong môi trường MS có 1 mg/L 2,4-D, tuy nhiên phôi thứ cấp lại có nguồn gốc từ các lớp tế bào trụ bì (pericycle cell layers) gần hệ mạch [169]. Ở Quercus robur L., Zegzouti và cộng sự (2001) đã ghi nhận được hai kiểu sinh phôi thứ cấp khác nhau từ vật liệu nuôi cấy là thân và rễ phôi sơ cấp (đã bỏ lá mầm): một là, sinh phôi gián tiếp, ở trường hợp này có sự phân chia tế bào ở mô vùng vỏ dẫn đến sự hình thành mô sẹo, sau đó tạo các khối phôi thứ cấp tròn từ vùng mô có khả năng phân bào mạnh ở mặt ngoài) mô sẹo; hai là, sinh phôi trực tiếp, có hai trường hợp xảy ra: (1) sự phân chia tế bào biểu bì trên diện rộng, và
96
(2) sự phân chia của một số tế bào biểu bì (3 – 4 tế bào) dẫn đến kết quả tạo phôi thứ cấp [76].
Như vậy, sự sinh phôi thứ cấp từ thân, lá và rễ phôi sơ cấp ở NGBCC cũng theo hướng chung của sự sinh phôi thứ cấp nói chung ở thực vật/cây trồng – tương tự như kết quả của một số tác giả nêu trên.
3.3. Tạo rễ bất định
3.3.1. Tạo rễ bất định trực tiếp từ mô lá
3.3.1.1. Ảnh hưởng của auxin (NAA/IBA) và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mô lá
Ảnh hưởng của auxin (NAA/IBA) và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (10 x10 mm)
Ở nghiệm thức đối chứng, môi trường nuôi cấy không bổ sung chất ĐHST (NAA/IBA), các mẫu cấy đều không có biểu hiện đáp ứng tạo rễ 30 NSC.
Trên môi trường nuôi cấy MS, ½MS, B5, SH có bổ sung IBA ở nồng độ từ (0,5 – 5mg/L), kết quả cho thấy sau 30 ngày nuôi cấy các mẫu cấy mảnh lá hoàn toàn không có biểu hiện cảm ứng tạo rễ ở tất cả các nghiệm thức (không trình bày số liệu, Hình 3.31A,B).
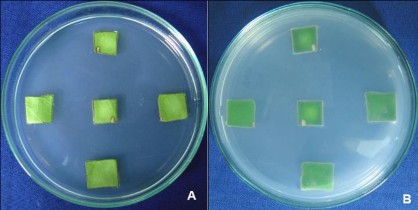
Hình 3.31. Đĩa cấy mảnh lá trên môi trường ½MS có 3 mg/L NAA, 30 NSC.
A. Mặt trên của đĩa cấy mảnh lá, B. Mặt dưới của đĩa cấy mảnh lá
Sau 30 ngày nuôi cấy mẫu trên môi trường MS, ½MS, B5 và SH có NAA ở tất cả các nghiệm thức, kết quả cho thấy có sự tác động rõ rệt của NAA đến khả năng tạo rễ xét ở tất cả các chỉ tiêu như tỷ lệ (%) mẫu tạo rễ, số rễ/mẫu, chiều dài rễ (mm) thể hiện ở (Bảng 3.15, Hình 3.32, Hình 3.33, Hình 3.34, Hình 3.35).
Quan sát mẫu cấy ở nghiệm thức có bổ sung NAA sau 7 ngày cho thấy, mô xung quanh vết cắt có biểu hiện trương to và rễ xuất hiện ở ngày thứ 12 – 15. Tỷ lệ
97
mẫu ra rễ, số rễ/mẫu, chiều dài rễ tăng theo nồng độ NAA (0,5 - 3 mg/L), hiệu quả cao nhất ở 3 mg/L NAA. Khi nồng độ NAA tăng trong khoảng 4, 5 mg/L, giá trị các chỉ tiêu theo dõi đều giảm. Mặt khác, trên các môi trường nuôi cấy khác nhau khi bổ sung NAA có cùng nồng độ, kết quả về các chỉ tiêu theo dõi khác nhau, chứng tỏ sự phát sinh rễ bất định chịu ảnh hưởng bởi các mức nồng độ khác nhau của NAA và các môi trường khoáng khác nhau. Trong nghiên cứu này cho thấy, hiệu quả tạo rễ trên môi trường ½MS là cao nhất với tỷ lệ mẫu tạo rễ đạt 100%, số rễ/mẫu 69,78; chiều dài rễ (mm) 16,96, kết quả này khác biệt với các nghiệm thức còn lại, rễ hình thành sớm hơn ở ngày thứ 12 sau cấy, so với các môi trường còn lại. Rễ hình thành nhiều ở xung quanh vết cắt, có màu trắng, nhiều lông hút trên tất cả các loại môi trường.
Trên môi trường B5 có 3 mg/L NAA, rễ có kích thước dài nhất (18,68 mm). Ở nghiệm thức có bổ sung 3 mg/L NAA, rễ ngắn nhất ghi nhận được khi mẫu nuôi cấy ở môi trường MS (11,33 mm).
Bảng 3.15. Ảnh hưởng của NAA và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mảnh lá (10 x 10 mm), ở môi trường ½MS, 30 NSC.
Môi trường khoáng | Tỷ lệ mẫu tạo rễ (%) | Số rễ/mẫu | Chiều dài rễ (mm) | |
0 | MS | 00,0r* | 00,0p | 0,00o |
0,5 | MS | 62,22q | 11,61n | 8,63l |
1 | MS | 64,45o | 15,92l | 9,22k |
2 | MS | 70,00lm | 23,71g | 10,44j |
3 | MS | 84,45h | 30,32e | 11,33i |
4 | MS | 81,11ij | 26,60f | 8,25m |
5 | MS | 66,67n | 20,82j | 7,54n |
0 | ½MS | 00,0o | 00,0p | 0,00o |
0,5 | ½MS | 80,00j | 18,49k | 12,28h |
1 | ½MS | 84,44h | 26,76f | 13,50f |
2 | ½MS | 91,11cd | 43,56c | 15,54d |
3 | ½MS | 100,00a | 69,78a | 16,96b |
4 | ½MS | 94,45b | 56,41b | 10,56j |
5 | ½MS | 88,89ef | 36,05d | 9,54k |
0 | B5 | 00,0o | 00,0p | 0,00o |
0,5 | B5 | 68,89m | 9,46o | 13,71f |
1 | B5 | 75,56k | 12,72mn | 14,50e |
2 | B5 | 86,67g | 18,68k | 16,57c |
3 | B5 | 92,22c | 26,53f | 18,68a |
4 | B5 | 90,00de | 23,15gh | 11,52i |
5 | B5 | 82,22i | 16,33l | 10,66j |
0 | SH | 00,0o | 00,0p | 0,00o |
0,5 | SH | 63,33po | 11,67n | 9,56k |
1 | SH | 66,67n | 13,98m | 10,81j |
2 | SH | 74,45k | 21,89hi | 11,38i |
3 | SH | 87,78fg | 29,08e | 12,69g |
4 | SH | 82,22i | 26,15f | 9,22k |
5 | SH | 71,11l | 16,89l | 8,69l |
Có thể bạn quan tâm!
-
 Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc. -
 Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của Naa Và Ba Đến Tạo Phôi Từ Mô Sẹo Mảnh Lá (3 X 10 Mm), Ở Môi Trường Sh, 30 Nsc. -
 Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc.
Nhân Phôi Qua Nuôi Cấy Lỏng Lắc Trong Môi Trường Sh, 30 – 60 Nsc. -
 Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Rễ Bất Định Trực Tiếp Từ Mảnh Lá (3 X 10 Mm), Ở Môi Trường ½Ms, 30 Nsc.
Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Rễ Bất Định Trực Tiếp Từ Mảnh Lá (3 X 10 Mm), Ở Môi Trường ½Ms, 30 Nsc. -
 Minh Họa Sự Tái Sinh Rễ Trực Tiếp Và Khảo Sát Hình Thái Giải Phẫu Rễ Tái Sinh Trực Tiếp
Minh Họa Sự Tái Sinh Rễ Trực Tiếp Và Khảo Sát Hình Thái Giải Phẫu Rễ Tái Sinh Trực Tiếp -
 Ảnh Hưởng Của Naa, Iba Đến Sự Phân Nhánh Rễ, Ở Môi Trường ½Ms, 21 Nsc.
Ảnh Hưởng Của Naa, Iba Đến Sự Phân Nhánh Rễ, Ở Môi Trường ½Ms, 21 Nsc.
Xem toàn bộ 180 trang tài liệu này.
*Các chữ cái khác nhau trong một cột thể hiện sự khác biệt có ý nghĩa ở mức p ≤ 0, 05 trong phép thử Duncan. Số liệu (%) được chuyển đổi sang dạng arcsin √𝑥 khi phân tích thống kê.

Hình 3.33. Tạo rễ trực tiếp từ mảnh lá (10 x 10 mm) ở môi trường ½MS, có NAA, 30 NSC. A. 0,5 mg/L, B. 1 mg/L, C. 2 mg/L, D. 3 mg/L, E. 4 mg/L, F. 5 mg/L. |

Hình 3.35. Tạo rễ trực tiếp từ mảnh lá (10 x 10 mm) ở môi trường SH, có NAA, 30 NSC. A. 0,5 mg/L, B. 1 mg/L, C. 2 mg/L, D. 3 mg/L, E. 4 mg/L, F. 5 mg/L. |
Ảnh hưởng của auxin (NAA/IBA) và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mảnh lá ( 3 x 10 mm)
Tương tự như trường hợp mẫu cấy mảnh lá (10 x10 mm), sau 30 ngày cấy ở nghiệm thức đối chứng (không có NAA) và tất cả các nghiệm thức có IBA (0,5 – 5
mg/L) hoàn toàn không ghi nhận được hiện tượng tạo rễ. Như vậy, lần nữa cho thấy mô lá hoàn toàn không có biểu hiện cảm ứng phát sinh rễ bất định đối với IBA.
NAA có tác động tích cực đến cảm ứng tạo rễ, mẫu cũng có đáp ứng tạo mô sẹo tuy không nhiều sau 5 ngày sau nuôi cấy trên môi trường MS và rễ xuất hiện sớm ở ngày thứ 12 nuôi cấy. Các nồng độ khác nhau của NAA đều có tác động kích thích quá trình tạo rễ, giá trị các chỉ tiêu theo dõi tăng tỷ lệ thuận với nồng độ NAA (0,5 - 3 mg/L), giảm khi nồng độ NAA cao hơn 3 mg/L (Bảng 3.16). Môi trường tạo rễ bất định hiệu quả nhất vẫn là ½MS có 3 mg/L NAA cụ thể tỷ lệ mẫu tạo rễ 100%; số rễ/mẫu 19,67; chiều dài rễ (6,29 mm), rễ hình thành sớm sau 10 ngày cấy. Rễ hình thành trên môi trường ½MS và B5 (Hình 3.37, 3.38) đều dài hơn rễ ở môi trường MS, SH (Hình 3.36, 3.39). Các giá trị trung bình của các chỉ tiêu theo dõi đều có sự khác biệt về mặt thống kê.
Kết quả đáp ứng nhanh của mẫu cấy mảnh lá có kích thước nhỏ (3 x 10 mm), tỷ lệ mẫu tạo rễ cao hơn so với mẫu cấy mảnh lá có thể do mẫu cấy có kích thước nhỏ, bề mặt tiếp xúc với môi trường lớn; nên tiếp nhận các chất từ môi trường nhanh hơn. Tuy nhiên, chiều dài rễ ngắn hơn so với rễ từ mảnh lá ở cùng điều kiện nuôi cấy, có thể do hàm lượng chất nội sinh trong mẫu ít hơn.
Nói chung, vật liệu mô lá, như một hệ thống nuôi cấy chứa protein sắc tố nhạy sáng phytochrome, thường được sử dụng trong nghiên cứu tạo rễ bất định vì: (1) auxin ngoại sinh có thể tác động dễ dàng đến loại tế bào có nhiều tiềm năng (tế bào liên kết với mạch dẫn) dẫn đến phân chia, biệt hóa tạo một cơ quan nhất định trong đó có rễ [174][175]; (2) lá còn chứa mô tế bào khuyết cũng có thể phản biệt hóa và tái biệt hóa tạo sơ khởi rễ dưới tác động của auxin ngoại sinh trong quá trình nuôi cấy như ở trường hợp tái sinh rễ Sainpaulia ionantha [103]; (3) lá cũng là cơ quan có khả năng sinh tổng hợp auxin nội sinh - có thể có liên quan nhất định đến sự tạo sơ khởi rễ [176]. Theo Yu và cộng sự (2017), rễ bất định tái sinh từ mảnh lá Arabidopsis thaliana là kết quả của một số hoạt động sinh lý trong mô tế bào như: (1) Auxin nội sinh được vận chuyển đến các tế bào có khả năng tái sinh (procambium và tế bào nhu mô mạch), kích chuyển tái lập trình di truyền các tế bào này thành các tế bào ‘nguồn’;
(2) Các tế bào ‘nguồn’ phát triển thành sơ khởi rễ - nơi tích tụ auxin cao; (3) Các tế bào sơ khởi rễ tiếp tục phân chia tạo mô phân sinh đầu rễ - nơi auxin giảm tích tụ; (4) Đầu rễ đạt mức trưởng thành, tiếp tục phát triển ra khỏi mảnh lá [176].