2.4.2.2. Ảnh hưởng của khối lượng phôi nuôi cấy đến sự tăng trưởng sinh khối phôi
Vật liệu nuôi cấy: sử dụng phôi qua nuôi cấy lỏng lắc sau 60 ngày nuôi cấy từ phôi 60 ngày tuổi của các thí nghiệm tạo phôi vô tính trực tiếp từ mô lá.
Để khảo sát ảnh hưởng khối lượng phôi nuôi cấy đến sự tăng trưởng sinh khối phôi, sử dụng khối lượng phôi ban đầu như sau: 0,3; 0,6; 1,2; 1,8 g tương ứng với 0,5%, 1%, 2% và 3% (w/v) vào bình tam giác V250 mL chứa 60 mL môi trường nuôi cấy kế thừa thí nghiệm ảnh hưởng chất ĐHST, 30 g/L đường. Thu thập số liệu về khối lượng tươi phôi (g), hệ số nhân phôi (lần) và đặc điểm hình thái phôi/cụm phôi ở 30 NSC.
Thí nghiệm bố trí theo kiểu đơn yếu tố, cấy 3 bình/lần lặp lại, mỗi nghiệm thức lặp lại 3 lần. Quan sát, theo dõi và thu thập số liệu về số phôi
2.4.2.3. Ảnh hưởng của kích thước phôi nuôi cấy đến sự tạo phôi thứ cấp
Sử dụng vật liệu là các phôi vô tính với các kích thước khác nhau: kích thước nhỏ (7 - 8 mm), trung bình (~ 10 mm), to (~ 15 mm). Tiến hành cấy 30 phôi nhỏ/trung bình/to vào bình tam giác V250 mL chứa 60 mL môi trường nuôi cấy giống thí nghiệm ảnh hưởng khối lượng phôi nuôi cấy, có 30 g/L đường.
Thí nghiệm bố trí theo kiểu đơn yếu tố, cấy 3 bình/lần lặp lại, mỗi nghiệm thức lặp lại 3 lần. Quan sát, theo dõi và thu thập số liệu về số phôi thứ cấp hình thành, đặc điểm hình thái, màu sắc phôi/ cụm phôi hình thành ở 30 NSC.
2.4.2.4. Ảnh hưởng của nồng độ đường đến sự tăng trưởng sinh khối phôi
Cấy khối lượng phôi 0,3 g (0,5% - w/v) vào bình tam giác V250 mL chứa 60 mL môi trường như thí nghiệm trên, sucrose được khảo sát với các mức nồng độ (20, 30, 40, 50 g/L); mỗi nghiệm thức được lặp lại 3 lần. Thu thập số liệu về khối lượng tươi phôi (g), hệ số nhân phôi (lần) và đặc điểm hình thái, màu sắc phôi/cụm phôi ở 45 NSC. Thí nghiệm bố trí hoàn toàn ngẫu nhiên theo kiểu đơn yếu tố
2.4.2.5. Ảnh hưởng của cường độ ánh sáng đến sự tăng trưởng sinh khối phôi
Cấy khối lượng phôi 0,30 g (0,5% - w/v) vào bình tam giác V250 mL chứa 60 mL môi trường như trên, 30 g/L sucrose, nuôi ở các điều kiện chiếu sáng khác nhau: tối (0 lux), chiếu sáng với cường độ 2.000 lux (~ 27 μmol m-2 s-1), 4.000 lux (~ 54 μmol m-2 s-1), mỗi nghiệm thức lặp lại 3 lần. Quan sát, theo dõi, thu thập số liệu về
khối lượng tươi phôi (g), hệ số nhân phôi (lần), đặc điểm hình thái, màu sắc phôi/cụm phôi ở 30 NSC. Thí nghiệm bố trí hoàn toàn ngẫu nhiên theo kiểu đơn yếu tố.
2.4.2.6. Ảnh hưởng của tỷ lệ nước dừa đến sự tạo phôi thứ cấp
Các phôi đơn có kích thước trung bình (~ 10 mm) được cấy vào bình tam giác V250 mL chứa 60 mL môi trường thí nghiệm ảnh hưởng khối lượng phôi nuôi cấy trên, 30 g/L sucrose, nước dừa được khảo sát với các mức tỷ lệ (0%, 5%, 10%). Cấy 30 phôi đơn/bình, mỗi nghiệm thức lặp lại 3 lần. Thu thập số liệu về số phôi hình thành, đặc điểm hình thái, màu sắc phôi/cụm phôi ở 21 NSC.
Thí nghiệm bố trí hoàn toàn ngẫu nhiên theo kiểu đơn yếu tố
2.4.2.7. Tạo cây con từ phôi nuôi lỏng lắc
Sử dụng các phôi đơn có kích thước trung bình (~ 10 mm), cấy vào bình tam giác V250 mL chứa 60 mL môi trường MS hoặc ½MS (1/2 khoáng đa lượng) [105] không bổ sung chất điều hòa sinh trưởng, 20 g/L sucrose, cấy 30 phôi đơn/bình, mỗi nghiệm thức lặp lại 3 lần; quan sát, ghi nhận sự phát triển phôi đến giai đoạn trưởng thành ở 14 NSC. Sau đó, cấy chuyển phôi sang môi trường đặc thích hợp (kế thừa kết quả thí nghiệm) để phôi phát triển thành cây con trong 60 ngày.
2.4.3. Quan sát cấu trúc giải phẫu phôi sơ cấp và thứ cấp
Cắt tạo các LMTB dọc thân phôi/rễ, ngang phiến lá mầm (của phôi sơ cấp) mang phôi thứ cấp bằng dao lam, mẫu cắt được nhuộm bằng phương pháp nhuộm kép của Bộ môn Thực vật - Khoa Dược, ĐH. Y Dược TP. HCM [43]. Quan sát tiêu bản bằng kính hiển vi soi nổi Leica (vật kính 20X) và chụp hình.
2.4.4. Các chỉ tiêu theo dõi và phương pháp xác định
Số phôi/cụm phôi = Tổng số phôi/số cụm phôi
Hệ số nhân phôi = Số phôi/cụm phôi
𝑆ố 𝑝ℎô𝑖 𝑐ấ𝑦/𝑐ụ𝑚
Khối lượng tươi phôi thu nhận (g): Thu và cân sinh khối lượng phôi ở mỗi nghiệm thức sau 30 ngày nuôi.
Hệ số nhân sinh khối phôi (lần) = 𝐾ℎố𝑖 𝑙ượ𝑛𝑔 𝑡ươ𝑖 𝑝ℎô𝑖 𝑡ℎ𝑢 𝑛ℎậ𝑛(𝑔)
𝐾ℎố𝑖 𝑙ượ𝑛𝑔 𝑝ℎô𝑖 𝑛𝑢ô𝑖 𝑐ấ𝑦 (𝑔)
2.5. Nội dung 3. Tạo rễ bất định
2.5.1. Tạo rễ bất định trực tiếp từ mô lá
2.5.1.1. Ảnh hưởng của auxin (NAA/IBA) và môi trường khoáng đến sự tạo rễ bất định trực tiếp từ mô lá
47
Khảo sát tác động của riêng lẻ của auxin và môi trường khoáng lên sự cảm ứng tạo rễ bất định của mô lá, nhằm xác định loại và nồng độ auxin thích hợp, trên môi trường khoáng thích hợp.
Sử dụng vật liệu là các mảnh lá I (10 x 10 mm), mảnh lá II (3 x 10 mm), cấy úp mặt trên lá tiếp xúc vào môi trường MS, ½MS, B5 và SH có bổ sung các chất ĐHST riêng lẻ NAA/IBA có cùng nồng độ (0; 0,5; 1; 2; 3; 4; 5) mg/L, 30 g/L sucrose, chiếu sáng 4.000 lux, 12 h chiếu sáng/ngày. Cấy 5 mảnh lá I/đĩa, 6 đĩa/lần lặp lại; 10 mảnh lá II/đĩa, 3 đĩa/lần lặp lại; mỗi nghiệm thức lặp lại 3 lần.
Thí nghiệm bố trí hoàn toàn ngẫu nhiên theo kiểu hai yếu tố: yếu tố về các mức nồng độ của NAA/IBA và yếu tố về môi trường khoáng với 4 môi trường khác nhau (MS, ½MS, B5, SH). Theo dõi thí nghiệm, thu thập số liệu về tỷ lệ mẫu tạo rễ (%), số rễ/mẫu, chiều dài rễ (mm) ở thời điểm 30 NSC.
2.5.1.2. Ảnh hưởng của nồng độ đường đến sự tạo rễ bất định trực tiếp từ mô lá
Nhằm khảo sát sự tác động của nồng độ đường đến sự phát sinh rễ từ các mẫu cấy mảnh lá, sử dụng môi trường khoáng với chất ĐHST (NAA/IBA) có nồng độ tạo rễ tích cực nhất (kế thừa từ thí nghiệm trên), có đường với các nồng độ khác nhau (20; 30; 40; 50 g/L) làm môi trường nuôi cấy.
Vật liệu nuôi cấy: mảnh lá I (10 x 10 mm), mảnh lá II (3 x 10 mm). Mẫu được cấy vào môi trường nuôi cấy trên với 5 mảnh lá I/đĩa, 6 đĩa/lần lặp lại; 10 mảnh lá II/đĩa, 3 đĩa/lần lặp lại; mỗi nghiệm thức lặp lại 3 lần. Thí nghiệm được bố trí hoàn toàn ngẫu nhiên, theo kiểu đơn yếu tố. Theo dõi thí nghiệm, số liệu về tỷ lệ mẫu tạo rễ (%), số rễ/mẫu, chiều dài rễ (mm) được thu thập ở thời điểm 30 NSC.
2.5.1.3. Ảnh hưởng của điều kiện chiếu sáng đến sự tạo rễ bất định trực tiếp từ mô
lá
Để khảo sát điều kiện chiếu sáng có tác động đến sự phát sinh rễ bất định từ
mảnh lá, tiến hành cấy mẫu trên môi trường khoáng, có loại và nồng độ auxin thích hợp, nồng độ sucrose có tác động hiệu quả nhất đến sự phát sinh rễ bất định từ mảnh lá (kế thừa kết quả từ hai thí nghiệm trên). Các đĩa mẫu cấy được đặt ở điều kiện chiếu sáng khác nhau 4.000 lux, 2.000 lux, tối hoàn toàn.
Sử dụng vật liệu nuôi cấy là các mảnh lá I (10 x 10 mm) và mảnh lá II (3 x 10 mm). Với mảnh lá I cấy 5 mẫu/đĩa, 6 đĩa/lần lặp lại; mảnh lá II cấy 10 mẫu/đĩa, 3 đĩa/lần lặp lại; mỗi nghiệm thức lặp lại 3 lần. Thí nghiệm được bố trí hoàn toàn ngẫu
48
nhiên, theo kiểu đơn yếu tố. Quan sát, theo dõi thí nghiệm, ghi nhận số liệu về tỷ lệ mẫu tạo rễ (%), số rễ/mẫu (tạo rễ), chiều dài rễ (mm) thu thập ở thời điểm 30 NSC.
2.5.1.4. Khảo sát hình thái giải phẫu rễ tái sinh trực tiếp từ mô lá
Cắt dọc các sơ khởi rễ 10 ngày tuổi, dài ~ 4 mm (hình thành trực tiếp ở mặt trên của mảnh lá nuôi cấy trên môi trường ½MS có 3 mg/L NAA) tạo LMTB bằng dao lam, vi phẫu được nhuộm bằng phương pháp nhuộm kép [43]. Quan sát tiêu bản bằng kính hiển vi soi nổi Leica (độ phóng đại 20X) và chụp hình.
2.5.2. Tạo rễ bất định từ chồi
2.5.2.1. Tạo rễ bất định từ chồi có nguồn gốc từ đốt thân cây vườn ươm
Khử trùng mẫu.
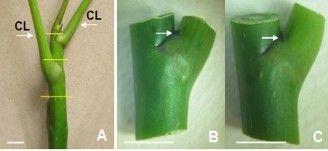
Hình 2.3. Vật liệu đốt thân dùng nuôi cấy tạo chồi.
A. Nhánh cây (vạch ngang là vị trí cắt tạo các đốt thân; CL: cuống lá); B, C. Các đốt thân dùng nuôi cấy tạo chồi (mũi tên chỉ vị trí chồi ở trạng thái ngủ) (thanh ngang 10 mm).
Sử dụng nhánh non (8 - 10 cm) cây NGBCC (Hình 2.3 A). Trước hết cắt bỏ lá, rửa nhánh dưới vòi nước chảy trong 10 phút, rửa tiếp bằng nước xà phòng. Cắt nhánh thành các đoạn mang chồi ngủ - đốt nhánh (sau đây gọi là đốt thân) dài ~ 1,5 cm, không sử dụng chồi ngọn, tiếp theo khử trùng bằng cồn 70% trong 1 phút, bằng nước Javel 30% (v/v) trong 30 phút, rửa lại 3 lần bằng nước cất vô trùng. Các đốt thân, sau khử trùng, cắt bỏ phần mô chết ở hai đầu (Hình 2.3 B, C) được dùng làm vật liệu nuôi cấy trong thí nghiệm tạo chồi.
Tạo chồi từ đốt thân cây vườn ươm
Cấy các đốt thân sau khử trùng vào môi trường MS có bổ sung 0,5 mg/L BA và 2 mg/L kinetin, 30 g/L sucrose [3]. Ghi nhận sự tạo chồi ở 60 NSC.
Tạo rễ bất định từ chồi
Tách các chồi (cao ~ 1 cm) và cấy vào môi trường tạo rễ bất định ½MS có bổ sung 0,2 mg/L NAA [3], 20 g/L sucrose, 10 g/L agar, pH 5,8; IBA cũng được sử dụng
với nồng độ 0,2 mg/L. Cấy 2 chồi nách/bình, cấy 15 bình/lần lặp lại, mỗi nghiệm thức lặp lại 3 lần. Theo dõi, ghi nhận số liệu về các chỉ tiêu: tỷ lệ chồi tạo rễ (%), số rễ/chồi, chiều dài rễ (mm) ở 60 NSC.
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên, theo kiểu đơn yếu tố
2.5.2.2. Tạo rễ bất định từ chồi đốt thân cây in vitro
Tạo chồi từ đốt thân cây in vitro
Cây in vitro ~ 5 tháng tuổi (có nguồn gốc từ phôi vô tính được nuôi trên môi trường ½MS không bổ sung chất ĐHST, có 30 g/L sucrose) được cắt bỏ toàn bộ lá, sau đó cắt thân thành các đoạn dài ~ 8 mm mang chồi nách và cấy vào môi trường tạo chồi như trên. Theo dõi sự tạo chồi ở 60 NSC.
Tạo rễ bất định từ chồi
Tách các chồi nách 60 ngày tuổi (cao 0,7 - 1 cm), cấy vào môi trường tạo rễ bất định như trường hợp trên. Cấy 2 chồi nách/bình, cấy 15 bình/lần lặp lại, mỗi nghiệm thức lặp lại 3 lần. Theo dõi, ghi nhận số liệu về các chỉ tiêu: tỷ lệ chồi tạo rễ (%), số rễ/chồi, chiều dài rễ (mm) ở 60 NSC.
2.5.2.3. Tạo rễ bất định từ chồi có nguồn gốc phôi vô tính
Sử dụng vật liệu cây con có nguồn gốc từ phôi vô tính có chiều cao thân ~ 15 mm, cắt bỏ phần rễ trụ, giữ phần thân (trụ dưới lá mầm) và các lá phía trên, dùng như vật liệu tạo rễ bất định. Mẫu được cấy vào môi trường ½MS có bổ sung NAA hoặc IBA cùng nồng độ 0,1 mg/L, 20 g/L sucrose. Cấy 2 chồi/bình, cấy 15 bình/lần lặp lại, mỗi nghiệm thức lặp lại 3 lần. Chỉ tiêu theo dõi: Tỷ lệ mẫu tạo rễ (%); số rễ/mẫu; chiều dài rễ (mm) và đặc điểm hình thái, màu sắc rễ tại thời điểm 30 NSC
2.5.3. Các chỉ tiêu và phương pháp theo dõi
Tỷ lệ mẫu tạo rễ (%) = (Số mẫu tạo rễ/số mẫu cấy) x 100% Số rễ/mẫu = Tổng số rễ/số mẫu tạo rễ
Chiều dài rễ (mm) = Tổng chiều dài các rễ/số rễ được đo
Các chỉ tiêu của thí nghiệm tạo rễ từ chồi đốt thân cây in vitro được thu thập ở 60 NSC:
= | (Số chồi tạo rễ/số chồi cấy) x 100% | |
Số rễ/chồi | = | Số rễ hình thành/số chồi tạo rễ |
Chiều dài rễ (mm) | = | Tổng chiều dài các rễ/số rễ được đo |
Có thể bạn quan tâm!
-
 Một Số Nghiên Cứu Về Sự Phát Sinh Phôi Vô Tính
Một Số Nghiên Cứu Về Sự Phát Sinh Phôi Vô Tính -
 Cơ Sở Khoa Học Của Sự Hình Thành Rễ Bất Định
Cơ Sở Khoa Học Của Sự Hình Thành Rễ Bất Định -
 Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá
Ảnh Hưởng Của Auxin (Naa/iba) Và Môi Trường Khoáng Đến Sự Tạo Phôi Trực Tiếp Từ Mô Lá -
 Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc.
Ảnh Hưởng Của Naa Và Môi Trường Khoáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá Ở 60 Nsc. -
 Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc
Ảnh Hưởng Của Nồng Độ Đường Và Điều Kiện Chiếu Sáng Đến Sự Tạo Phôi Vô Tính Trực Tiếp Từ Mô Lá, Ở Môi Trường Sh, 60 Nsc -
 Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc.
Ảnh Hưởng Của 2,4-D Đến Sự Hình Thành Mô Sẹo Có Knsp, Ở Môi Trường Sh, 30 Nsc.
Xem toàn bộ 180 trang tài liệu này.
2.6. Nội dung 4. Nhân rễ bất định trong môi trường lỏng
2.6.1. Ảnh hưởng của chất điều hòa sinh trưởng đến sự phân nhánh của rễ
Sử dụng các rễ đơn (rễ sơ cấp, dài ~ 1 cm) tái sinh trực tiếp từ mảnh lá trên môi trường đặc ½MS có 3 mg/L NAA ở thời điểm 20 NSC làm vật liệu nuôi cấy.
Cấy ~ 120 rễ đơn vào bình tam giác V250 mL chứa 60 mL (~ 0,5% - w/v) môi trường lỏng ½MS có bổ sung NAA hoặc IBA với các nồng độ khác nhau 0, 1, 2, 3 mg/L. Sau 20 ngày nuôi cấy lấy ngẫu nhiên 30 rễ/lần, 3 lần đo đếm, thu thập số liệu về chiều dài rễ sơ cấp (mm), số rễ thứ cấp cấp 1, chiều dài rễ thứ cấp cấp 1 (mm), số rễ thứ cấp (sau đây gọi là rễ nhánh) cấp 2 hình thành và đặc điểm hình thái rễ.
2.6.2. Ảnh hưởng của nồng độ đường đến sự tăng trưởng sinh khối rễ
Cấy khối lượng rễ 0,3 g (0,5% - w/v) vào bình tam giác V250 mL chứa 60 mL môi trường ½MS bổ sung NAA/IBA với nồng độ kế thừa kết quả thí nghiệm (2.6.1); sucrose với các nồng độ (20, 30 và 40 g/L). Thu thập số liệu về khối lượng tươi rễ (g), hệ số nhân rễ (lần) và đặc điểm hình thái, màu sắc rễ, cụm rễ ở thời điểm 30 NSC, mỗi nghiệm thức lặp lại 3 lần. Thí nghiệm bố trí theo kiểu hai yếu tố: yếu tố chất ĐHST (NAA, IBA) và yếu tố nồng độ sucrose với ba mức nồng độ (20, 30, 40 g/L).
2.6.3. Ảnh hưởng của khối lượng rễ nuôi cấy đến sự tăng trưởng sinh khối rễ
Để khảo sát ảnh hưởng của khối lượng rễ nuôi cấy đến tăng sinh khối rễ, sử dụng khối lượng rễ 0,35 g; 0,70 g; 1,4 g; 2,1 g tương ứng với 0,5%, 1%, 2% và 3% (w/v) vào bình tam giác V250 mL chứa 70 mL môi trường ½MS có bổ sung NAA hoặc IBA có nồng độ kế thừa thí nghiệm (2.6.1), nồng độ sucrose được sử dụng từ thí nghiệm (2.6.2). Thu thập số liệu về khối lượng tươi rễ (g), hệ số nhân rễ (lần) và đặc điểm hình thái, màu sắc rễ, cụm rễ ở 30 NSC, mỗi nghiệm thức lặp lại 3 lần. Thí nghiệm bố trí theo kiểu hai yếu tố: yếu tố chất ĐHST (NAA, IBA) và yếu tố khối lượng rễ nuôi cấy với bốn mức nồng độ (0,35; 0,7; 1,4; 2,1%).
2.6.4. Khảo sát diễn biến tăng trưởng sinh khối rễ theo thời gian
Cấy khối lượng rễ thích hợp nhất (từ kết quả của thí nghiệm 2.6.3) vào bình tam giác V250 mL chứa 70 mL môi trường nuôi cấy giống với thí nghiệm (2.6.3). Sau thời gian nuôi cấy 28 ngày, tiến hành thay 70 mL môi trường nuôi cấy có thành phần giống môi trường ban đầu. Thu thập số liệu về khối lượng tươi rễ (g), hệ số nhân rễ (lần) ở 7, 14, 21, 28, 35, 42 và 49 NSC, mỗi nghiệm thức lặp lại 3 lần. Thí nghiệm
bố trí theo kiểu hai yếu tố: yếu tố chất ĐHST (NAA, IBA) và yếu tố thời gian với các mức thời gian (7, 14, 21, 28, 35, 42, 49 ngày).
2.6.5. Các chỉ tiêu và phương pháp theo dõi
Chiều dài rễ sơ cấp (mm) = Chiều dài các rễ/số rễ được đo
Số rễ nhánh cấp 1 = Số rễ hình thành từ rễ sơ cấp/số rễ sơ cấp
Chiều dài rễ nhánh cấp 1 (mm) = Chiều dài của các rễ nhánh/số rễ nhánh Số rễ nhánh cấp 2 = 𝑇ổ𝑛𝑔 𝑠ố 𝑟ễ 𝑛ℎá𝑛ℎ ℎì𝑛ℎ 𝑡ℎà𝑛ℎ 𝑡ừ 𝑟ễ 𝑐ấ𝑝 1
𝑆ố 𝑟ễ 𝑛ℎá𝑛ℎ 𝑐ấ𝑝 1
Khối lượng tươi rễ (g): khối lượng rễ tươi thu nhận được 30 NSC Hệ số nhân (lần) = 𝐾ℎố𝑖 𝑙ượ𝑛𝑔 𝑟ễ 𝑡ℎ𝑢 𝑛ℎậ𝑛 (𝑔)
𝐾ℎố𝑖 𝑙ượ𝑛𝑔 𝑟ễ 𝑛𝑢ô𝑖 𝑐ấ𝑦 (𝑔)
2.7. Điều kiện nuôi cấy in vitro
Các thí nghiệm được thực hiện ở nhiệt độ phòng 25 - 28oC, độ ẩm trung bình 50 – 60%, các thí nghiệm đều được đặt ở ngoài sáng để dưới ánh sáng đèn huỳnh quang, chiếu sáng 12 giờ chiếu sáng/ngày, cường độ sáng ~ 4.000 lux (trừ thí nghiệm tạo phôi trực tiếp ở điều kiện tối đặt trong điều kiện tối hoàn toàn; thí nghiệm ảnh hưởng của cường độ ánh sáng đến tăng trưởng sinh khối phôi; thí nghiệm ảnh hưởng của điều kiện chiếu sáng đến tạo rễ bất định ở điều kiện sáng 2.000 lux, ở điều kiện tối mẫu đặt ở điều kiện tối hoàn toàn). Sử dụng môi trường đặc (agar 10 g/L, pH 5,8; hấp khử trùng ở 1 atm/121oC trong 20 phút); thí nghiệm trong môi trường lỏng lắc với tốc độ lắc 80 vòng/phút.
2.8. Phương pháp thống kê và xử lý số liệu
Thí nghiệm được bố trí hoàn toàn ngẫu nhiên, mỗi nghiệm thức lặp lại 3 lần. Các kết quả trung bình của 3 lần lặp lại được xử lý và phân tích bằng ANOVA một yếu tố, kiểm tra mức độ khác biệt giữa các nghiệm thức bằng LSD hoặc Duncan. Các thí nghiệm 2 yếu tố được xử lý theo phân tích phương sai đa biến một chiều (One- way MANOVA) của phép thử Duncan với p ≤ 0,05 bằng phần mềm SPSS 25.0. (Số liệu tỷ lệ % biến động từ 0 – 100% chuyển đổi sang arcsin √𝑥 khi xử lý thống kê, hoặc từ 70 – 100% được chuyển đổi sang (x + 0,5)1/2.
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Tạo phôi vô tính
Trong nghiên cứu này, phôi vô tính hình thành trực tiếp được định nghĩa là phôi tái sinh ngay ở lần nuôi cấy đầu tiên, khác với phôi tái sinh gián tiếp qua hai giai đoạn nuôi cấy là giai đoạn tạo mô sẹo và phát sinh phôi từ mô sẹo [108][109].
3.1.1. Tạo phôi vô tính trực tiếp từ mô lá
3.1.1.1. Ảnh hưởng của auxin (NAA/IBA) và môi trường khoáng đến sự tạo phôi vô tính trực tiếp từ mô lá

Hình 3.1. Các dạng phát triển của phôi vô tính hình thành trực tiếp từ mô lá.
A,B. Phôi cầu đơn, cụm phôi cầu; C. Phôi dạng tim (1) và dạng cầu (2); D. Phôi dạng thủy lôi; E,F,G,H. Phôi có lá mầm và rễ mầm phát triển; I. Cây con hoàn chỉnh lá mầm, lá thật (đơn, kép), rễ cọc điển hình. Mũi tên chỉ lá mầm (trắng), rễ mầm (đen). Thanh ngang 2 mm.
Sau 5 tuần nuôi cấy, phôi vô tính xuất hiện ở nhiều nghiệm thức, ở môi trường SH có bổ sung 5 mg/L NAA phôi xuất hiện sớm và nhiều nhất, môi trường ½MS phôi phát sinh chậm, ít hơn. Sự phân hóa cấu trúc trong quá trình phát sinh phôi từ mảnh lá NGBCC bắt đầu từ dạng phôi cầu, xuất hiện khoảng 32 – 35 NSC, có màu vàng nhạt (Hình 3.1A), giai đoạn phôi hình tim có màu xanh, xuất hiện sau đó khoảng 10 ngày, đây là dấu hiệu tiền hai lá mầm, dạng đặc trưng của sự hình thành phôi ở cây hai lá mầm (Hình 3.1C). Dạng phôi thủy lôi (Hình 3.1D) phát triển tiếp đến giai đoạn có hai lá mầm khoảng 15 – 20 ngày tiếp theo (Hình 3.1E,F,G,H). Phôi phát sinh trực






