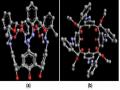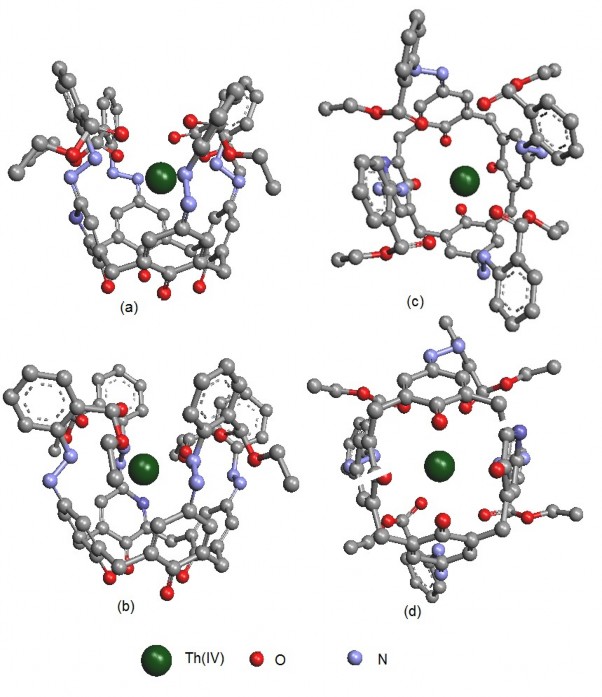
Hình 3.28. Cấu trúc phức TEAC-Th(IV) tối ưu hóa bằng ArgusLab.
(a), (b) theo hướng nhìn ngang.
(c) theo hướng từ trên xuống.
(d) theo hướng từ dưới lên.
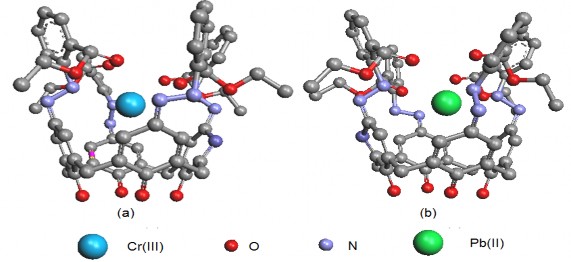
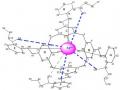
Hình 3.29. Cấu trúc phức TEAC-Cr(III) (a) và TEAC-Pb(II) (b) tối ưu bằng ArgusLab (theo hướng nhìn ngang).
Kết quả tối ưu hóa cũng phù hợp với một số nghiên cứu trước đây về phức của ion kim loại với các azocalixaren tương tự TEAC như phức Hg(II) của Ho [70], phức Pb(II) của Lu [102], và Cr(III) của Lu [104]. Theo các tác giả này, ion kim loại khu trú ở khu vực trung tâm phân tử và hình thành liên kết với các nhóm azo.
Kết luận: Bằng chương trình tối ưu hóa của phần mềm Argus Lab 4.01, chúng tôi đã khảo sát được vị trí của ion kim loại bên trong phân tử TEAC. Kết quả cho thấy ion Pb(II), Cr(III), Th(IV) có xu hướng tạo liên kết với 4 nhóm –N=N và các nguyên tử O của nhóm COOC2H5. Khoảng cách giữa các ion này với các nguyên tử N và O của TEAC phù hợp cho việc hình thành liên kết tạo phức.
Chúng tôi cũng đã tính toán được năng lượng liên kết của các dạng ion kim loại đi vào trong phức. Kết quả cho thấy ở dạng ion tự do thì năng lượng của hệ là thấp nhất. Tuy nhiên, để có kết luận chính xác dạng ion nào của kim loại tồn tại trong phức chất thì cần có thêm các thông tin về phổ IR, Raman, 1H-NMR và MS.
3.3.2. Phổ ESI-MS của thuốc thử và phức chất
Trong nghiên cứu tạo phức, đặc biệt là phức rắn, phổ khối thường xuyên được sử dụng để xác nhận khối lượng ion phân tử phức. Đối với các phức trong dung
dịch thì việc sử dụng MS khó khăn hơn nhiều. Nguyên nhân là khi sử dụng nguồn năng lượng cao để bắn phá thì phức thường bị phân hủy. Tuy nhiên, chúng tôi cũng áp dụng kĩ thuật này với hy vọng sẽ tìm được ion mẹ để minh chứng cho sự tồn tại của phức chất.
Phổ khối của hệ phức TEAC-Th(IV) trong dung môi MeOH được trình bày ở hình 3.30. Số liệu thu được cho thấy sự xuất hiện mảnh ion có m/z khối lượng 1357,45 đây chính là khối lượng của mảnh [TEAC+Th-4H]. Điều này chứng tỏ rằng khi tạo phức TEAC đã loại bỏ hoàn toàn 4 ion H+ của 4 nhóm hydroxyl ở nhân thơm của vòng dưới.
[Th(C64H54N8O12)]+.
Hình 3.30. Phổ ESI-MS của phức TEAC-Th(IV).
Hình 3.31. Phổ ESI-MS của phức TEAC-Cr(III).
Tương tự, trong phổ khối của hệ TEAC-Cr(III) và TEAC-Pb(II) cũng xuất hiện cụm pic ion phân tử m/z =1179 và m/z =1335 (hình 3.31 và 3.32). Các dữ kiện này cho thấy có sự hình thành phức giữa TEAC với Cr(III) và Pb(II).
Hình 3.32. Phổ ESI-MS của phức TEAC-Pb(II).
3.3.3. Phổ IR của thuốc thử và phức
Phổ hồng ngoại của TEAC ở dạng thái rắn với viên nén KBr được trình bày ở hình 3.33. Kết quả cho thấy TEAC có dao động của nhóm OH trong khoảng 3450- 3320 cm-1, giá trị OH trong TEAC giảm xuống và tù hơn so với các nhóm –OH dạng tự do có thể là do sự tồn tại các liên kết hydro liên phân tử [48,79]. Dao động của liên kết C=C của nhân thơm có =1585 cm-1, dao động hóa trị của các cầu
nối –CH2 có giá trị 2931-2980 cm-1, dải dao động hoá trị của nhóm –CO tại 1196-1063 cm-1. Nhóm –C=O của chức este có giá trị 1720 cm-1, do có sự liên hợp với nhân thơm nên giá trị này thấp hơn so với dao động của nhóm –C=O tự do. Liên
kết của nhóm –N=N có giá trị tại 1512 cm-1 và liên kết –CN có dao động hóa trị tại số sóng 1120 cm-1 và dao động biến dạng tại 1084 cm-1.
Phổ IR của các phức chất cho thấy ở các vùng nhóm chức có sự thay đổi đáng kể hoặc về vị trí hoặc về cường độ. Dao động của các nhóm –N=N tại 1512 cm-1 và C=O tại 1720 cm-1 trong phức TEAC-Th(IV) có sự thay đổi về cường độ.
Trong khi đó, ở phức chất TEAC-Pb(II), cường độ dao động của nhóm –N=N cũng giảm xuống. Điều này cho thấy có thể tại vùng này đã có sự hình thành liên kết dạng phối trí hoặc liên kết tĩnh điện giữa ion kim loại với các nhóm chức này nên đã làm thay đổi dao động đặc trưng của chúng.
TEAC-Th(IV)
TEAC
Hình 3.33. Phổ IR của TEAC và TEAC-Th(IV) dạng viên nén với KBr.
3.3.4. Phổ Raman của thuốc thử và phức
Phổ Raman là một trong những dữ kiện quan trọng trong nghiên cứu cấu trúc phức. Tương tự phổ IR, phổ Raman cũng đo dao động quay của các nhóm nguyên tử. Điểm nổi bật của loại phổ này là đo được dao động của các liên kết kim loại-phi kim ở số sóng thấp mà phổ IR không đo được. Tùy theo dạng tồn tại của phức chất mà người ta có thể đo mẫu ở trạng thái rắn hoặc trạng thái lỏng [14]. Trong thí nghiệm này,
chúng tôi tiến hành ghi phổ của TEAC và phức chất của nó ở trạng thái dung dịch với nền dung môi MeOH trong khoảng số sóng từ 2001700 cm-1 bằng thiết bị Bruker IFS
66. Kết quả được trình bày ở hình 3.34, 3.35 và bảng 3.8.
Hình 3.34. Phổ Raman của TEAC và TEAC-M trong khoảng 10001700 cm-1.
Hình 3.35. Phổ Raman của TEAC và TEAC-M trong khoảng 200900 cm-1.
Theo các tác giả như Huang [71], Leopold [98], Mink [114] và một số tác giả khác [3,113], dao động của các liên kết kim loại-phi kim như O hoặc N thường xuất
hiện trong vùng có số sóng thấp dưới 800 cm-1. Phổ Raman ở hình 3.35 cho thấy ở các phức chất trong vùng này xuất hiện các dao động mới ở vị trí 460463 cm-1, có thể quy cho dao động hóa trị của liên kết MN và ở vị trí 393400 cm-1 có thể quy kết cho liên kết MO. Cường độ khác nhau của các mũi trong phổ có thể là do bản chất của ion kim loại khác nhau, chẳng hạn như của ThO có cường độ cao, trong khi đó cường độ của liên kết PbO lại yếu hơn.
Bảng 3.8. Số sóng của một số dao động đặc trưng (cm-1) của TEAC và TEAC-M
TEAC-Cr(III) | TEAC-Pb(II) | TEAC-Th(IV) | Dao động của các liên kết | |
1147 | 1150 | PhN= | ||
1164 | 1163 | 1162 | NN | |
1285 | 1287 | PhNH | ||
1362 | 1365 | 1374 | CN | |
1416 | N=N | |||
1544 | 1547 | 1550 | C=N | |
1602 | 1602 | 1600 | 1600 | nhân thơm |
630 | 630 | 630 | 630 | CH |
463 | 463 | 463 | MN | |
395 | 394 | 400 | MO |
Có thể bạn quan tâm!
-
 Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại -
 Khảo Sát Các Yếu Tổ Ảnh Hưởng Đến Sự Hình Thành Hệ Phức Teac- Th(Iv), Teac-Cr(Iii) Và Teac-Pb(Ii)
Khảo Sát Các Yếu Tổ Ảnh Hưởng Đến Sự Hình Thành Hệ Phức Teac- Th(Iv), Teac-Cr(Iii) Và Teac-Pb(Ii) -
 Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức
Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức -
 Thứ Tự Các Nguyên Tử Trong Phức Teac- Ion Kim Loại M.
Thứ Tự Các Nguyên Tử Trong Phức Teac- Ion Kim Loại M. -
 Sự Phụ Thuộc Độ Hấp Thụ Quang Của Các Phức Vào Nồng Độ Teac.
Sự Phụ Thuộc Độ Hấp Thụ Quang Của Các Phức Vào Nồng Độ Teac. -
 Lê Văn Tán, Lâm Ngọc Thụ (2010), “Thuốc Thử Hữu Cơ Trong Hóa Phân Tích”,
Lê Văn Tán, Lâm Ngọc Thụ (2010), “Thuốc Thử Hữu Cơ Trong Hóa Phân Tích”,
Xem toàn bộ 130 trang tài liệu này.
3.3.5. Phổ 1H-NMR thuốc thử và phức
Trước hết, chúng tôi dự đoán phổ 1H-NMR của TEAC và các phức chất của nó bằng phần mềm ChemBioDraw 11. Kết quả cho thấy TEAC ở dạng azo-enol có các tín hiệu proton đặc trưng của nhóm -OH ở 5.35 ppm, proton của nhân thơm có tín hiệu trong khoảng 7,26-8,36 ppm. Dạng keto-hydrazo có tín hiệu đặc trưng của proton trên nhóm hydrazit NH là 7,00 ppm và proton của nhân thơm có tín hiệu ở 7,45 ppm. Trong phức TEAC-Pb(II) và TEAC-Cr(III) vẫn có tín hiệu của proton của nhóm NH, các proton ở nhân thơm cũng dao động trong khoảng 6,80-7,60 ppm. Các dao động này cũng có sự thay đổi nhỏ về vị trí và cường độ. Phức chất của TEAC-Th(IV) có nhiều điểm đáng lưu ý so với dạng TEAC tự do và 2 phức còn lại,
trong phổ này không còn tín hiệu của proton trao đổi nhanh, đồng thời các tín hiệu tại giá trị 7,45 ppm của proton của nhân thơm tách ba pic rõ rệt (xem phụ lục 3).
Sau đó, chúng tôi tiến hành khảo sát phổ của thuốc thử TEAC và phức. Kết quả cho thấy phổ 1H-NMR của TEAC xuất hiện tín hiệu của các proton trong nhân thơm ở 6,53-7,90 ppm, các nhóm proton trong nhóm –CH2 ở 4,07 ppm…Theo tính toán lý thuyết, các proton của nhóm OH thường định vị ở trường thấp (< 5,00 ppm) do chúng là các proton trao đổi nhanh. Tuy nhiên, trong phổ 1H-NMR của TEAC trong dung môi DMSO-d6 các proton này lại cho một pic đơn tại 10,00 ppm. Chúng tôi cho rằng, sự dịch chuyển về phía trường cao của các proton này là do sự hình thành các liên kết hydro nội phân tử. Trong khi đó, tín hiệu proton của các nhómOH trong phức hoặc giảm như trường hợp của phức TEAC-Cr(III) và TEAC-Pb(II) hoặc biến mất như trong phức TEAC-Th(IV). Nguyên nhân, có thể là các proton H đã tách khỏi phân tử thuốc thử khi hình thành phức hoặc thuốc thử đã chuyển sang dạng keto-hydrazo. Tín hiệu của các proton trong nhân thơm cũng có sự dao động nhẹ có thể do sự tương tác của ion kim loại (xem phụ lục 4).
3.3.6. Đề nghị cơ chế tạo phức
Kết hợp giữa các dữ kiện phổ như MS, IR, Raman, 1H-NMR và chương trình tối ưu hóa cấu trúc ArgusLab 4.01, chúng tôi đề nghị cơ chế tạo phức như sau:
+ Giai đoạn 1: Ion kim loại sẽ bị bẫy vào trung tâm của phân tử từ hai hướng lower rim hoặc upper rim tạo ra dạng hợp chất khách-chủ “Host-Guest”.
+ Giai đoạn 2: Phân tử TEAC tách các nguyên tử H của nhóm –OH thơm ở vòng dưới và chuyển sang dạng ion âm keto-hydrazo.
+ Giai đoạn 3: Ion kim loại tạo liên kết tĩnh điện với các điện tích âm trên nguyên tử nitơ (dạng anion hydrazit). Đồng thời các nhóm –COOEt ở các vòng trên sẽ xoay vào bên trong để hình thành các liên kết phối trí với ion kim loại, ổn định cấu trúc phức (xem hình 3.36).