chuyển dời cấu trúc electron của phân tử thuốc thử dẫn đến độ chuyển dịch max
không cao.
+ Trong môi trường axit yếu, TEAC đã có tín hiệu tương tác chọn lọc với ion Th(IV), phức có max =520 nm với dung dịch nền là MeOH-H2O.
+ Trong môi trường bazơ, TEAC có tín hiệu tương tác với hai ion Cr(III) và Pb(II) tại các giá trị max lần lượt là 488 nm và 458 nm với dung dịch nền là dung dịch TEAC.
Từ các thí nghiệm đã khảo sát ở trên, chúng tôi nhận thấy rằng các tín hiệu phân tích thu được từ sự tương tác của MEAC và DEAC với ion kim loại không đủ lớn để tiến hành các nghiên cứu theo hướng trắc quang. Do đó, trong các nội dung tiếp theo của luận án, chúng tôi không đề cập đến hai thuốc thử này và tập trung vào các tín hiệu của TEAC với Th(IV), Cr(III) và Pb(II).
3.2. Khảo sát các yếu tổ ảnh hưởng đến sự hình thành hệ phức TEAC- Th(IV), TEAC-Cr(III) và TEAC-Pb(II)
3.2.1. Ảnh hưởng của pH
Có thể bạn quan tâm!
-
 Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn
Phân Tích Định Lượng Ion Kim Loại Theo Phương Pháp Đường Chuẩn -
 Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại -
 Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại
Khảo Sát Sự Tương Tác Của Meac, Deac Và Teac Với Ion Kim Loại -
 Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức
Tính Toán Mật Độ Điện Tích Cân Bằng Của Các Nhóm Chức -
 Cấu Trúc Phức Teac-Th(Iv) Tối Ưu Hóa Bằng Arguslab.
Cấu Trúc Phức Teac-Th(Iv) Tối Ưu Hóa Bằng Arguslab. -
 Thứ Tự Các Nguyên Tử Trong Phức Teac- Ion Kim Loại M.
Thứ Tự Các Nguyên Tử Trong Phức Teac- Ion Kim Loại M.
Xem toàn bộ 130 trang tài liệu này.
pH là một trong những yếu tố ảnh hưởng quyết định đến sự hình thành phức, độ hấp thụ quang cũng như độ bền của phức. Yếu tố này quyết định dạng tồn tại của thuốc thử và ion kim loại. Để nghiên cứu sự ảnh hưởng của yếu tố này đến độ hấp thụ quang của hệ TEAC-Th(IV) tại bước sóng 520 nm, chúng tôi tiến hành thí nghiệm như sau: Trong các bình định mức 25 mL, thêm vào 5 mL TEAC 10-3M + 2 mL dung dịch Th(IV) 10-3M. Điều chỉnh pH của hệ bằng dung dịch đệm axetat. Lắc đều và để yên cho hệ ổn định. Đo độ hấp thụ quang của hệ tại bước sóng 520 nm với dung dịch so sánh là MeOH+H2O. Kết quả biểu thị trên hình 3.16 cho thấy độ hấp thụ quang của hệ đạt giá trị cực đại trong khoảng pH = 4÷5. Vì vậy, chúng tôi chọn khoảng giá trị pH này để tiến hành các nghiên cứu sau.
0.55
0.50
0.45
0.40
0.35
0.30
2
3
4
5
6
pH
Absorbance
Hình 3.16. Sự phụ thuộc mật độ quang của hệ TEAC-Th(IV) vào pH.
Ảnh hưởng của pH đến độ hấp thụ quang của TEAC-Cr(III) ở 488 nm và TEAC-Pb(II) ở 458 nm được trình bày ở hình 3.17. Số liệu nhận được cho thấy trong khoảng pH có giá trị 1011 thì độ hấp thụ quang của phức TEAC-Cr(III) đạt giá trị cực đại. Trong khi đó, với giá trị pH 911, thì phức TEAC-Pb(II) có độ hấp thụ quang lớn nhất. Vì vậy, chúng tôi chọn khoảng giá trị pH này để tiến hành các nghiên cứu tiếp theo. Ảnh hưởng của dung dịch đệm đến độ hấp thụ quang của hệ được khảo sát với 4 dung dịch khác nhau là Na2HPO4/NaOH, Na2CO3/NaOH, Na2B4O7/NaOH và NH3/NH4Cl. Kết quả cho thấy khi sử dụng dung dịch Na2HPO4/NaOH thì độ hấp thụ quang của các hệ ổn định và đạt giá trị cao nhất. Vì vậy, dung dịch này được sử dụng cho các nghiên cứu tiếp theo.
0.6
0.5
TEAC-Pb(II) TEAC-Cr(III)
0.4
0.3
0.2
0.1
0.0
6
8
10
pH
12
14
Hình 3.17. Sự phụ thuộc của mật độ quang của TEAC-Cr(III) và TEAC-Pb(II) vào pH.
3.2.2. Ảnh hưởng của nồng độ ion kim loại đến phổ hấp thụ
Ảnh hưởng của nồng độ ion kim loại (C) đến độ hấp thụ quang (A) của phức đóng vai trò rất quan trọng trong việc ứng dụng phức vào phân tích định lượng. Nếu giữa A và C có mối quan hệ tuyến tính trong một khoảng giá trị xác định thì ta có thể xây dựng được phép phân tích định lượng ion kim loại bằng phương pháp đường chuẩn.
Trong phần này, chúng tôi tiến hành các thí nghiệm sau: Chuẩn bị các dung dịch nghiên cứu tương tự như trên bằng cách giữ nguyên nồng độ TEAC là 2.10-5M nhưng tăng nồng độ ion kim loại từ 0,2.10-5M đến 20,0.10-5M. Điều chỉnh pH của hệ đến giá trị 45. Đo độ hấp thụ quang của hệ tại bước sóng 520 nm với dung dịch so sánh là dung môi MeOH-H2O. Kết quả biểu diễn ở đồ thị hình 3.18 đã chỉ ra rằng khi tăng nồng độ ion Th(IV) thì độ hấp thụ quang của hệ cũng tăng và đạt giá trị bão hòa khi nồng độ của Th(IV) là 2,0.10-5M. Trên cơ sở đó, chúng tôi đã xây dựng đồ thị biểu thị khoảng tuyến tính của nồng độ Th(IV) và độ hấp thụ quang (A) tại bước sóng 520 nm, bằng tính toán thống kê, đường biểu diễn có phương trình:
A = 0,248.C.10-5 (mol/L) +0,020 (R² = 0,990, n =7)
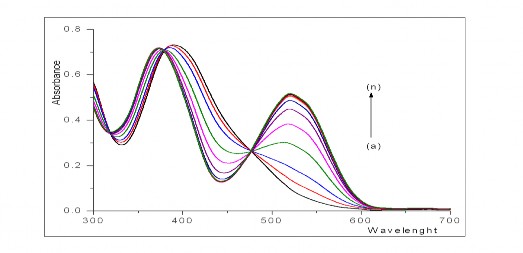
Hình 3.18. Phổ hấp thụ của hệ TEAC- Th(IV) khi tăng nồng độ Th(IV) từ 0,2.10-5M đến 20,0.10-5M với dung dịch so sánh là MeOH+H2O tại pH =4,5.
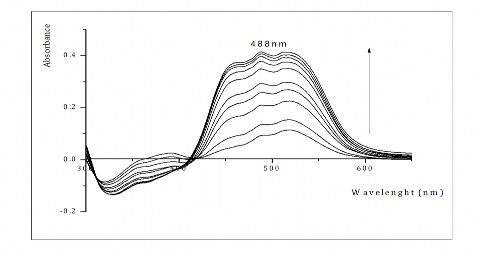
Ảnh hưởng của nồng độ ion Cr(III) đến mật độ quang của hệ TEAC-Cr(III) được khảo sát tương tự ở bước sóng 488 nm và pH 1011 với dung dịch nền là TEAC. Từ kết quả biểu diễn ở đồ thị hình 3.19, chúng tôi nhận thấy khi tăng dần nồng độ ion Cr(III) thì độ hấp thụ quang của hệ tăng dần. Số liệu thu được cho thấy giữa độ hấp thụ quang của hệ và nồng độ ion kim loại có mối quan hệ tuyến tính với nhau trong một khoảng nồng độ 0,4.10-5 2,0.10-5M.
0.6
458nm
0.5
0.4
0.3
0.2
0.1
0.0
400
600
-0.1
-0.2
-0.3
Wavelenght(nm)
Absorbance
Hình 3.19. Phổ hấp thụ của hệ TEAC-Cr(III) khi tăng nồng độ Cr(III) từ 0,2.10-5M đến 20,0.10-5M với dung dịch so sánh là TEAC tại pH = 10,5.
Hình 3.20. Phổ hấp thụ của hệ TEAC-Pb (II) khi tăng nồng độ Pb(II) từ 0,2.10-5M đến 20,0.10-5M với dung dịch so sánh là TEAC tại pH = 10,2.
Sự ảnh hưởng của nồng độ ion Pb(II) đến độ hấp thụ quang của hệ TEAC-Pb(II) cũng được khảo sát tương tự. Kết quả trình bày trên hình 3.20 cho thấy khi tăng nồng độ ion Pb(II) thì độ hấp thụ quang tại 458 nm cũng tăng lên và A đạt giá trị bão hòa khi nồng độ Pb(II) là 2,0.10-5M. Giữa hai đại lượng này có mối quan hệ tuyến tính trong khoảng nồng độ của Pb(II) từ 0,4.10-5-M đến 2,0.10-5M. Đây là một tín hiệu rất có ý nghĩa để tiến hành các nghiên cứu phân tích định lượng.
3.2.3. Khảo sát thành phần của hệ
Để xác định được hệ số tỷ lượng các hợp phần của phức, người ta có thể sử dụng nhiều phương pháp khác nhau như phương pháp tỷ lệ mol, phương pháp dãy đồng phân tử gam, phương pháp hiệu suất tương đối Straric-Bacbanel [9,14]. Nguyên tắc chung là dựa vào việc xây dựng giản đồ tỷ lệ nồng độ các hợp phần (C)
0.3
TEAC-Pb(II) TEAC-Cr(III) TEAC-Th(IV)
0.2
0.1
0.0
0.0
0.2
0.4
0.6
0.8
1.0
[M]/([TEAC]+[M])
Absorbance
- độ hấp thụ quang (A) để xác định thành phần phức. Trong luận án này, chúng tôi sử dụng phương pháp dãy đồng phân tử gam để nghiên cứu. Kết quả khảo sát được trình bày ở đồ thị hình 3.21.
Hình 3.21. Sự phụ thuộc của độ hấp thụ quang của hệ vào tỷ lệ [M]/([TEAC]+[M]).
Từ kết quả thu được ở đồ thị hình 3.21, chúng tôi nhận thấy khi tỷ lệ nồng độ [M]/([TEAC]+[M]) = 0,5 thì độ hấp thụ quang của các hệ đạt giá trị cực đại. Như vậy, TEAC tạo phức với các ion Th(IV), Cr(III) và Pb(II) theo tỉ lệ 1:1.
3.2.4. Khảo sát độ bền của hệ theo thời gian
Trong nghiên cứu trắc quang, độ bền màu của phức đóng vai trò rất quan trọng vì nó liên quan đến thời gian phân tích. Để khảo sát độ bền màu của hệ theo thời gian, chúng tôi tạo dung dịch nghiên cứu tương tự như trên và đo độ hấp thụ quang của hệ tại bước sóng 520 nm (với TEAC-Th(IV)) và dung dịch nền là MeOH-H2O, 488 nm (với TEAC-Cr(III)), 458 nm (với TEAC-Pb(II)) và dung dịch nền là TEAC. Kết quả trình bày ở đồ thị hình ở 3.22 cho phép kết luận như sau:
+ Độ hấp thụ quang của hệ TEAC-Th(IV) ổn định trong khoảng thời gian 590 phút sau khi cho thêm ion kim loại vào dung dịch thuốc thử.
+ Độ hấp thụ quang của hệ TEAC-Cr(III) ổn định trong khoảng thời gian 590 phút sau khi tạo hệ.
+ Độ hấp thụ quang của hệ TEAC-Pb(II) ổn định trong khoảng thời gian 580 phút sau khi cho thêm ion kim loại vào dung dịch thuốc thử.
0.6
0.5
TEAC-Th(IV) TEAC-Cr(III) TEAC-Pb(II)
0.4
0.3
0.2
0.1
0.0
0
20
40
60
80
t
100
120 140 160
Absorbance
Như vậy, thời gian ổn định màu cũng như mật độ quang của 3 phức TEAC- Th(IV), TEAC-Cr(III) và TEAC-Pb(II) đủ lớn để xây dựng quy trình phân tích định lượng.
Hình 3.22. Độ hấp thụ quang của các hệ sau thời gian t (phút).
3.2.5. Khảo sát ảnh hưởng của các ion kim loại khác
1.0
0.8
0.6
0.4
0.2
TEAC-Th(IV) TEAC-U(VI) TEAC-Pb(II) TEAC-Sm(III) TEAC-Cr(III)
TEAC-Fe(III) TEAC
0.0
300
400
500
600
700
Wavelenght(nm)
Absorbance
Ảnh hưởng của một số ion kim loại đến khả năng tạo phức của TEAC với ion Th(IV) được khảo sát như sau: Chuẩn bị dung dịch nghiên cứu TEAC-Th(IV) trong khoảng pH 45 sao cho nồng độ của và TEAC và Th(IV) là 2,0.10-5M còn nồng độ ion kim loại tăng dần. Để ổn định rồi đo phổ hấp thụ của từng hệ. Kết quả cho thấy ở điều kiện tạo phức của Th(IV), các ion như UO2(II), Eu(III), La(III), Sm(III)... hầu như không gây ảnh hưởng đến độ hấp thụ quang của hệ dù nồng độ cao hơn gấp nhiều lần (hình 3.23). Kết quả này cho thấy TEAC tạo phức chọn lọc với ion Th(IV) khi có mặt của các ion khác.
Hình 3.23. Ảnh hưởng của một số kim loại đến phổ hấp thụ của TEAC-Th(IV) với dung dịch so sánh là MeOH+H2O, (pH =4,5).
Ảnh hưởng của một số ion kim loại khác đến khả năng tạo phức của TEAC với Cr(III) và Pb(II) cũng được khảo sát tương tự như trên. Phổ hấp thụ của ở hình 3.24 cho thấy ở điều kiện tạo phức của Cr(III), và Pb(II) các ion như Th(IV), UO2(II), Eu(III), La(III), Sm(III), Ni(II), Fe(III)…làm phổ đồ thay đổi không đáng kể so với thuốc thử TEAC tự do. Nguyên nhân có thể là do trong môi trường pH cao, các ion kim loại nói trên đã bị thủy phân hoặc solvat hóa (tạo phức hydroxo với dung môi).
Như vậy:
1) Trong môi trường axit yếu, thuốc thử TEAC khả năng tạo phức chọn lọc với ion Th(IV) khi có mặt của các ion khác.
1.0
0.8
TEAC-Cr(III)
TEAC-Pb(II)
0.6
TEAC
TEAC-Th(IV)
0.4
TEAC-UO (II)
2
TEAC-Fe(III)
0.2
TEAC-Cu(II) TEAC-Sm(III)
0.0
400
600
Wavelenght(nm)
Absorbance
2) Trong môi trường bazơ, thuốc thử TEAC có khả năng tạo phức với hai ion Pb(II) và Cr(III) trong điều kiện tương tự nhau.
Hình 3.24. Ảnh hưởng của một số ion kim loại đến phổ hấp thụ của TEAC-Cr(III) và TEAC-Pb(II) với dung dịch so sánh là MeOH+H2O, pH =10,5.
3.2.6. Xác định hệ số hấp thụ mol và hằng số bền của phức
Hệ số hấp thụ mol () được xác định từ thực nghiệm bằng cách xây dựng phương trình biểu diễn sự phụ thuộc của độ hấp thụ quang vào nồng độ ion kim loại trong phức. Kết quả được trình bày ở bảng 3.3.
Trước đây, để xác định được hằng số bền người ta thường phải xác định hằng số thủy phân của ion kim loại, hằng số axit của thuốc thử…sau đó tiến hành giải bài toán tìm hằng số bền. Tuy nhiên, đối với phức chất Host-Guest thì việc xác định các hằng số này gặp rất nhiều khó khăn vì cấu trúc phân tử của các thuốc thử hữu cơ