(EtOAc), [αD]25 = -52o (MeOH, c =1,0).
Rf = 0,45 (CH2Cl2:MeOH = 98:2), hiệu suất 0,006% (so với mẫu rễ khô).
IR (KBr, ν, cm-1): 3363, 2883, 1623, 1505, 1431, 1263, 1153, 1069, 985, 817.
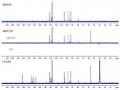
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.6.
Cryptostrobin (PK6): C16H14O4, tinh thể hình kim, màu vàng, đnc 200- 201oC (EtOAc-MeOH), [αD]25 = -35o (MeOH, c =0,6).
Rf = 0,47 (CH2Cl2:MeOH = 98:2), hiệu suất 0,005% (so với mẫu rễ khô). IR (KBr, ν, cm-1): 3126, 2948, 1642, 1587, 1440, 1303, 1112, 988, 817.
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.7.
3.1.3. Cặn chiết n-butanol (n-BuOH)
Khảo sát sơ bộ cho thấy phần lớn trong phân đoạn n-BuOH là các hợp chất dạng keo, tan trong hỗn hợp dung môi MeOH-H2O (1:1) nhưng lại khó tan trong dung môi khác. Trước khi tiến hành phân lập các chất, cặn chiết n-BuOH được chiết loại sơ bộ các tạp chất bằng cách hòa tan hoàn toàn cặn chiết bằng hỗn hợp dung môi MeOH-H2O (1:1), sau đó chiết với hỗn hợp CH2Cl2-EtOH (2:1), cất loại dung môi thu được 12g cặn chiết n-BuOH(E).
12g cặn n-BuOH(E) được tiến hành phân lập bằng sắc ký cột sephadex LH- 20 với dung môi giải hấp là MeOH thu được 6 phân đoạn, ký hiệu PKB1 → PKB6. Khảo sát các phân đoạn bằng sắc ký lớp mỏng cho thấy hầu hết các hợp chất chính của các phân đoạn đã được tìm thấy từ cặn chiết EtOAc, chỉ có phân đoạn PKB2 (4,6g) cho vết có Rf khác với các chất đã phân lập. Vì vậy, cặn này được chọn để tiếp tục tiến hành tinh chế.
Phân đoạn PKB2 được tinh chế bằng sắc ký cột silicagel với hệ dung môi lần lượt là CH2Cl2-MeOH (9:1); CH2Cl2-MeOH-H2O (9:1:0,05); CH2Cl2-MeOH-H2O
(9:1:0,1), thu được 10 phân đoạn PKB2.1→PKB2.10. Tiếp tục làm sạch phân đoạn
PKB2.2 bằng sắc ký cột sephadex LH-20 với dung môi giải hấp là MeOH thu được 64mg chất PK7, dạng rắn, màu trắng.
Quá trình phân lập các hợp chất từ cặn chiết n-BuOH của rễ Thông lá dẹt
được thực hiện theo Sơ đồ 3.3.
Cặn chiết n-BuOH (20g)
1. Hòa tan trong MeOH-H2O (1:1)
2. Chiết với CH2Cl2-EtOH (2:1)
PKB1
PKB3-6
3. Cất loại dung môi
Cặn n-BuOH(E) (12g) | ||
CC, Sephadex LH-20 MeOH | ||
Có thể bạn quan tâm!
-
 Chuyển Hóa Hóa Học Hợp Chất Triterpene Khung Lupane Và Hoạt Tính Sinh Học Của Chúng
Chuyển Hóa Hóa Học Hợp Chất Triterpene Khung Lupane Và Hoạt Tính Sinh Học Của Chúng -
![Khử Hoá Nối Đôi 20(29) Của Betulinic Acid [65], [66]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Khử Hoá Nối Đôi 20(29) Của Betulinic Acid [65], [66]
Khử Hoá Nối Đôi 20(29) Của Betulinic Acid [65], [66] -
![Hoạt Tính Chống Oxi Hóa: Thực Hiện Theo Phương Pháp Dpph [80], [81]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Hoạt Tính Chống Oxi Hóa: Thực Hiện Theo Phương Pháp Dpph [80], [81]
Hoạt Tính Chống Oxi Hóa: Thực Hiện Theo Phương Pháp Dpph [80], [81] -
 Các Thông Số Của Phản Ứng Chuyển Hóa Tạo At10 – At12
Các Thông Số Của Phản Ứng Chuyển Hóa Tạo At10 – At12 -
 Kết Quả Từ Loài Thông Lá Dẹt (Pinus Krempfii Lecomte)
Kết Quả Từ Loài Thông Lá Dẹt (Pinus Krempfii Lecomte) -
 Phổ 13 C-Nmr Và Dept Của Chất Pk1 (125 Mhz, Dmso-D 6 )
Phổ 13 C-Nmr Và Dept Của Chất Pk1 (125 Mhz, Dmso-D 6 )
Xem toàn bộ 169 trang tài liệu này.

PKB2 | ||
CC, SiO2 1. CH2Cl2-MeOH (9:1) 2. CH2Cl2-MeOH-H2O (9:1:0,05) 3. CH2Cl2-MeOH-H2O (9:1:0,1) | ||
PKB2.1
PKB2.2
PKB2.3-2.10
CC, Sephadex LH-20 MeOH
PK7
(64mg)
Sơ đồ 3.3. Phân lập chất PK7 từ cặn chiết n-BuOH của rễ Thông lá dẹt
Isolariciresinol (PK7): C20H24O6, chất rắn vô định hình, màu trắng, đnc 155- 157oC (CHCl3-MeOH), [αD]25 = +55o (MeOH, c =0,55).
Rf = 0,45 (CH2Cl2:MeOH:H2O = 9:1:0,2), hiệu suất tách 0,006% (so với mẫu rễ khô).
IR (KBr, ν, cm-1): 3453, 2934, 2863, 1721, 1606, 1514, 1457, 1273, 1023,
874.
HR-ESI-MS: m/z 383,1470 [M+Na]+ (tính toán cho công thức C20H24O6Na+ là
383,1471).
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.8.
3.2. Loài Ngũ gia bì hương (Acanthopanax trifoliatus (L.) Merr.)
3.2.1. Phân lập các hợp chất từ loài Ngũ gia bì hương
3.2.1.1. Quá trình phân lập
Thân và lá Ngũ gia bì hương
(3,7kg)
Chiết với MeOH-H2O (85:15) (3 lần)
Dịch MeOH
Cất loại dung môi
Chiết với n-hexane
(3 lần)
Dịch nước
Dịch n-hexane
Dịch nước còn lại
Cặn n-hexane (32g)
Cất loại dung môi
Chiết với CH2Cl2 (3 lần)
Dịch CH2Cl2
Dịch nước còn lại
Cặn ATC1 (55g)
Cất loại dung môi
1. NaOH 4N, 80oC, 8h
2. HCl 1N
3. Chiết với CH2Cl2 (3 lần)
Dịch CH2Cl2
Dịch nước còn lại
Cặn ATC2 (50g)
Cất loại dung môi
Sơ đồ 3.4. Quy trình chiết mẫu Ngũ gia bì hương
Mẫu thân và lá loài Ngũ gia bì hương đã sấy khô (3,7kg), nghiền nhỏ được ngâm chiết bốn lần trong hỗn hợp MeOH-H2O (85:15) ở nhiệt độ phòng. Sau khi
cất loại dung môi MeOH dưới áp suất giảm ở 40oC, dịch nước còn lại được chiết phân lớp lần lượt với n-hexane và CH2Cl2. Cất loại dung môi của các dịch chiết dưới áp suất giảm thu được các cặn chiết tương ứng, cặn n-hexane (32g) và cặn dichlorometan 1 (ATC1) (55g). Thủy phân dịch nước còn lại bằng dung dịch NaOH 4N trong EtOH ở 80oC trong 8h. Cất loại EtOH, acid hóa bằng HCl 1N, sau đó chiết với CH2Cl2. Cất loại dung môi dưới áp suất giảm được 50g cặn chiết dichlorometan 2 (ATC2) (Sơ đồ 3.4).
Cặn chiết ATC1 (55g) được đưa lên cột silica gel giải hấp bằng hệ dung môi CH2Cl2-MeOH gradient MeOH từ 0 đến 100% thu được 20 phân đoạn ký hiệu ATC1.1→ATC1.20.
Từ phân đoạn 2 (ACT1.2) và phân đoạn 4 (ACT1.4) tiến hành sắc ký cột silica gel với dung môi giải hấp là CH2Cl2-EtOAc (80:20) thu được 8,2g chất AT1 và 7,8g chất AT2.
Từ phân đoạn 3 (ACT3) cũng tiến hành sắc ký cột silica gel với dung môi giải hấp là CH2Cl2-EtOAc (80:20) thu được 3 phân đoạn chính, ký hiệu ATC1.3.1
→ ATC1.3.3. Phân đoạn ACT1.3.2 được làm sạch lại bằng sắc ký cột pha đảo RP –
18 với hệ dung môi MeOH-H2O (80:20) thu được chất AT3 (42mg).
Tương tự tiến hành phân lập hai hợp chất AT1, AT2 từ cặn chiết ATC2 (50g) bằng sắc ký cột lặp lại với hệ dung môi thích hợp, đã phân lập được 1,2g AT1 và 1,4g AT2.
Như vậy, từ hai cặn chiết dichlorometan đã phân lập được hai chất có hàm lượng lớn AT1 (9,4g), AT2 (9,2g) và từ cặn chiết chưa thủy phân ACT1 đã phân lập được hợp chất AT3 (42mg).
Quá trình phân lập các hợp chất từ các cặn chiết CH2Cl2 của loài Ngũ gia bì hương được biểu diễn ở Sơ đồ 3.5
ATC1.3 | ||
CC, SiO2 CH2Cl2-EtOAc (80:20) | ||
CC, SiO2
CH2Cl2-MeOH (100:0 → 0:100)
CC, SiO2 CH2Cl2-EtOAc
(80:20)
CC, SiO2 CH2Cl2-EtOAc (80:20)
CC, RP-18 MeOH –H2O
(80:20)
ATC1.1
ATC1.2
AT1 (8,2g)
AT2 (7,8g)
ATC1.3.1
ATC1.3.2
ATC1.3.3
AT1 (9,4g)
AT3
(42mg)
AT2 (9,2g)
Cặn chiết ATC1 (55g)
ATC1.4
ATC1.5-1.20
AT1 (1,2g)
AT2 (1,4g)
CC, SiO2 CH2Cl2-EtOAc
(80:20)
CC, SiO2 CH2Cl2-EtOAc (80:20)
ATC2.1
ATC2.2
ATC2.3
ATC2.4-2.15
CC, SiO2 CH2Cl2-MeOH (100:0 →0:100) | ||
Cặn chiết ATC2 (50g) |
Sơ đồ 3.5. Phân lập các hợp chất từ cặn chiết dichlorometan của loài Ngũ gia bì hương
3.2.1.2. Dữ liệu phổ của các hợp chất phân lập được
24-nor-11α-hydroxy-3-oxo-lup-20(29)-ene-28-oic acid (AT1):C29H44O4, chất rắn vô định hình, màu trắng, đnc 182-184oC (EtOAc-MeOH), [αD]25 = +25o (MeOH, c = 0,38).
Rf = 0,5 (CH2Cl2:MeOH = 100:3), hiệu suất 0,26% (so với mẫu khô). ESI-MS (positive ion): m/z 479,2 [M+Na]+
ESI-MS (negative ion): m/z 455,5 [M-H]-.
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.9.
24-nor-3α,11α dihydroxy-lup-20(29)-ene-28-oic acid (AT2): C29H46O4, chất rắn vô định hình, màu trắng, đnc 223-225oC (EtOAc-MeOH), [αD]25 = +16o (MeOH, c =0,52).
Rf = 0,35 (CH2Cl2:MeOH = 100:3), hiệu suất 0,25% (so với mẫu khô) ESI-MS (positive ion): m/z 481,1 [M+Na]+
ESI-MS (negative ion): m/z 457,4 [M-H]-.
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.10.
11α,23-dihydroxy-3-oxo-lup-20(29)-ene-28-oic acid (AT3): C30H46O5, chất rắn vô định hình, màu trắng, đnc 218-220oC (EtOAc-MeOH), [αD]25 = +26o (MeOH, c =0,25).
Rf = 0,4 (CH2Cl2:MeOH = 100:3), hiệu suất 0,04 % (so với mẫu khô).
HR-ESI-MS: m/z 487,3424 [M+H]+ (tính toán lý thuyết cho công thức C30H46O5 là 487,3423).
Số liệu phổ 1H- và 13C-NMR được đưa ra ở Bảng 4.11.
3.2.1.3. Tổng hợp các dẫn xuât của hai chất AT1, AT2
3.2.1.4. Tổng hợp các dẫn xuất của chất AT1
Tổng hợp các dẫn xuất của AT1 được thực hiện theo Sơ đồ 4.1
a. Tổng hợp các dẫn xuất ester của AT1
Các phản ứng tạo ester được thực hiện giữa nhóm hydroxyl ở C-11 của AT1 với một số acid anhydride như acetic anhydride, phthalic anhydride, glutaric anhydride, succinic anhydride.
24-nor-11-acetoxy-3-oxo-lup-20(29)-ene-28-oic acid (AT4):
Hòa tan 1,465g (3,2mmol) chất AT1 trong hỗn hợp 5ml pyridine và 3ml acetic anhydride. Hỗn hợp được khuấy ở nhiệt độ phòng trong 24h. Sau đó cất loại pyridine và acetic anhydride dư dưới áp suất giảm thu được cặn rắn màu trắng. Cặn này được hòa tan trong CH2Cl2 và rửa bằng 10ml dung dịch HCl 5%, sau đó rửa 3 lần với nước, làm khan bằng Na2SO4, cất loại dung môi, sản phẩm thô được làm sạch bằng cột silicagel với hệ dung môi CH2Cl2: MeOH = 98:2 thu đuợc 1,35g chất AT4 ở dạng rắn, màu trắng, hiệu suất 85%.
FT-IR (KBr): 3430, 2960, 1728, 1691, 1641, 1458, 1374, 1235, 1021, 894
ESI-MS (positive ion): m/z 521,4 [M+Na]+ ESI-MS (negative ion): m/z 497,4 [M-H]-.
24-nor-11-O-phthalyl-3-oxo-lup-20(29)-ene-28-oic acid (AT5):
Hỗn hợp của 160mg (0,35mmol) hợp chất AT1, 200mg (1,64mmol) 4-DMAP và 260mg (1,75mmol) phthalic anhydride trong 10 ml pyridine được đun nóng ở 60oC trong 8h. Sau khi phản ứng kết thúc, để nguội đến nhiệt độ phòng, cho thêm nước và chiết 3 lần với EtOAc. Trung hòa dịch chiết bằng dung dịch HCl 1N, rửa lại với nước, làm khan và cất loại dung môi. Sản phẩm thô được tinh chế bằng cột silica gel với hệ dung môi CH2Cl2: MeOH = 100:4 thu được 137mg chất AT5 ở dạng chất rắn màu trắng, hiệu suất 65%.
FT-IR (KBr): 3491, 2954, 1714, 1600, 1456, 1282, 1124, 1069, 889 cm-1.
ESI-MS (positive ion): m/z 626,9 [M+Na]+. ESI-MS (negative ion): m/z 603,4 [M-H]-.
1H-NMR (300 MHz, CDCl3): δ 7,85 và 7,54 (4H,-C6H4-); 5,56 (1H, m, H-11);
4,80 (1H, s, H-29A); 4,64 (1H, s, H-29B); 3,05 (1H, s, H-19).
Tương tự AT5, các chất AT6 và AT7 được tổng hợp với các thông số của phản
ứng như sau:
Bảng 3.1. Các thông số của phản ứng chuyển hóa tạo AT6, AT7
AT1 (mg/mmol) | Acid anhydride (mg/mmol) | Pyridine (ml) | 4-DMAP (mg/mmol) | LSP (mg) | H (%) | |
AT6 | 160/0,35 | glutaric anhydride 200/1,75 | 10 | 200/1,64 | 134 | 67 |
AT7 | 160/0,35 | succinic anhydride 175/1,75 | 10 | 200/1,64 | 127 | 65 |
24-nor-11-O-glutaryl-3-oxo-lup-20(29)-ene-28-oic acid (AT6):
ESI-MS (positive ion): m/z 593,0 [M+Na]+. ESI-MS (negative ion): m/z 569,3 [M-H]-.
1H-NMR (300 MHz, CDCl3): δ 5,26 (1H, dt, J= 11,0 và 5,5 Hz, H-11); 4,75
(1H, s, H-29A); 4,61 (1H, s, H-29B); 2,97-3,04 (m, 1H, H-19); 1,67 (3H, s); 1,07 (3H, s); 1,04 (3H, s); 1,01 (3H, s).
13C-NMR (75 MHz, CDCl3): δ 213,9; 182,1; 178,5; 171,8; 149,6; 110,5;
72,9; 56,2; 56,1; 53,2; 50,5; 48,7; 46,4; 44,9; 42,3; 42,2; 42,1; 42,0; 37,7; 37,3;
36,9; 36,8; 34,1; 33,5; 32,6; 31,9; 30,3; 29,4; 21,9; 19,9; 19,1; 16,8; 14,3; 12,2.
24-nor-11-O-succinyl-3-oxo-lup-20(29)-ene-28-oic acid (AT7):
ESI-MS (negative ion): m/z 555,6 [M-H]-.
1H-NMR (500 MHz, CDCl3): δ 5,28 (1H, dt, J = 11,0 và 5,5 Hz, H-11); 4,74 (1H, s, H-29A); 4,60 (1H, s, H-29B); 3,00-2,96 (1H, m, H-19); 1,67 (3H, s); 1,07
(3H, s); 1,04 (3H, s); 1,04 (3H, s); 1,01 (3H, s); 0,99 (3H, d, J=6,5 Hz).
13C-NMR (125 MHz, CDCl3): δ 214,2; 182,4; 178,0; 171,1; 149,5; 110,4;
73,3; 56,2; 53,3; 50,6; 48,8; 46,4; 44,9; 42,3; 42,2; 41,9; 37,7; 37,3; 36,9; 33,6;
32,5; 31,9; 30,4; 29,7; 29,4; 28,9; 21,8; 19,2; 16,8; 14,3; 13,9; 12,2.


![Khử Hoá Nối Đôi 20(29) Của Betulinic Acid [65], [66]](https://tailieuthamkhao.com/uploads/2022/05/09/luanghien-cuu-hoa-hoc-va-tham-do-hoat-tinh-sinh-hoc-cua-loai-thong-la-det-6-120x90.jpg)
![Hoạt Tính Chống Oxi Hóa: Thực Hiện Theo Phương Pháp Dpph [80], [81]](https://tailieuthamkhao.com/uploads/2022/05/10/luanghien-cuu-hoa-hoc-va-tham-do-hoat-tinh-sinh-hoc-cua-loai-thong-la-det-7-120x90.jpg)