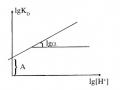
Nếu có z H+ tham gia phản ứng, ta có: tg = z; lgD = A + lgH+
IV.1.3.2. Ảnh hưởng của hiệu ứng muối:
* Các muối không tạo phức:
3
Giả sử có các hệ số chiết Th(NO3)4 hoặc UO2(NO3)2 / NO
/ TBP.
Nếu có thêm các muối trong pha nước ví dụ NH4NO3, Ca(NO3)2, Al(NO3)3.
Có thể bạn quan tâm!
-
 Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro
Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro -
 Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ
Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ -
 Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi.
Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi. -
 Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph
Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16 -
 Hiệu Quả Của Số Lần Chiết D = 2; V Nc = 100 Ml;
Hiệu Quả Của Số Lần Chiết D = 2; V Nc = 100 Ml;
Xem toàn bộ 167 trang tài liệu này.
Các muối này không bị chiết lên pha hữu cơ nhưng nó có ảnh hưởng như sau:
- Hằng số điện môi, thay đổi.
- Lực ion của nước thay đổi.
- Tỷ trọng hai pha thay đổi.
* Các muối tạo phức với ion kim loại trong pha nước:
Giả sử có ion kim loại ngoài việc tạo phức với tác nhân chiết HR còn tạo
phức với chất tạo phức phụ X: D = Kex
[HR]x
[H ]x
Giả sử ion kim loại tạo phức với X, ta có: =
[MX ] [M ][ X ]
[MX] = [M] [X]
D’ =
[M ]hc =
[M ]nc [M ]nc [ X ]
[M ]hc
[M ]nc (1 [ X ])
= D
(1 [ X ])
Kex =
D .
1
[H ]x
[HR]x
Như vậy, khi tăng Kex giảm.
IV.1.3.3. Ảnh hưởng của tác nhân chiết:
* Nồng độ tác nhân chiết:
lgD = lgKex + npH + lg[HR]hc
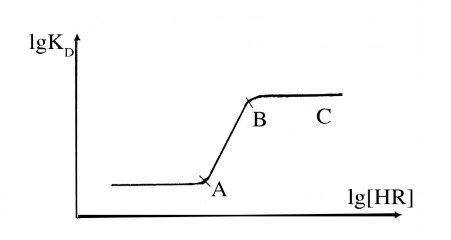
Hình 4.2: Ảnh hưởng của nồng độ tác nhân chiết.
Khi [HR] tăng lgD tăng, tuy nhiên khi đạt tới mức độ nhất định thì không tăng nữa, mặt khác pH1/2 giảm, có nghĩa là có thể chiết ở môi trường axit hơn.
* Ảnh hưởng bản chất của cấu tử chiết:
+ Chất nội phức: vị trí của nhóm chức, loại nhóm chức có thể hình thành liên kết bền chặt và kết quả có thể gây ảnh hưởng khác.
+ Chiết theo kiểu A+, B-.
* Ảnh hưởng của nhiệt độ:
Kex =
f1
f 2
exp
(M 0 M 0 )
2 1
RT
; T tăng D giảm.
IV.1.3.4. Điều kiện chiết:
* Hệ số tách càng khác 1 càng tốt:
= DA 1
DB
* Hệ số tạp chất = E B
E A
càng nhỏ càng tốt.
IV.2. Cơ sở lý thuyết của phương pháp sắc kí:[26]
Khi pha động chứa một phần tử chất cần phân tích A được cho chảy qua cột chứa pha tĩnh thì chất cần phân tích sẽ được phân bố giữa 2 pha theo hệ số phân bố D: Am = A(động) - A( tĩnh) = AS
D = [ A]t =
[ A]d
[ A]S
[ A]m
(1)
[A]t là nồng độ chất A trong pha tĩnh tại thời điểm này trong cột và [A]đ là nồng độ chất A trong pha động. A chỉ có thể chuyển động qua cột khi nó ở trong pha động. Nói cách khác, nếu D rất lớn thì chất A sẽ chủ yếu ở pha tĩnh và sẽ bị giải hấp rất chậm. Muốn biết một chất cần phân tích sẽ bị giải hấp nhanh hay chậm ra sao, ta cần biết tỉ lệ thời gian mà nó sẽ ở pha động. Tỉ lệ này đơn giản là tỉ lệ của chất A trong pha động tại bất kì thời điểm nào. Do đó:
mmol A trong pha động
f = tỷ lệ thời gian trong pha động =
Tổng mmol A trong cột
f = [ A]m Vm
[ A]m Vm [ A]S VS
(2)
trong đó: Vm, VS là thể tích pha động và pha tĩnh tương ứng. Có thể đơn giản hoá phương trình (2) bằng cách chia cả tử và mẫu số cho [A]mVm:
f =1
1 [ A]S VS / [ A]m Vm
=1
1DVS / Vm
(3)
Từ (3) ta thấy, mặc dù [A]S và [A]m biến đổi khi đi qua cột nhưng tỉ số [A]S/[A]m bao giờ cũng bằng D khi đã đạt tới cân bằng. Số hạng DVS/Vm đã
được dùng dưới dạng thừa số dung tích k’, vì thế nên: f =
1
1k'
(4)
Vận tốc UA của A đi qua cột sẽ bằng vận tốc U của pha động trong suốt thời gian mà chất A còn ở trong pha động và sẽ bằng “không’’ khi nó ở pha tĩnh.
Do vậy: UA = Uf = U (
1
1k'
) (5)
Số hạng
1
1k'
≤ 1 vì k’ ≥ 0; vì thế vận tốc của A không bao giờ có thể lớn
hơn vận tốc của pha động (dung môi rửa giải).
IV.2.1 Thời gian lưu:
Chất cần phân tích A cuối cùng sẽ được giải hấp ra khỏi cột một thời điểm tR gọi là thời gian lưu. Từ vận tốc của A và chiều dài của cột, có thể tính được thời gian lưu là:
chiều dài cột (cm)
tR = vận tốc của A (cm/s)
tR = L =
U A
L (1 + k’) (6)
U
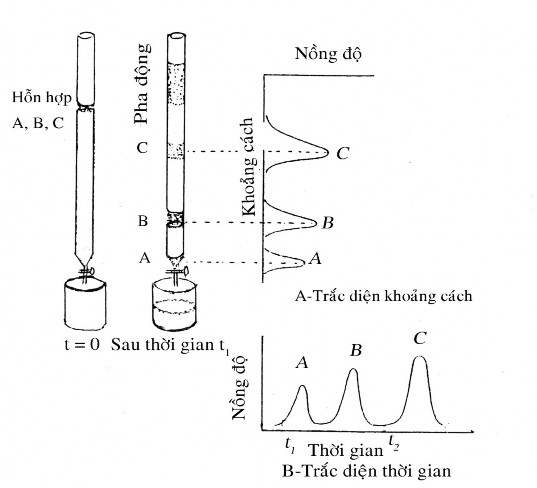
Hình 4.3: Tách sắc kí do Michael Txvet thực hiện, các hợp phần A, B, C có thể được quan sát theo trắc diện khoảng cách (A) và trắc diện thời gian (B).
Pha động sẽ chảy qua cột với vận tốc U nên thời gian nó lưu lại trong cột
tm là: tm =
L (7)
U
có thể tổ hợp các phương trình (6), (7) để được:
tR = tm (1 + k’) (8)
Thời gian lưu của bất kì chất nào không bị giữ ở pha tĩnh (D = 0 k’ = 0) cũng sẽ là tm. Điều này cho phép ta đo được tm bằng cách theo dõi vận tốc của chất không bị cột giữ, chẳng hạn như không khí trong cột sắc kí khí tiêu biểu.
IV.2.3. Thể tích lưu:
Thể tích lưu phụ thuộc vào tốc độ chảy (F) của pha động qua cột là một biến số thực nghiệm thường biến đổi từ thí nghiệm này qua thí nghiệm kia. Mặt khác, thể tích pha động cần để rửa giải chất phân tích sẽ không phụ thuộc vào tốc độ chảy. Thể tích lưu VR sẽ là:
VR (ml) = tR (s) . F (ml/s) (9)
Đồng thời, thể tích của pha động Vm trong cột là:
Vm (ml) = tm (s) . F (ml/s) (10) Vm cũng được coi là thể tích trống trong cột vì bất kì thể tích nào trong cột mà không bị pha tĩnh chiếm sẽ bị pha động chiếm. Tổ hợp (8), (10) ta được:
tR = tm (1 + k’)
VR =
F
Vm (1 + k’) VR = Vm (1 + k’) (11)
F
VR = Vm + Vmk’
VR = Vm +
Vm DVS
Vm
VR = Vm + DVS (12)
Thể tích lưu phụ thuộc vào thể tích pha động trong cột, thể tích pha tĩnh và hệ số phân bố. Hiệu số VR - Vm là quan trọng hơn cả. Đó là thể tích rửa giải không tính thể tích cần để lấp khoảng trống trong cột, nó được coi là thể tích lưu hiệu chỉnh V’R:
V’R = VR - Vm = D VS (13)
Thể tích lưu hiệu chỉnh tỉ lệ thuận với hằng số cân bằng của quá trình tách. Hằng số tỉ lệ là thể tích pha tĩnh trong cột nó sẽ không đổi đối với bất kì một cột nhất định nào. Nếu đã biết thể tích pha tĩnh thì có thể chia thể tích lưu hiệu chỉnh cho VS để được thể tích lưu đặc trưng Vg:
Vg = VR
VS
= D (14)
Vg còn là thể tích lưu để rửa giải chất phân tích trong một đơn vị thể tích hoặc trong một đơn vị về lượng pha tĩnh. Trong thực tế, có thể dùng trọng lượng pha tĩnh thay cho VS để xác định thể tích lưu đặc trưng:
Vg =
D : tỉ trọng của pha tĩnh
IV.2.3. Sắc ký khí (GC):[25]
IV.2.3.1. Sắc ký khí – rắn (GSC):
Trong GSC chất mang rắn là pha tĩnh và điển hình là polime, silicagel, nhôm oxit. Hiện tượng hấp phụ giữ vai trò chính và thường tạo ra những pha sắc kí đối xứng (tạo đuôi cho dải) vì D thường phụ thuộc nồng độ trong cân bằng hấp phụ.
- Cột được nhồi chất rắn hấp phụ mạnh chất cần phân tích để có thể có thời gian lưu lâu hơn nhiều so với thời gian lưu trong GLC, do đó mà những chất bay hơi có thể được tách dễ dàng.
- Các hạt rắn được dùng nhất là Silicagen hoặc nhôm oxit đều có thể tác dụng như những chất xúc tác làm cho các phản ứng hoá học diễn biến được trong cột với chất cần phân tích.
IV.2.3.2. Sắc ký khí – lỏng (GLC):
Cột nhồi - khi sử dụng pha tĩnh lỏng nó phải được giữ trên một số chất mang rắn để ngăn không cho nó di chuyển qua cột theo pha động. Chất dùng làm chất mang thông thường nhất là đất lưỡng nguyên, một chất liệu của silic chứa khung hai nguyên tử. Chất liệu này là thành phần chính trong gạch chịu lửa, bền ở nhiệt độ cao.
IV.3. Cơ sở lý thuyết của phương pháp tách:[12]
IV.3.1. Tách chất bằng phương pháp chưng cất:
IV.3.1.1. Cân bằng lỏng hơi của hệ hai hay nhiều cấu tử:
Để xác định số đĩa lí thuyết và tỉ số hồi lưu phải có các dấu hiệu cân bằng lỏng - hơi của hệ chất cần tách ở áp suất cần chưng cất. Thành phần của pha hơi và pha lỏng phải khác nhau.
Khi hệ chất cần tách là lý tưởng thì cân bằng lỏng - hơi được tính theo định luật Raoult: Pi = xi Poi
Poi: áp suất hơi bão hoà của cấu tử i ở trạng thái nguyên chất;
Pi: áp suất hơi riêng phần của cấu tử i tại hỗn hợp có thành phần xi. xi: phân số mol của cấu tử.
i: ở pha lỏng xi =
ni
ni
Để tính sơ đồ cân bằng đẳng áp của hệ hai cấu tử lý tưởng phải có phương trình áp suất hơi của hai cấu tử, theo phương trình Clausius – Clopayron:
lgP = A -
B = A -
T
V H
2,303.RT
Nếu hỗn hợp hai cấu tử không phải là dung dịch lí tưởng thì phải xác định cân bằng lỏng hơi ở áp suất cho trước.
IV.3.1.2. Xác định số đĩa lí thuyết và tỷ số hồi lưu bằng phương pháp MC Cabe - Thielo:
Tỷ số hồi lưu là tỷ số giữa phần chất hồi lưu lại và phần chất được chưng cất ra:
= R D
Phương pháp MC Cabe - Thielo dựa trên sơ đồ y/x để xác định số đĩa lí thuyết và tỉ số hồi lưu.
Để xác định số đĩa lí thuyết, trước hết ta xây dựng đường làm việc của phần trên cột cất bằng cách nối điểm x = xD ở đường chéo hệ trục toạ độ với
điểm y =
phần cất ra).
1 .xD ở trục tung (xD: phân số mol của cấu tử dễ bay hơi trong
1
IV.3.1.3. Xác định số đĩa lí thuyết cực tiểu và tỷ số hồi lưu cực tiểu theo phương pháp MC Cabe - Thielo:
Để thử nghiệm cột chưng cất người ta thường làm việc với tỉ số hồi lưu phần toàn lượng và lấy một lượng rất nhỏ chất để phân tích, từ đó xác định số đĩa lí thuyết bằng phương pháp MC Cabe - Thielo khi dùng đường chéo của hệ toạ độ chính là đường làm việc của cột chưng cất.
Để xác định tỉ số hồi lưu cực tiểu, người ta xây dựng đường làm việc của phần trên cột cất, đường này cắt đường cân bằng lỏng hơi. Từ đoạn cắt của
đường này trên trục y ta tính được tỉ số hồi lưu cực tiểu: min =
xD - 1
y
Như vậy trong quá trình chưng cất sẽ xảy ra hai trường hợp cho một nhiệm vụ tách đó là:
+ Nếu tiến hành chưng cất với tỉ số hồi lưu cực lớn thì chỉ cần số đĩa lí thuyết nhỏ và ngược lại.
+ Với tỉ số hồi lưu nhỏ thì số đĩa lí thuyết phải lớn.
IV.3.1.4. Xác định đường kính của cột chưng cất và chiều cao của cột chưng cất cho yêu cầu tách đã cho: