loãng đến 50,00 ml. Các dữ liệu thực nghiệm thu được khi phân tích như trên với 4,0264 gam mẫu cành cây sồi :
ppm Na | Độ phát xạ | |
Mẫu trắng | 0 | 0 |
Mẫu chuẩn 1 | 2,00 | 90,30 |
Mẫu chuẩn 2 | 4,00 | 181,0 |
Mẫu chuẩn 3 | 6,00 | 272,0 |
Mẫu chuẩn 4 | 8,00 | 363,0 |
Mẫu chuẩn 5 | 10,00 | 448,0 |
Mẫu phân tích | 238,0 |
Có thể bạn quan tâm!
-
 Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh
Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh -
 Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro
Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro -
 Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ
Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ -
 Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B).
Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B). -
 Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph
Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16
Xem toàn bộ 167 trang tài liệu này.
Hãy xác định hàm lượng Na theo ppm trong cành cây sồi.
Giải:
Tiến hành xây dựng đường chuẩn, hồi qui tuyến tính theo nguyên lí bình phương tối thiểu A = aC + b:
Hàm lượng Na (C) | Độ hấp thụ (A) | A.C | C2 | |
Mẫu trắng | 0,00 | 0,00 | 0,000 | 0,000 |
Mẫu chuẩn 1 | 2,00 | 90,30 | 180,600 | 4,00 |
Mẫu chuẩn 2 | 4,00 | 181,0 | 724,000 | 16,00 |
Mẫu chuẩn 3 | 6,00 | 272,0 | 1632,000 | 36,00 |
Mẫu chuẩn 4 | 8,00 | 363,0 | 2904,000 | 64,00 |
Mẫu chuẩn 5 | 10,00 | 448,0 | 4480,000 | 100,00 |
Mẫu phân tích | 238,0 | |||
n = 6 | C = 30,0 | A = 1354,3 | AC = 9920,6 | C2 = 220 |
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
6.9920,6 1354,3.30
= 44,987
n n 2
6.220 302
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 1,354 . 220 9920,6.30
b =i1 i1 i1 i1=
= 0,781
n n 2
6.220 302
i
i
nC 2 C
i1
i1
500
450
400
350
300
250
200
150
100
50
0
y = 44,987x + 0,781 R2 = 0,9999
0 2 4 6 8 10 12
Hình 3.6 Đường chuẩn xác định hàm lượng Na trong mẫu cây sồi.
Xây dựng đường chuẩn: y = 44,987C + 0,781
C = 5,273 ppm; khối lượng Na trong mẫu: m = 5,273.50,0 = 263,65 g
Hàm lượng Na trong mẫu cành cây sồi : 263, 65 = 65,48 ppm.
4, 0264
Bài 15:Gluodenis mô tả phương pháp sử dụng ICP để phân tích lượng Pb và Ni trong mẫu đồng thau.
a) Việc xác định Pb theo phương pháp chuẩn ngoài chuẩn bị từ mẫu đồng thau chứa lượng Pb chưa biết. Kết quả phân tích cho trên bảng sau:
%W/W Pb | Cường độ phát xạ (I.10-4) | |
1 | 0.000 | 4.39 |
2 | 0.0100 | 18.7 |
3 | 0.0200 | 32.0 |
0.0650 | 128 | |
5 | 0.3500 | 622 |
6 | 0.7000 | 1260 |
7 | 1.0400 | 1770 |
8 | 2.2400 | 3880 |
9 | 3.1500 | 5610 |
10 | 9.2500 | 16400 |
4
Thành phần % khối lượng của Pb trong mẫu là bao nhiêu khi cường độ phát xạ của mẫu là 9.25.104?
b). Việc xác định Ni theo phương pháp chuẩn trong chuẩn bị từ mẫu đồng thau chứa lượng Ni chưa biết. Kết quả phân tích cho trên bảng sau:
%W/W Ni | Tỉ số của cường độ phát xạ | |
1 | 0.000 | 0.00267 |
2 | 0.0140 | 0.00154 |
3 | 0.0330 | 0.00312 |
4 | 0.1300 | 0.12000 |
5 | 0.2800 | 0.24600 |
6 | 0.2800 | 0.24700 |
7 | 0.5600 | 0.53000 |
8 | 1.3000 | 1.20000 |
9 | 4.8200 | 4.40000 |
Thành phần % khối lượng của Ni trong mẫu là bao nhiêu khi tỉ số cường độ phát xạ của mẫu là 1,10.10-3?
Giải:
a, Tiến hành xây dựng đường chuẩn, hồi qui tuyến tính theo nguyên lí bình phương tối thiểu I = aC + b:
%W/W Pb | Cường độ phát xạ (I.10-4) | I.C | C2 | |
1 | 0,000 | 4,39 | 0,000 | 0,0000 |
2 | 0,010 | 18,7 | 0,187 | 0,0001 |
3 | 0,020 | 32,0 | 0,640 | 0,0004 |
4 | 0,065 | 128,0 | 8,320 | 0,0042 |
5 | 0,350 | 622,0 | 217,7 | 0,1225 |
6 | 0,700 | 1260,0 | 882,0 | 0,4900 |
7 | 1,040 | 1770,0 | 1840,8 | 1,0816 |
8 | 2,240 | 3880,0 | 8691,2 | 5,0176 |
9 | 3,150 | 5610,0 | 17671,5 | 9,9225 |
10 | 9,250 | 16400,0 | 151700 | 85,5625 |
n=10 | C=15,68 | A=29670 | AC=181012,35 | C2=102,2 |
n n n
nAi Ci Ai Ci
a =i1 i1 i1
= 10.181012,35 29670.15,68
= 1772,8
n n 2
10.102,2 15,682
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 29670.102,2 181012,35.15,68
b =i1 i1 i1 i1=
= -10,266
n n 2
10.102,2 15,682
i
i
nC 2 C
i1
i1
Xây dựng đường chuẩn thu được: I = (1772,8C – 10,266).104 Ta có: I = 9,25.10-4 tính được C% = 0,011%
b) Tiến hành xây dựng đường chuẩn, hồi qui tuyến tính theo nguyên lí bình phương tối thiểu K = aC + b:
%W/W Ni | Cường độ phát xạ | A.C | C2 | |
1 | 0,000 | 0,00267 | 0,0000 | 0,0000 |
2 | 0,014 | 0,00154 | 0,0000 | 0,0002 |
3 | 0,033 | 0,00312 | 0,0001 | 0,0011 |
4 | 0,130 | 0,12000 | 0,0156 | 0,0169 |
5 | 0,280 | 0,24600 | 0,0689 | 0,0784 |
6 | 0,280 | 0,24700 | 0,0692 | 0,0784 |
7 | 0,560 | 0,53000 | 0,2968 | 0,3136 |
8 | 1,300 | 1,20000 | 1,5600 | 1,6900 |
9 | 4,280 | 4,40000 | 18,8320 | 18,3184 |
n=9 | C=6,877 | A=6,75033 | AC=20,8426 | C2=20,4970 |
n n n
nAi Ci Ai Ci
a = i1 i1 i1 =
9.20,8462 20,8426.6,887
= 0,9149
n n 2
9.20,497 6,8772
i
i
nC 2 C
i1
i1
n n n n
A C 2 A .C C
i i i i
i 6,75033.20,497 20,8426.6,887
b =i1 i1 i1 i1=
= 0,0039
n n 2
9.20,497 6,8772
i
i
nC 2 C
i1
i1
Xây dựng đường chuẩn thu được: K = 0,9149C- 0,0039 C = 5,465.10-3
Kết luận chương III: Chương “Phương pháp phân tích Quang phổ phát xạ nguyên tử ”: đã xây dựng hệ thống câu hỏi tự luận và hệ thống bài tập có phân loại theo các dạng bài tập và đề xuất cách giải: Xác định giá trị nguyên tử ứng với mức năng lượng mà electron chuyển tới, tính năng lượng photon
của các bước sóng của bức xạ đơn sắc, xác định % của kim loại trong mẫu bằng phương pháp chuẩn, khi biết cường độ phát xạ.
CHƯƠNG IV
CÁC PHƯƠNG PHÁP TÁCH, CHIẾT VÀ PHÂN CHIA
IV.1 CƠ SỞ LÍ THUYẾT CỦA PHƯƠNG PHÁP CHIẾT:
IV.1.1 Định nghĩa và hệ số phân bố:[16]
- Chiết là phương pháp tách, phân chia, làm giàu chất dựa vào quá trình chuyển chọn lọc chất phân tích từ pha này sang pha khác. Tuỳ theo chất tan, người ta có thể sử dụng các dung môi chiết, cũng như tác nhân chiết khác nhau.
- Đặc điểm chung của quá trình chiết: hai pha không trộn lẫn; chất tan chuyển từ pha này sang pha khác; chất tan phân ưu tiên vào pha nào có tính chất tương tự nó.
- Giả sử có một chất tan A được hoà tan trong hai dung môi (1) và (2) không trộn lẫn với nhau. Chất tan A sẽ được phân bố giữa hai dung môi:
A (1) A (2) (IV.1)
Thông thường dung môi (1) là nước. Dung môi (2) là dung môi hữu cơ. Quá trình chất tan A chuyển từ dung môi (1) sang dung môi (2) được gọi là quá trình chiết.
Áp dụng định luật tác dụng khối lượng cho cân bằng (V.1) ta có biểu thức:
D = A(2)
A(1)
(IV.2)
(A)(2): nồng độ chất tan A trong dung môi (2).
(A)(1): nồng độ chất tan A trong dung môi (1).
xét đối với trường hợp một dạng của A phân bố ở 2 pha khác nhau:
K = [ A](2)
K :gọi là hằng số phân bố.
D [ A]
D
(1)
IV.1.2 Hằng số chiết:[27]
Cho ion kim loại Mn+ tạo phức với phân tử X- sau đó đem chiết bằng dung môi hữu cơ, cân bằng chiết xảy ra như sau:
M
nc
nc
n+ n(HX)hc (MXn)hc + nH
[MX ] .[H ]n
Kex =
n hc nc
(IV.13)
hc
nc
[M n] .[HX ]n
K n
Kex =
a
. DMX .
n
(IV.14)
D
HX
Kex : hằng số chiết.
: hằng số bền phức MXn.
n
DHX : hệ số phân bố của phức HX. DMX : hệ số phân bố của phức MXn. Ka : hằng số phân li của axít HX.
Hằng số chiết đặc trưng cho khả năng tách ion kim loại ra khỏi pha nước –
giá trị Kex càng lớn thì khả năng chiết càng tốt.
IV.1.3. Các yếu tố ảnh hưởng đến quá trình chiết hoá học:[11]
IV.1.3.1. Ảnh hưởng của nồng độ H+ trong pha nước:
Trường hợp H+ tham gia chiết: khi axit hoá dung dịch, H+ đi vào liên kết với tác nhân chiết, trở thành ion dương ở ngay trên bề mặt phân chia giữa
hai pha; tiếp theo, chúng liên kết bền vững với các ion đối trong pha nước là các chất cần chiết và chuyển vào pha hữu cơ.
Thí dụ: Chiết Fe3+ bằng ete trong môi trường axit:
(Fe3+)nc + 4(Cl-)nc + (H+)nc + xShc = ( H [FeCl4]Sx )hc
Kex =
(H[FeCl4 ]Sx )hc
nc
nc
nc
[Fe3] [Cl ]4 [H ]
[S]x
hc
Tuy nhiên Fe (III) còn tồn tại ở dạng tự do.
Hệ số phân bố điều kiện: D =
(H[FeCl4 ]Sx )hc
nc
[Fe3] (H[FeCl ]S
4 x
)nc
4
Giả sử có bao nhiêu Fe3+ đều chuyển thành FeCl
sau đó đều tạo dạng chiết
H(FeCl4)Sx và chuyển lên pha hữu cơ bấy nhiêu và có nồng độ thích hợp để
không có sản phẩm phụ, lúc đó: D =
[H (FeCl4 ]Sx ]hc [Fe3]
Thay D vào Kex ta có: Kex =
D
nc
nc
[Cl ]4 .[H ]
nc
hc
.[S ]x
Nếu trong điều kiện thí nghiệm không đổi, Kex = const, nồng độ [Cl-] đủ lớn
= const D chỉ phụ thuộc vào [H+].
lgD = lgKex + 4lg[Cl-]nc + lg[H+]nc + xlg[S]hc
Biểu diễn sự phụ thuộc lgD vào lg[H+] được biểu diễn bằng đồ thị: A = (lgKex + 4lg[Cl-]nc + xlg[S]hc) = const
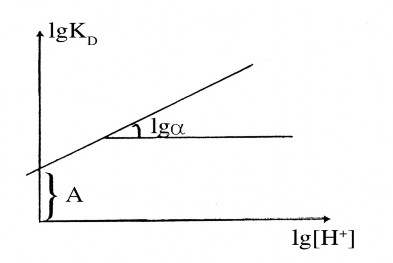
Hình 4.1: Ảnh hưởng của nồng độ H+ trong pha nước