để xác định hai bước sóng
31
và 41
thuộc dãy Lyman ta có thể tổ hợp các
biểu thức trên:
E 3 1 = h31
= E3 – E1 = (E3 – E2) + (E2 – E1)
Từ (2) và (1) ta có:
Có thể bạn quan tâm!
-
![1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) 1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]
1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11] -
 Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh
Vị Trí Các Vạch Phổ Đã Biết Và Chưa Biết Trên Kính Ảnh -
 Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro
Giản Đồ Năng Lượng Phát Xạ Nguyên Tử Của Hiđro -
 Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi.
Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi. -
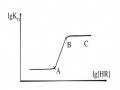
 Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B).
Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B). -
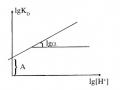
 Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph
Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph
Xem toàn bộ 167 trang tài liệu này.
hc =
31

hc +
32
hc
21
1
31
= 1
32
+ 1
21
=
32 21
= 65663.1215 = 1193 0
31
32
21
656631215 A
Từ (3) và (4) ta có:
hc =
41
hc +
42
hc
21
1
41
= 1
42
+ 1
21
=
42 21
= 4861.1215 = 972 0
41
42
21
48611215 A
Bài 5:Trong một thí nghiệm người ta đã cung cấp một năng lượng gấp 1,5 lần năng lượng tối thiểu để bứt một electron ra khỏi trạng thái cơ bản của
nguyên tử hiđro. Hỏi bước sóng theo
0
A của bức xạ trong trường hợp này
bằng bao nhiêu? Cho h = 6,62.10-34J.s ; me = 9,1.10-31kg; c = 3.10-8 m/s.
Giải:
Khi cung cấp một năng lượng gấp 1,5 lần năng lượng tối thiểu, EH (năng lượng đối với H ở trạng thái cơ bản) để làm bứt electron ra khỏi H thì năng lượng này được chia làm 2 phần. E1 là năng lượng dùng để bứt electron (năng lượng ion hoá). E2 là năng lượng dùng để làm cho electron chuyển động.
Ta có: E = E1 + E2
1,5EH
= EH +
mv 2
2
1 EH =
2
1 mv2
2
mEH = (mv)2
mE H
mv =
Để xác định bước sóng ta áp dụng hệ thức De Broglio:
= h hay =
mv
h mEH
Thay số vào biểu thức ta có: =
6,62.1034
9,1.1031 .13,6.1,6.1019
= 4,7 . 10-10 m =
0
4,7 A
Bài 6:
a, Cho phân tử nitơ chuyển động trong hộp thế một chiều với L = 5cm, hãy xác định hiệu năng lượng (theo J) giữa hai mức năng lượng thấp nhất?
Cho h = 6,62.10-34J.s ; me = 9,1.10-31kg; c = 3.10-8 m/s.
b, Tính xem phản ứng với giá trị n bằng bao nhiêu thì năng lượng của phân
tử nitơ đạt được giá trị
3 kT ở 3000K.
2
c, Tại mức năng lượng tương ứng với n vừa tìm được thì năng lượng tách bằng bao nhiêu khi N2 chuyển về mức năng lượng thấp kế tiếp.
Cho k = 1,381.10-23J/K-1 ; h = 6,62.10-34J.s ; N = 14 ; me = 9,1.10-31kg;
1u = 1,66.10-27kg
Giải:
h 2 h 2
a, Ta có: E 2 1 = E2 - E1 = 4
8mL2
- 1
8mL2
E = 3
h 2
8mL2
= 3 (6,62.1034 ) 2
8.28.1,66.1027.(5.102 ) 2
E n n – 1
E 2 1
E
= 3 . 4,714.10
-40
= 1,41.10
-39J
Hình 3.4 Giản đồ hiệu mức năng lượng thấp nhất của phân tử Nitơ
b, khi E đạt được
3 kT ở 3000K, nghĩa là:
2
E = n2
h 2
8mL2
= 3 kT n2 . 4,714.10-40 =
2
3 kT
2
3kT
2.4,714.1040
3.1,381.1023.300
2.4,714.1040
n = = = 3,63.10-9
2
2
2 2 h h
c, E n n – 1 = En – En – 1 = [n
Do n >> 1:
– (n - 1) ]
8mL2
= (2n - 1)
8mL2
E n = 2n
h 2
8mL2
= 2.3,63.109.4,714.10
-40
= 3,42.10
-30 J
Bài 7:Từ lời giải phương trình Schrodinger cho hệ một electron, một hạt
nhân và liên hệ E
giữa hai mức năng lượng
E và
n
c
En (kí hiệu nc và nt chỉ
t
mức năng lượng ứng với số lượng tử n cao hoặc thấp) ta thu được biểu thức:
1 1
RH n 2 n 2
(1)
t c
Trong đó:
là tần số vạch phổ (theo Hz) trong quang phổ vạch H. RH là hằng số Ritbe cho hiđro.
1. Biểu thức (1) tính vạch phổ hấp thụ hay phát xạ? Tại sao?
2. Hãy cho biết công thức cụ thể của RH?
3. Cho RH = 3,29.1015Hz. Hãy tính của một vạch trong dãy Lyman với nc = 7?
Giải:
1.Lời giải phương trình Schrodinger cho hệ một electron, một hạt nhân thu
được biểu thức: En
= - mZ 2 e 4
0
2n 2 2 (4) 2
(a)
Mặt khác. có E
= E -
n
c
E = h(b)
n
t
1 1
Kết hợp hai biểu thức (a), (b) ta có biểu thức RH n 2 n 2
(1)
t c
Vậy (1) là biểu thức tính tần số của một vạch phổ phát xạ (ta xét với H nên Z = 1).
2. Kết hợp hai biểu thức (a), (b) và 4 0
= 1 ; = h
2
ta thu được biểu thức
của hằng số Ritbe cho H là RH =
22 me 4
h3 c
(2)
3. Dãy Lyman có nt = 1 ; với nc = 7 thay vào (1) ta có:
Bài 8:
= 3,29.1015(1 -
1 )Hz = 3,22.1015Hz
49
a, Hãy viết biểu thức tính năng lượng (E) của electron trong nguyên tử H từ việc giải phương trình chrodinger?
b, Từ biểu thức năng lượng đó hãy rút ra biểu thức tính số sóng của các
vạch phổ phát xạ của nguyên tử H?
Giải:
a, Lời giải phương trình Schrodinger cho hệ một electron, một hạt nhân thu
được biểu thức: En
= - mZ 2e4
0
2n22 (4)2
h
Trong đó: Z = 1; 40= 1 ; = 2
Biểu thức tính năng lượng (E) của electron trong nguyên tử H từ việc giải
phương trình chrodinger: En
= - 22 me 4
n 2 h 2
= - 13,6 eV
n 2
b, E
= E c -
Et ;
E = h= h c
_
= hc
_ E E
22 me 4 1 1
1 1
c t=
hc
h3 c
n2
n2
= RH n2
n2
t c t c
với RH =
22 me 4
h3 c
= 109195,16 cm-1
Bài 9:Để phá vỡ liên kết I – I trong 1 mol iot đòi hỏi phải cung cấp một năng lượng là 150,48 kJ dưới dạng của ánh sáng kích thích. Hãy tính bước sóng đó ứng với giá trị là bao nhiêu theo nm. Cho h = 6,62.10-34 J.s ; c = 3.108 m/s ; NA = 6,022.1023 mol-1.
Giải:
Phương trình: h+ I2 2I
Ta có: E = h
= 150480 = 24,98.10-20 J
6,022.1023
Mặt khác:
hc
E
= 6,625.1034.3.108 24,98.1020
= 0,795.10-6m = 795nm.
Dạng 2: Tính năng lượng photon của các bước sóng của bức xạ đơn sắc.
Cách giải:
* Áp dụng công thức: E h
và c
Trong đó: h: hằng số Plank, h = 6,626.10-27 ec.s C: tốc độ ánh sáng = 3.108 m/s
: bước sóng của bức xạ.
: tần số của bức xạ.
Bài 10:Hãy tính năng lượng của photon (trong ec) của các bước sóng sau: a, 803nm
0
b, 999 A
Giải:
Áp dụng công thức: a, 803nm = 803.10-9m
E h
trong đó
c
ta có:
tần số sóng c
= 3.108 803.109
= 3,74.1014 s-1
Năng lượng photon:
E h
0 -10
= 6,626.10-27 . 3,74.1014 = 2,48.10-12 ec
b, 999 A = 999.10 m
tần số sóng c =
3.108
999.1010
= 3.1015 s-1
Năng lượng photon:
E h
= 6,626.10-27 . 3.1015 = 2.10-9 ec
Bài 11:Thực nghiệm đã xác định được độ dài bước sóng của hơi Natri là
0
= 5900 A . Hãy xác định:
a, Năng lượng của các quang electron (photon) phát ra theo J và eV? b, Tần số sóng theo Hz?
Giải:
a, Áp dụng công thức:
E hc =
6,626.1034 3.108
5900.1010
= 3,36.10-19 J
vì 1 eV = 1,6.10-19J 3,36.10-19J = 2,1 eV
b, Ta có: E h
E h
= 3,36.1019 6,626.1034
= 5,08.1014 Hz hoặc c
= 5,08Hz
Bài 12:Trong trường hợp đối với nguyên tử H, hãy xác định các đại lượng sau:
a, Năng lượng kích thích dùng để chuyển electron ở trạng thái cơ bản lên trạng thái ứng với n = 3.
b, Năng lượng ion hoá để tách electron ở n = 3 tới xa .
c, Bước sóng (nm) khi electron chuyển từ n = 3 về n = 2.
Giải:
Trong trường họp chung, ta có thể áp dụng công thức:
1 1
E = Ec – Et = EH
n2 n2
t c
Ở đây EH là năng lượng của H ở trạng thái cơ bản. EH = -13,6eV.
3
n =
n = 4
n = 3
32
n = 2
13
n = 1
Hình 3.5 Giản đồ năng lượng nguyên tử H
a, Đối với bước chuyển 1 3 năng lượng tương ứng là:
1 3 3 1
1
E = E – E = -13,6 1
= 12,09 eV.
32 12
b, Năng lượng ion hoá ứng với bước chuyển 3 là:
E 3
= E
– E3
= -13,6 1 1
9
= 1,5 eV.
c, Bước sóng
32
khi electron chuyển từ 3 2 là:
E = E – E
= h= h
C = -13,6 1 1
3 2 3 2
9
4
32
32 = 36
hC = 6,57.10-7m hay
5.13,6.1,6.1019
32 = 657nm.
Bài 13:Vạch phổ ứng với bước chuyển nt = 1 và nc = 2 đối với ion He+ có bước sóng tương ứng = 30,3.10-9m.
He
a, Hãy xác định giá trị R ?
b, Tính năng lượng ở trạng thái cơ bản theo J và eV đối với ion He+?
Giải:
a, Đổi 30,3.10-9m = 30,3.10-7 cm
Ta có:
1 = R
1
1
He n 2 n 2
t
1 = R
c
1 1
30,3.107
He1 4
R = 0,044.10 cm = 4,4.10 cm .
7 -1 5 -1
He
2
b, áp dụng công thức: E = -13,6. Z
n 2
2
Ta có: E = -13,6. 2
12
= -54,4 eV
năng lượng ở trạng thái cơ bản đối với He+ là 54,4 eV = 87,04.10-19J
Dạng 3:Xác định % của kim loại trong mẫu bằng phương pháp chuẩn, khi biết cường độ phát xạ.
Cách giải:
Tiến hành xây dựng đường chuẩn, hồi qui tuyến tính theo nguyên lí bình phương tối thiểu A = aC + b:
i
i
i
i
i
i
n n n n n n n
i
i
i
nA C A C
A C 2 A .C C
Trong đó: a =
i1 i1 i1
; b =
i1 i1 i1 i1
n n 2 n n 2
i
i
i
i
nC 2 C nC 2 C
i1
i1
i1
i1
Từ phương trình hồi quy tuyến tính ta suy ra nồng độ C, từ đó suy ra tỉ lệ %.
Bài 14Nồng độ Na trong cây có thể được xác định bằng phương pháp quang photphat xạ nguyên tử. Mẫu phân tích được chuẩn bị bằng cách nghiền nhỏ, homogen hoá và làm khô ở 103oC. Một mẫu khoảng 4 gam được chuyển vào bình thạch anh nung trên đĩa để phân huỷ hợp chất hữu cơ. Mẫu được nung trong lò nung ở 550oC trong vài giờ, sau khi đưa về nhiệt độ phòng, phần tro được hoà tan trong 2,0 ml dung dịch HNO3 1:1 và làm bay hơi đến khô. Phần cặn rắn được hoà tan lại bằng 10,0 ml dung dịch HNO3 1:9, lọc và pha

![1.3 Bản Chất Của Phương Pháp Quang Phổ Phát Xạ Nguyên Tử:[11]](https://tailieuthamkhao.com/uploads/2022/08/29/xay-dung-he-thong-cau-hoi-va-bai-tap-mot-so-chuong-trong-phan-tich-li-hoa-9-1-120x90.jpg)