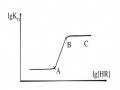
thay đổi đáng kể cho chiều cao pic mặc dù diện tích vẫn giữ hầu như không đổi; vì thế việc chỉ đo chiều cao pic có thể dẫn tới những sai số lớn.
Câu 17:Lấy một mẫu nhựa ở dạng H+ rồi cho nó vào 1 dung dịch có chứa Na+ nồng độ cao vừa phải. Phản ứng trao đổi sau sẽ xảy ra:
R-H + Na+ + H2O R-Na + H3O+ (*)
Thiết lập biểu thức tính hằng số cân bằng D? và cho biết những yếu tố nào sẽ xác định D?
HDTL:
* Hệ số phân bố của phản ứng trao đổi vẫn là “tích của các chất tham gia phản ứng” giống như bất kì hằng số cân bằng nào nhưng trong trường hợp này phải kể đến các phần tử tích điện. Với mỗi điện tích ion chuyển được từ pha động vào pha tĩnh thì phải có một điện tích chuyển theo hướng ngược lại. Hằng số cân bằng biểu thị ở phương trình (*). (bỏ qua hoạt độ của H2O)
3
[R Na][ H O]
K = [R H ][ Na ]
Có thể bạn quan tâm!
-
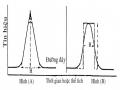
 Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B).
Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B). -
 Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph
Đường Cong Đặc Trưng Về Sự Phụ Thuộc Phần Trăm Chiết Vào Ph -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16 -
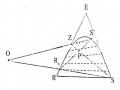
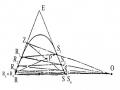
 Đường Binodan Và Đường Conot Đối Với Hệ 3 Cấu Tử Nước (R) - Axeton (E) - Clo Benzen (S).
Đường Binodan Và Đường Conot Đối Với Hệ 3 Cấu Tử Nước (R) - Axeton (E) - Clo Benzen (S). -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 19
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 19 -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 20
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 20
Xem toàn bộ 167 trang tài liệu này.
K cũng được gọi là “ hằng số chọn lọc” của phản ứng trao đổi ion.
* Những yếu tố nào sẽ xác định D?
Từ phương trình (*), H+ trên chất trao đổi cation bị thay thế bởi một ion kim loại nào đó, thì K sẽ tăng lên trong những điều kiện sau:
1. Điện tích trên Mn+ tăng.
2. Bán kính ion hiđrat hoá của Mn+ giảm.
3. Liên kết ngang của nhựa lớn hơn (khi mạch liên kết ngang giảm đi thì mọi giá trị K tiến tới 1).
4. Có hiệu ứng hấp phụ, chẳng hạn với những ion hữu cơ phân tử lượng lớn.
- Yếu tố 1 cho thấy các chất làm mềm nước hoạt độ được tốt vì những ion làm cứng nước đều 2+, trong khi nhựa (hoặc khoáng tự nhiên trao đổi ion) chứa các ion 1+.
- Yếu tố 2 sẽ có ý nghĩa quan trọng khi các ion có tính chất hoá học giống nhau, chẳng hạn như khi cần tách các đất hiếm hoặc các actinit. Khi K tăng, ion sẽ bị giải hấp khỏi cột chậm hơn vì thế với dãy ion kim loại tương tự thì các ion sẽ bị rửa giải theo trình tự ngược với bán kính ion (ion lớn nhất sẽ bị rửa giải trước tiên).
Câu 18:Giả sử có chứa 1 mẫu chứa chất cần phân tích A+được đưa lên đỉnh cột trao đổi ion và liên tục thêm dung môi rửa giải dùng làm pha động vào. Cần phải dùng 1 thể tích pha động là bao nhiêu trước khi chất A+ bị rửa giải?
HDTL:
Về nguyên tắc thì IEC (sắc kí trao đổi ion) không khác gì các phương pháp sắc kí khác và có áp dụng phương trình: VR = Vm (1+ k’)
Trong đó, VR là thể tích lưu (hoặc rửa giải); Vm là thể tích pha động đựơc chứa trong cột (thể tích trống) và k’ là thừa số dung lượng, thừa số này là:
(m mol A)
k’=
S
(m mol A)
m
Trong IEC, k’ cũng được biết dưới dạng D, tỉ số phân bố. Tuy nhiên trong trao đổi ion có sự cạnh tranh nên k’sẽ phụ thuộc vào bản chất và nồng độ của ion tham gia ví dụ như H3O+ trong phương trình:
R-H + Na+ + H2O R-Na + H3O+
Như vậy thời gian lưu sẽ phụ thuộc vào nồng độ các ion trong dung môi rửa giải.
Câu 19.Hãy cho biết các mối liên hệ cơ bản để dự đoán sự phân bố của chất tan trong phân bố lỏng - lỏng?
HDTL:
* Luật phân bố Nernst: Bất kì một hợp phần trung tính nào cũng sẽ phân bố giữa 2 dung môi trộn lẫn với tỉ số nồng độ trong 2 pha là một hằng số.
D = [ A]hc
[ A]n
* Phần chất A chiết được:
D: hằng số phânbố.
[A]hc: nồng độ của chất A trong pha hữu cơ. [A]n: nồng độ của chất A trong pha nước.
= [ A]hc .Vhc
[ A]hc .Vhc [ A]n .Vn
D.V
1D.V
V: Tỷ số pha (V= Vhc/Vn) Vhc: Thể tích pha hữu cơ. Vn: Thể tích pha nước.
* Phần chiết được sau n lần chiết:
= 1- [
1 ]n
1D.V
* Phân bố dòng ngược :
D.V = 10 99% chất tan được chiết với n = 2
D.V = 0,1 50% chất tan được chiết với n = 7
Mối liên hệ giữa hằng số phân bố D của chất tan trong quá trình chiết và nồng độ của chất tan trong các phễu chiết hoặc các phân đoạn tách khác nhau được thể hiện trong các phương trình sau:
[] + (1-)n] = 1
Phần chiết Tn, r của chất tan có mặt trong phân đoạn r với số lần chiết n được xác định theo phương trình:
Tn, r =
n! .
D.V
n!(n r)! (1D.V )n
Câu 20. Nêu một số ưu điểm, nhược điểm của kĩ thuật ion hoá theo cơ chế giải hấp sử dụng nguồn Laze với sự trợ giúp nền (MALDI)?
HDTL:
Khối phổ - ion hoá theo cơ chế giải hấp với sự trợ giúp nền (Mitrix - asisted Laser Desorption/Ionization Mass spectrometry: MALDI - MS) cho phép phân tích các hợp chất có phân tử lượng lớn với độ nhạy cao.
Kỹ thuật ion hoá theo cơ chế giải hấp sử dụng nguồn Laze với sự trợ giúp nền cho phép phân tích chỉ với 1 lượng mẫu khá nhỏ. Hơn nữa, ưu điểm của từng kĩ thuật này là có thể phân tích các mẫu không đồng nhất. Ngoài ra, kỹ thuật này còn được sử dụng hữu hiệu khi ghép nối với thiết bị sắc kí lỏng hiệu năng cao (HPLC). Sau đây là các ưu nhược điểm của kĩ thuật MALDI:
* Ưu điểm:
- Khoảng khối lượng có thể phân tích lên đến 300.000 Da.
- Độ nhạy đặc trưng khoảng từ thấp hơn femtomol đến picomol, có thể đạt đến attomol.
- Đây là một kĩ thuật “ion hóa mềm”, thường ít hoặc không phân mảnh.
- Phù hợp cho phân tích các hỗn hợp phức tạp.
* Nhược điểm:
- Độ phân giải thấp. Một số thiết bị MALDI có độ phân giải cao hơn nhưng chỉ phân tích được khoảng khối lượng thấp và độ nhạy sẽ giảm.
- Nếu mẫu có thể gây khó khăn khi phân tích các hợp chất có khối lượng dưới 1000 Da. Ảnh hưởng nền này phụ thuộc nhiều vào vật liệu nền.
- Có thể bị phân huỷ quang học do ion hoá - giải hấp Laze.
V.5 Bài tập:
Dạng 1:Tính nồng độ của axit còn lại trong pha nước, khi biết hằng số phân li axit và hệ số phân bố.
Cách giải:
[H O ]
Áp dụng phương trình: K’D = D .
3 nc
(1)
K a [H
3
O ]
nc
HA
C
và K’D = hc
C
(2)
Từ (1) và (2)
HAnc
CHA
nc
Bài 1:Tính nồng độ axit axetic còn lại trong pha nước nếu ta cho 60,0 ml axit axetic 0,04M chiết bằng 30,0 ml đimetyl ete ở pH = 3,0 và pH = 8,0. Biết hệ số phân bố của axit axetic giữa nước và đimetyl ete là 780.
Ka = 1,60.10-5.
Giải:
* Ta có: pH = 3,0 [H3O+] = 1,0.10-3 M
Áp dụng phương trình:
[H O ] 1,0.103
K’D = D .
3 nc
= 780 .
= 768
K a [H
3
O ]
nc
1,0.103 1,6.105
Số mmol CH3COOH ban đầu = 0,04 . 60 = 2,40 mmol. Số mmol CH3COOH bị phân bố giữa 2 dung môi:
3 nc 3 hc
60,0 . CCH COOH + 30,0 . CCH COOH
= 2,40 (*)
Ta lại có: K’D =
CCH COOH
3 hc
C
= 768
CH3COOHnc
3 nc 3
Từ (*): 60,0 . CCH COOH + 30,0 . 768 . CCH COOHnc
= 2,40
3 nc
CCH COOH
= 1,04 . 10-4M
* Ta có: pH = 8,0 [H3O+] = 1,0.10-8 M
Áp dụng phương trình:
[H O ] 1,0.108
K’D = D .
3 nc
= 780 .
= 0,487
K a [H
3
O ]
nc
1,0.108 1,6.105
3
nc
60,0 . CCH COOH
+ 30,0 . 0,487 . CCH COOH
= 2,40
3
3 nc
nc
CCH COOH
= 3,22 . 10-2M
Bài 2:Hệ số phân bố của axit acrylic giữa H2O và etyl metyl ete là 1200. Hằng số phân li axit Ka = 1,125.10-5. Nếu ta đem 100,0 ml CH2=CH–COOH 0,05M chiết bằng 50,0 ml etyl metyl ete ở pH = 4,0 thì nồng độ của axit acrylic còn lại trong pha nước là bao nhiêu?
Giải:
Ta có: pH = 4,0 [H3O+] = 1,0.10-4 M
Theo phương trình:
[H O ] 1,0.104
K’D = D .
3 nc
= 1200
= 1079
K a [H
3
O ]
nc
1,0.104 1,125.105
Mặt khác: K’D =
CCH CH COOH
2 hc
C
= 1079
CH2 CH COOHnc
Số mmol axit acrylic ban đầu = 0,05 . 100 = 5,0 mmol. Số mmol axit acrylic được phân bố ở giữa 2 dung môi:
HA
5,0 = 100,0 C
nc
+ 50,0 . 768 . C
HA
hc
HA
HA
C và C
hc nc
: tổng nồng độ của axít acrylic trong pha hữu cơ và pha nước.
HA
HA
C = 1079 . C
hc nc
HA
5,0 = 100,0 C
nc
+ 50,0 . 1079 . C
HA
nc
CHA = 9,25 . 10 M.
-5
nc
Bài 5:Hệ số phân bố D của axit yếu HA giữa nước và đietyl ete là 800. Hằng số phân li axit Ka = 1,50.10-5. Tính nồng độ axit HA còn lại trong pha nước nếu ta đem 50ml axit HA 0,050M chiết bằng 25,0ml đietyl ete ở pH = 2,0 và pH = 8,0.
Giải:
Ta biết pH = 2,0 [H3O+] = 1,0.10-2 M
Áp dụng phương trình:
[H O ] 1,0.102
K’D = D .
3 nc
= 800 .
= 799
K a [H
3
O ]
nc
1,0.102 1,5.105
Số mmol HA ban đầu = 0,050 . 50 = 2,50 mmol. Số mmol HA được phân bố giữa 2 dung môi:
HA
50,0 . C
nc
+ 25,0 . C
HA
hc
= 2,50
nước.
C và
HA
hc
C : tổng nồng độ của axit HA trong pha hữu cơ và pha
HA
nc
HA
=
D
Mặt khác ta có: K’ C hc = 799
CHAnc
HA
HA
C = 799 . C
hc nc
HA
2,50 = 50,0 C
nc
+ 25,0 . 799 . C
HA
nc
CHA = 1,25 . 10 M.
-4
nc
* Ta có: pH = 8,0 [H3O+] = 1,0.10-8 M
Áp dụng phương trình:
[H O ] 1,0.108
K’D = D .
3 nc
= 800 .
= 0,533
K a [H
3
O ]
nc
1,0.108 1,5.105
HA HA
50,0 . C + 25,0 . 0,533 . C
nc nc
= 2,50
HA
C = 3,95 . 10-2M
nc
Bài 6:Hệ số phân bố của I2 giữa CCl4 và H2O bằng 85. Tính nồng độ I2 còn lại trong pha nước nếu ta đem 50,0 ml dung dịch I21,0.10-3M chiết bằng CCl4 theo các cách sau:
Chiết 1 lần bằng 50,0 ml CCl4. Chiết 2 lần bằng 25,0 ml CCl4. Chiết 4 lần bằng 10,0 ml CCl4.
Giải:
Áp dụng công thức: nếu chiết n lần mỗi lần V2 ml dung môi hữu cơ thì sau n
1 n
lần chiết chất A còn lại trong pha nước: Cn = C0
1D(V / V )
= C0
V n
2 1
1D 2
V1
Ta tính được I2 còn lại trong pha nước:
C (1) = 1,0.10-3
50,0
1
= 1,16.10-5 M
I
2 50,0.85.50,0
C (2) = 1,0.10-3
50,0
= 5,28.10-7 M
2
I
2 50,0.85.50,0
C (3) = 1,0.10-3
50,0
= 5,29.10-10 M
5
I
2 50,0.85.50,0
A
Phần còn lại: C nc
A
C
hc
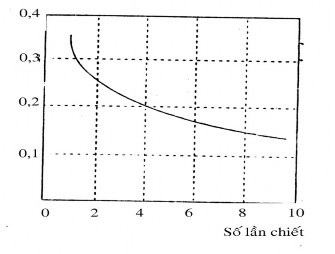
Hình 4.6: Hiệu quả của số lần chiết D = 2; Vnc = 100 ml;
Vhc =
100 ; Tổng Vdmhc = 100 ml
n
Dạng 3:Xác định hệ số phân bố, phần trăm chiết?
Cách giải: Áp dụng công thức: