Để xác định đường kính của cột chưng cất trước hết dựa trên lượng cất lấy ra D. Khối lượng dòng của hơi bay lên bao gồm cả phần chất bay cất ra D và
phần hồi lưu R: n = D + R mà =
R nên n = (1 + )D
D
thể tích dòng vi phân: V = n RT
P
Với R = 0,0826 l.at.mmol-1.k-1 ; P: áp suất ; T: oK
Mà V = A.W trong đó A là thiết diện của cột chưng cất:
2 d 2
Có thể bạn quan tâm!
-
 Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ
Giản Đồ Hiệu Mức Năng Lượng Thấp Nhất Của Phân Tử Nitơ -
 Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi.
Đường Chuẩn Xác Định Hàm Lượng Na Trong Mẫu Cây Sồi. -
 Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B).
Tách Sắc Kí Do Michael Txvet Thực Hiện, Các Hợp Phần A, B, C Có Thể Được Quan Sát Theo Trắc Diện Khoảng Cách (A) Và Trắc Diện Thời Gian (B). -
 Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16
Xây dựng hệ thống câu hỏi và bài tập một số chương trong phân tích lí hoá - 16 -
 Hiệu Quả Của Số Lần Chiết D = 2; V Nc = 100 Ml;
Hiệu Quả Của Số Lần Chiết D = 2; V Nc = 100 Ml; -
 Đường Binodan Và Đường Conot Đối Với Hệ 3 Cấu Tử Nước (R) - Axeton (E) - Clo Benzen (S).
Đường Binodan Và Đường Conot Đối Với Hệ 3 Cấu Tử Nước (R) - Axeton (E) - Clo Benzen (S).
Xem toàn bộ 167 trang tài liệu này.
A = x =
4
nên d =
4 A /
Chiều cao của cột chưng cất được suy ra từ số đĩa lí thuyết (thường 3 đĩa lí thuyết có chiều cao 1m).
--------------- v: vận tốc dòng
v d: đường kính cột chưng cất
---------------
d
V.4 CÂU HỎI:
Câu 1:Nguyên tắc của chiết vật lý là gi? HDTL:
- Chiết vật lý phải đảm bảo được nguyên tắc là chất tan có dạng chiết giống với chính nó ở pha ban đầu, ngoài ra chất tan không tham gia các phản ứng phụ. Hệ chiết khi đó được xem là lí tưởng, cân bằng chất tan chỉ xảy ra giữa hai pha không trộn lẫn. Khi đó áp dụng qui tắc Gibbs để mô tả quá trình này:
N + F = C + 2
N: số pha có trong hệ; C: số cấu tử; F: số bậc tự do của hệ
- Đối với hệ chiết gồm pha nước và pha hữu cơ, N= 2, nếu có một chất tan có trong hệ thì C = 3. Số bậc tự do chính là các điều kiện chiết: nhiệt độ, áp suất và nồng độ cấu tử, F = 3.
- Hệ chiết tiến hành ở điều kiện T = const; P = const, hệ chỉ phụ thuộc vào nồng độ, khi đó tỉ số nồng độ của chất tan giữa hai pha là một hằng số.
- Các chất tan thường là các hợp chất hữu cơ phân cực hoặc không phân cực, nó tương tác với các hợp chất phân cực hay không phân cực khác trong pha hữu cơ tạo nên các liên kết phân cực, liên kết phân tán.
Thí dụ: chiết phenol từ nước vào CHCl3; các phân tử hữu cơ phân cực liên kết với phenol và kéo chúng vào pha hữu cơ, trong thực tế người ta dùng hỗn hợp tác nhân chiết khác nhau gồm nhiều loại dung môi có độ phân cực khác nhau.
Câu 2:Điều kiện của phương trình Nernst cho quá trình chiết vật lý?
HDTL: Nernst đã chứng minh được rằng: tỷ số nồng độ của chất tan ở hai pha không trộn lẫn trong điều kiện nhất định là một hằng số hay:
C2 = const.
C1
Điều kiện của phương trình Nernst:
+ Hai dung môi không trộn lẫn.
+ Nồng độ chất tan đủ loãng.
+ Dạng tồn tại của chất tan.
Nernst xem quá tình chiết là quá trình cân bằng chất tan giữa hai pha không trộn lẫn vào nhau. Khi cân bằng pha thiết lập, hoá thế của chất tan trong pha 1 bằng hoá thế của chất tan ở pha 2:
1 = 2
hay
0 + RT lna1 =
0 + RT lna2
1
2
1
2
0 , 0 : hoá thế của chất tan ở pha 1 và pha 2 ở điều kiện tiêu chuẩn.
R = 8,3144 J/mol: hằng số khí. C2 T: nhiệt độ tuyệt đối (K).
109
Số hóa bởi Trung tâm Học liệu – Đại học Thái Nguyên http://www.lrc-tnu.edu.vn
a1, a2: là hoạt độ của chất tan ở pha 1 và pha 2. a = f . C
C f (0 0 )
ta có:
2=1exp(2 1) tg= KP
C1 f 2 RT
C1
=
1 2
Trong điều kiện 2 pha không trộn lẫn, ta có 0 0 = const, mặt khác trong
điều kiện đẳng nhiệt và đẳng áp P = const; T = const.
Phương trình phân bố Nernst:
C2 = KP = const hay C2 = KP . C1
C1
Câu 3:Hệ số phân bố điều kiện là gì? Cho 2 ví dụ minh hoạ? HDTL:
Trong thực tế chất tan thường có những cân bằng khác ngoài cân bằng phân bố chất tan giữa hai pha làm cho chất tan có nhiều dạng ngoài dạng chiết thông thường.
Hệ số phân bố điều kiện D:
D =
Chc
Cnc
= tổng nồng độ chất phân tích trong pha hữu cơ tổng nồng độ chất phân tích trong pha nước
Ví dụ 1: I2 phân bố qua pha nước và pha hữu cơ, trong trường hợp pha nước có I-, ta có cân bằng sau: I2 + I- = I3-
Vì vậy hệ số phân bố điều kiện là: D =
[I ]
[I 2 ]hc
[I ]
n 3 n
Ví dụ 2: R – COOH là axit hữu cơ có cân bằng: pha nước: R – COOH R – COO- + H+ pha hữu cơ: 2R – COOH (R – COOH)2 hc
với D =
[RCOOH ]hc [(RCOOH ) 2 ]hc
n
n
[RCOOH ] [RCOO ]
D phụ thuộc vào nhiệt độ, pH, phản ứng phụ.
Câu 4:Quá trình hóa học gồm các giai đoạn nào? Thiết lập mối quan hệ giữa các hằng số của các quá trình chiết?
HDTL:
Quá trình chiết là quá trình tổng hợp của nhiều giai đoạn:
* Chuyển tác nhân chiết từ pha hữu cơ sang pha nước hay pha rắn, chính xác hơn là sang bề mặt phân chia giữa hai pha:
Shc Snc K1 =
* Phản ứng giữa tác nhân chiết và chất tan:
[S ]hc
[S ]nc
xS + Na
+ (NO ) {(S
…Na+)NO }
x 3 nc
3
n
nc
K = [(S ...Na )NO ]
nc nc
3 nc x
3 nc
2 [S ]x .[Na ]
.[NO ]
x 3 hc
nc
* Vận chuyển dạng chiết vào pha hữu cơ:
[(S …Na )NO ] [(S
…Na+)NO ]
K =[(S
...Na )NO ]
x 3 nc x
3 hc
3 [(S
... Na . NO ]
3
x
nc
[(S ...Na )NO ]
Thay K2 vào K3 ta có: K3 =
x 3 hc
nc
3
2
nc
nc
K [S]x [Na ] .[NO ]
K [(S ...Na )NO ]
Thay K1 vào K3 ta có: K3 =
1.x 3 hc
hc
3
2
nc
nc
K [S]x [Na ] .[NO ]
Quá trình trên có thể xem như là một phản ứng hoá học và dựa vào định luật tác dụng khối lượng để xác định hằng số chiết. Chất tan NaNO3 đã phản ứng với xeton (S) để đi vào pha hữu cơ. Oxi trong phân tử xeton còn cặp electron có thể liên kết phối trí với Na+ và vì vậy phân tử trở thành tích điện dương và để duy trì phải có NO3- theo kiểu sonvat.
Phản ứng tổng hợp có thể viết như sau:
x(S)nc + (Na+)nc + (NO )nc {(Sx …Na+)NO }hc
3 3
[(S ...Na )NO ]
Kex =
x 3 hc
hc
3
nc
nc
[S]x .[Na ] .[NO ]
Mối liên hệ giữa các hằng số của các quá trình chiết là:
Kex =
K 2 . K3
K1
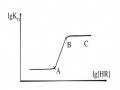
Câu 5:Độ pH có ảnh hưởng đến hệ số phân bố như thế nào? Hãy xây dựng đồ thị biểu diễn sự phụ thuộc phần trăm chiết (E%) vào pH?
HDTL:
Ta xét quá trình chiết phức kim loại Mn+ được tạo thành giữa ion Mn+ với thuốc thử tạo phức HQ bằng dung môi hữu cơ.
Các cân bằng xảy ra trong 2 pha hữu cơ như sau: Phân bố thuốc thử HQ:
HQhc = HQnc (5.1)
DHQ =
[HQ]hc
[HQ]nc
(5.2)
Phân li thuốc thử tạo phức HQ trong pha nước:
HQ + H2O H3O+ + Q- (5.3)
[H O][Q]
K
aHQ =
3 nc
[HQ]
(5.4)
nc
Phản ứng tạo phức: Mn+ + nQ- MQn =
(5.5)
Phân bố phức MQn giữa hai pha:
[MQn ]
[M n][Q]n
MQn (hc) = MQn (nc)
D = [MQn ]hc
(5.6)
HQn
[HQn
]nc
Trong pha hữu cơ chỉ tồn tại một dạng MQn và đại bộ phận phức MQn được chiết lên pha hữu cơ. Nên ta có thể viết hằng số phân bố điều kiện K’D như
sau: K’D =
[MQn ]hc
= [MQn ]hc
nc
nc
(5.7)
[MQn
]nc
[M n]
[M n]
[MQn ]nc << [M ]
nc
nc
Thông thường trong phương pháp chiết, người ta sử dụng lượng thuốc thử tạo phức bao giờ cũng lớn so với nồng độ kim loại. Thuốc thử bao giờ cũng hoà tan tốt trong dung môi hữu cơ nên nồng độ của nó trong pha nước nhỏ. Vậy ta có thể viết [HQ]hc >> [HQ]nc.
Giả thiết rằng, CHQ = [HQ]hc (5.8) Theo định luật phân bố ta có:
[MQn ]nc
= DMQ . [MQn ]nc
(5.9)
n
Theo phân tử (5.5):
[MQn ]nc
= . [M n]
. [Q]n
(5.10)
nc
nc
Thay (5.10) và (5.9):
[MQ ]
= .
D . [M n]
. [Q]n
(5.11)
Thay (5.11) và (5.7):
n hc
MQn
nc nc
.D [M n] [Q]n
n
nc
K’D =
MQn nc nc
nc
[M n]
= .DMQ
[Q]n
(5.12)
3
Ta có:
[Q] =
Ka [HQ]nc [H O]
(5.13)
nc
Thay (5.13) và (5.12):
K’D =
.D
[HQ]n
.K n .nc
(5.14)
3
MQn
a [H
O ]n
Theo (5.2): [HQ]hc = DHQ . [HQ]nc
hay [HQ]nc =
[HQ]hc
DHQ
K n
[HQ]n
(5.15)
K’D =
.D
.a.hc
(5.16)
D
3
MQn n HQ
[H O]n
Các giá trị ,
DMQ ,
DHQ ,
[HQ]hc , K a
coi như bằng const, kí hiệu chung
n
bằng K* K’D = K*.[H3O+]- (5.17)
giả sử Vnc = Vhc theo phương trình D = E
. Vnc
100E
Vhc
D = K* [H3O+]-n =
E
100E
(5.18)
lgE – lg(100 - E) = lgK* + npH
từ (5.17) đồ thị phụ thuộc E% vào pH với độ nghiêng n. Giá trị pH tại đó
E = 50%. kí hiệu pH1/2 (D=1): pH1/2 = -
1 lgK*
n
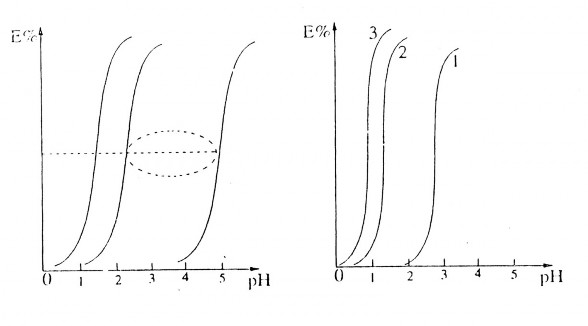
Hình 4.4: Đường cong đặc trưng về sự phụ thuộc phần trăm chiết vào pH
2+ +
Câu 6:Nghiên cứu phản ứng chiết Thori bằng axetyl axeton trong benzen. Trong dung dịch nước chỉ xét sự tồn tại của các dạng phức bậc thấp nhất của Thori: ThX3+; ThX2 ; ThX3 . Không xét đến các phức hiđroxo. Hãy thiết lập hệ số phân bố điều kiện?
HDTL:
Hệ số phân bố điều kiện D có thể viết :
D =
[MX n ]hc
in1
[MX n ]nc [MX i ]nc
i0
Đặt
1 in1 i
và K = 1
Ki[ X
i0
]nc o
D = [MX n ]hc
[M n]
= KD .
1
[M n]
(6.1)
[MX ]
nc
1nc
n nc
[MX
n ]nc .
Phương trình (6.1) chỉ áp dụng ở trường hợp biết nồng độ anion tạo phức X-
.
Ở pH thấp, thuốc thử HX tồn tại chủ yếu ở dạng không phân li HX được chiết lên pha hữu cơ với hệ số phân bố, vì vậy:
[X-]
= Ka [HX ]nc Ka .[HX ]hc
(6.2)
nc
nc
nc [H ]
DHX
[H ]
1in1
K .[HX ] i
a
Ki
hc
(6.3)
i0
DHX [H
]nc
Sau khi biến đổi ta có hệ số phân bố điều kiện:
D
D =
K
MX
K .[H ]n
(6.4)
1DHX nc
..K n .[HX ]n
a nc
Câu 7: Căn cứ vào đâu để phân loại hệ chiết? Hệ chiết được phân thành mấy loại? Cho ví dụ?
HDTL: Dựa vào bản chất hay tính chất chung của các hợp chất có thể chiết, người ta phân thành một số hệ chính sau đây:
* Chiết các chất vô cơ đơn giản, chúng được phân bố giữa 2 tướng theo định luật phân bố.
Ví dụ: I2 được phân bố giữa dung môi hữu cơ (benzen) và dung môi nước.
* Chiết các phức chất dạng vòng càng (chelat). Đây là loại hợp chất được ứng dụng phổ biến nhất để chiết các ion kim loại. Các phối tử tạo phức: 8-oxiquinolin, đithizon, đietyl đithiocacbonat, điphenyl cacbazit… là những phối tử tạo phức vòng càng với các ion kim loại thành các phức chất không mang điện tích và bị chiết lên pha hữu cơ.
* Hệ chiết liên hợp ion: Hợp chất được chiết vào pha hữu cơ là hợp chất hình thành nhờ liên hợp ion. Có 3 kiểu liên hợp:
- Kiểu 1: Ion kim loại tham gia vào thành phần trong đó có hợp chất hữu cơ phức tạp.
Ví dụ: Cu (I) phản ứng với 2,9 - đimetyl phenantrolin mang điện tích hóa trị 1+ nó kết hợp với ion nitrat hay peclorat thành hợp chất trung tính được chiết lên pha hữu cơ (CHCl3) hay ion ZnCl42- kết hợp với 2 ion