1.6.1. Phương pháp vi sóng
Trong phương pháp này, bột graphit thương mại được sử dụng như là một tiền chất ban đầu cho quá trình tổng hợp GO thông qua phương pháp Hummers cải tiến. Nhóm tác giả Youn và cộng sự [95] đã sử dụng phương pháp vi sóng để tổng hợp vật liệu compozit MoS2/graphen cho phản ứng sinh hydro. Mô hình được mô tả trong hình 1.17.
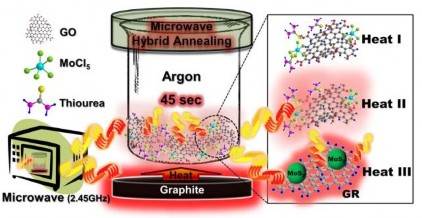
Hình 1.17. Mô hình tổng hợp vật liệu MoS2/GR bằng phương pháp vi sóng [95]
Theo Li và cộng sự [19], quy trình tổng hợp được thực hiện như sau: Trước tiên, GO được cho vào 10 mL dung dịch axit phosphomolybdic 0,02 M, điều chỉnh pH của dung dịch về pH = 7 bằng dung dịch NaOH 1 M. Sau đó cho 10 mL dung dịch thioacetamic 0,72 M vào dung dịch trên và khuấy trong 10 phút để cho quá trình phân tán đồng nhất. Tiếp theo, hỗn hợp được cho vào lò vi sóng tự động (Explorer-48, CEM Co.) và xử lý ở 150oC với nguồn sóng bức xạ là 150 W trong 10 phút. Sau khi lọc, rửa và sấy, thu được compozit MoS2/rGO. Trong quá trình này GO được khử về rGO bằng phương pháp vi sóng trực tiếp có tỷ lệ C/O ![]() 9,12 gần bằng với quá trình khử bằng phương pháp sử dụng tác nhân khử là hydrazin
9,12 gần bằng với quá trình khử bằng phương pháp sử dụng tác nhân khử là hydrazin ![]() ).
).
Phương pháp này có ưu điểm là đơn giản, thời gian ngắn nhưng cần thiết bị vi sóng, nhiệt độ cao và hiệu quả chưa cao.
1.6.2. Phương pháp nhiệt phân
Trong phương pháp này, các tiền chất là (NH4)2MoS4, axit alginic và NH4OH được sử dụng. Quá trình tổng hợp vật liệu được thể hiện trên hình 1.18.
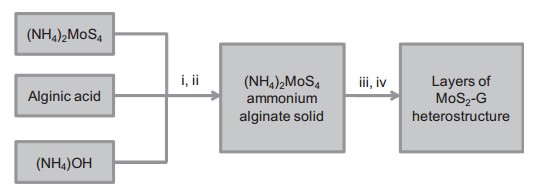
Hình 1.18. Sơ đồ tổng hợp MoS2/rGO theo phương pháp nhiệt phân: (i) hòa tan trong nước, (ii) loại nước, (iii) nhiệt phân dưới dòng Ar ở 900 oC, (iv) thu hồi bột lơ lửng bằng phương pháp siêu âm [96]
Trong quá trình nhiệt phân, axit alginic biến đổi thành dạng graphen và tương tác với MoS2 tạo thành compozit MoS2-graphen. Các phản ứng chính xảy ra trong quá trình là:
(NH4)2MoO4 ![]() MoS3 + 2NH3 + H2S (120 – 260oC) (1.9) MoS3
MoS3 + 2NH3 + H2S (120 – 260oC) (1.9) MoS3 ![]() MoS2 + S (> 800 oC) (1.10)
MoS2 + S (> 800 oC) (1.10)
Ưu điểm của phương pháp này là các lớp graphen được hình thành nhờ quá trình nhiệt phân nguyên liệu ban đầu là axit alginic ít độc hại. Tuy nhiên, phương pháp này có nhược điểm là sử dụng nhiệt độ rất cao (900 oC trong dòng khí Ar) gây tiêu tốn một lượng lớn năng lượng.
1.6.3. Phương pháp thủy nhiệt
Thủy nhiệt là phương pháp đơn giản và được sử dụng rộng rãi trong nhiều quá trình tổng hợp vật liệu. Có hai cách thủy nhiệt để tạo compozit MoS2/rGO. Cách thứ nhất là thủy nhiệt trực tiếp các tiền chất để tạo ra vật liệu compozit, còn cách thứ hai là tạo ra các tiền chất MoS2 và rGO trước rồi sau đó mới tiến hành thủy nhiệt để tạo compozit.
Zhang và cộng sự [6] đã tổng hợp vật liệu compozit MoS2/rGO bằng phương pháp thủy nhiệt từ các tiền chất Na2MoO4.2H2O và thioure ở nhiệt độ 210oC trong 24h. Sản phẩm thu được MoS2/rGO-5 và MoS2/rGO-10 tương ứng với các tỷ lệ GO là 5% và 10%. Quy trình được mô tả trên hình 1.19.
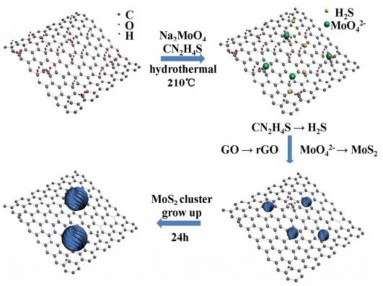
Hình 1.19. Tổng hợp vật liệu compozit MoS2/rGO theo phương pháp thủy nhiệt [97]
Khi Na2MoO4 được đưa vào mạng lưới GO, ion MoO42- sẽ tương tác với các nhóm chức của GO, hình thành các mầm MoS2 trên mạng lưới GO [97]. Sự tương tác này có thể khác với sự có mặt của CTAB (hexadecyltrimethyl ammonium bromide) trong đó CTAB thường sử dụng như là một tác nhân làm cầu nối để vượt qua sự không tương thích về mặt điện tích giữa GO và các anion [98]. Trong quá trình thủy nhiệt, H2S được sinh ra do sự phân hủy của CN2H4S ở 210oC và các mạng lưới GO bị khử thành rGO bởi H2S, nghĩa là ion MoO42-bị chuyển thành MoS2.
Phương pháp này có ưu điểm là đơn giản, hiệu quả nhưng có nhược điểm là thời gian thủy nhiệt dài và cần nhiệt độ cao.
Để có thêm căn cứ lựa chọn phương pháp tổng hợp, diện tích bề mặt riêng của vật liệu compozit MoS2/rGO tổng hợp theo các phương pháp khác nhau đã được thống kê trong bảng 1.1.
Từ bảng 1.1 có thể nhận thấy, trong các phương pháp tổng hợp compozit MoS2/rGO, thủy nhiệt là phương pháp đơn giản nhất, được sử dụng phổ biến nhất và mang lại hiệu quả cao nhất (diện tích bề mặt riêng được cải thiện nhiều nhất). Do đó phương pháp này được lựa chọn để tổng hợp vật liệu compozit MoS2/rGO trong nghiên cứu này.
Bảng 1.1. Diện tích bề mặt riêng của vật liệu MoS2/rGO tổng hợp theo các phương pháp khác nhau
SBET (m2/g) | Điều kiện tổng hợp | Tài liệu | |
MoS2 | 9,42 | Thủy nhiệt, nhiệt độ 180oC và 36h, Na2MoO4.2H2O, NaOH và L-cysteine, GO. | Yi Du và cộng sự [99] |
MoS2/rGO | 74,08 | ||
MoS2 | 2,64 | Vi sóng, nhiệt độ 160oC, 100W và 10 phút, axit photphomolybdic, NaOH, GO và thioacetamide. Nung ở 800oC, 2h trong dòng N2/H2. | Wei Qin và cộng sự [100] |
MoS2/rGO | 42,68 | ||
MoS2 | 14,3 | Thủy nhiệt, nhiệt độ 240oC và 24h, Na2MoO4.2H2O, CTAB và L-cysteine, GO. Nung ở 800oC, 2h trong dòng N2/H2. | Jianbo Ye và cộng sự [101] |
MoS2/rGO | 35,2 | ||
MoS2 | 2,6 | Thủy nhiệt, nhiệt độ 210oC và 24h, Na2MoO4.2H2O, thiourea, GO. | Long Zhang và cộng sự [102] |
MoS2/rGO | 55,8 | ||
MoS2/rGO | 28 | Thủy nhiệt, nhiệt độ 220oC và 24h, Na2MoO4.2H2O và L-cysteine, GO. Nung ở 800oC, 2h trong dòng N2/H2. | Jing Zhou và cộng sự [103] |
MoS2 | 1,57 | Thủy nhiệt, nhiệt độ 200oC và 24h, [NH4]6Mo7O24.4H2O, thioacetamide, GO. | Xiaolu Jiang và cộng sự [104] |
MoS2/rGO | 81,34 | ||
MoS2/rGO | 44,4 | Thủy nhiệt, nhiệt độ 180oC và 24h, [NH4]6Mo7O24.4H2O, thiourea và GO | Haitao Xie và cộng sự [105] |
Có thể bạn quan tâm!
-
![Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]
Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12] -
![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]
Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32] -
![Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]
Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71] -
 Ứng Dụng Làm Xúc Tác Quang Trong Xử Lý Chất Màu Của Mos 2
Ứng Dụng Làm Xúc Tác Quang Trong Xử Lý Chất Màu Của Mos 2 -
 Phương Pháp Hiển Vi Điện Tử Truyền Qua (Tem) Và Kính Hiển Vi Điện Tử Truyền Qua Phân Giải Cao (Hr-Tem)
Phương Pháp Hiển Vi Điện Tử Truyền Qua (Tem) Và Kính Hiển Vi Điện Tử Truyền Qua Phân Giải Cao (Hr-Tem) -
 Phương Pháp Cộng Hưởng Thuận Từ Điện Tử (Epr)
Phương Pháp Cộng Hưởng Thuận Từ Điện Tử (Epr)
Xem toàn bộ 192 trang tài liệu này.
1.7. Biến tính MoS2/rGO bằng kim loại chuyển tiếp
Để cải thiện diện tích bề mặt riêng, làm chậm quá trình tái tổ hợp electron-lỗ trống quang sinh, tăng hoạt tính quang xúc tác của vật liệu MoS2 trong vùng ánh sáng nhìn thấy, bên cạnh việc chế tạo tổ hợp compozit MoS2/rGO, biến tính ion kim loại chuyển tiếp vào vật liệu compozit cũng là một giải pháp để tăng hiệu quả quang xúc tác của vật liệu.
1.7.1. Bản chất quá trình biến tính
Việc chèn các kim loại vào MoS2 là một cách để kích hoạt bề mặt phẳng cơ bản (basal planes surface), làm tăng nồng độ của các vị trí hoạt tính xúc tác [106].
Một mặt, biến tính ion kim loại chuyển tiếp vào vật liệu làm tăng cường các phản ứng chuyển điện tích [4]. Người ta đã được chứng minh rằng các vị trí kim loại hoạt động như một cái bẫy nhận các electron từ vùng hóa trị của các chất bán dẫn, làm ức chế sự tái tổ hợp các điện tích quang sinh tạo ra, giúp cải thiện một cách đáng kể hiệu quả quang xúc tác của vật liệu.
Mặt khác, lý thuyết cho thấy, từ tính trong cấu trúc nano TMDs (transition- metal dichalcogenides) được thể hiện khi biến tính với các kim loại chuyển tiếp khác nhau. Các nhóm nghiên cứu lý thuyết đã chỉ ra rằng, biến tính ion kim loại chuyển tiếp vào MoS2 có thể làm nâng cao tính chất từ của vật liệu [107].
Việc biến tính các kim loại chuyển tiếp vào các vị trí cạnh S (S-edge) của MoS2 có thể làm thay đổi hoạt tính các vị trí cạnh này trong phản ứng sinh hydro, làm cải thiện đáng kể hiệu quả quang xúc tác cũng như mở rộng khả năng ứng dụng vào thực tế của vật liệu.
1.7.2. Các kim loại sử dụng cho quá trình biến tính
Có rất nhiều kim loại chuyển tiếp đã được sử dụng để biến tính chất bán dẫn MoS2 đa lớp dạng 2H trong tự nhiên như Fe, Mn, Ni. Các kim loại chuyển tiếp khác như Co và Ag cũng có thể được sử dụng để biến tính với hiệu quả cao trong lĩnh vực quang xúc tác, nhưng Ag có giá thành cao và Co thì độc hại, nên ít được sử dụng. Thống kê về việc sử dụng kim loại chuyển tiếp để biến tính MoS2/rGO được thể hiện trong bảng 1.2.
Bảng 1.2. Các kim loại chuyển tiếp được sử dụng để biến tính MoS2/rGO
Nhóm tác giả | Phương pháp tổng hợp | Ứng dụng | |
Fe-rGO- MoS2 | Muhammad và cộng sự [108] | - MoS2/rGO thủy nhiệt ở 200oC trong 24h. Fe-rGO-MoS2 thủy nhiệt ở 180oC trong 18h. | - Nâng cao tính chất từ của vật liệu. |
Co(Ni)-biến tính MoS2 | Xiaoyan và cộng sự [109] | Thủy nhiệt ở 200oC trong 24h. | - Xúc tác quang cho quá trình sinh H2. |
Ag biến tính MoS2/rGO | Li và cộng sự [110] | Thủy nhiệt ở 200oC trong 24h. | - Xúc tác quang cho quá trình phân hủy tetracycline đạt 85,5% trong 90 phút với đèn Xenon 300 W. |
Cu biến tính MoS2/rGO | Wang và cộng sự [111] | Thủy nhiệt ở 200oC trong 20h. | - Xúc tác quang cho quá trình sinh H2. |
Mn biến tính MoS2/rGO | Zhang và cộng sự [112] | Thủy nhiệt ở 220oC trong 24h. | - Xúc tác quang cho quá trình sinh H2. |
Zn biến tính MoS2/rGO | Haixia Qian và cộng sự [113] | Thủy nhiệt | - Xúc tác điện hóa cho quá trình sinh H2. |
1.7.3. Cấu trúc vật liệu MoS2 biến tính bởi kim loại chuyển tiếp
Cấu trúc của vật liệu Mn biến tính MoS2 được thể hiện trên hình 1.20 [114].
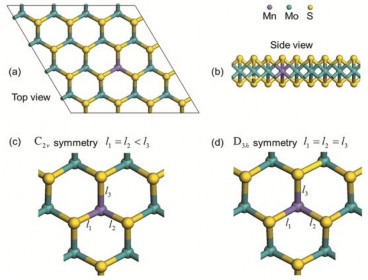
Hình 1.20. (a) Cấu trúc mặt trên và (b) cấu trúc mặt bên của Mn biến tính MoS2 đơn lớp. Cấu trúc nguyên tử của Mn biến tính MoS2 đơn lớp với đối xứng C2v (c) và đối xứng D3h (d) [114]
Để đưa ra cấu trúc này, quá trình tính toán được thực hiện trong một supercell 4x4 của MoS2 đơn lớp với 48 nguyên tử trong đó có 16 nguyên tử Mo và 32 nguyên tử S. Một trong những nguyên tử Mo bị thay thế bằng một kim loại chuyển tiếp. Supercell được điều chỉnh để duy trì một khoảng cách đủ lớn (20 Ao) giữa các đơn lớp liền kề với nhau.
Bên cạnh đó, Haixia Qian và cộng sự [113] cũng đã nghiên cứu đề xuất mô tả cấu trúc vật liệu MoS2/rGO biến tính bởi Zn như thể hiện trên hình 1.21.

Hình 1.21. Cấu trúc của vật liệu Zn-MoS2-RGO [113]
1.7.4. Cơ chế quang xúc tác trên vật liệu biến tính
Cho đến nay, có rất ít công trình công bố về cơ chế quang xúc tác của vật liệu MoS2/rGO biến tính bằng kim loại chuyển tiếp. Chỉ có duy nhất 1 công bố về cơ chế của quá trình quang xúc tác phân hủy tetracycline trên vật liệu MoS2/rGO
được biến tính với Ag của nhóm tác giả Li và cộng sự [110] như thể hiện trên hình 1.22.
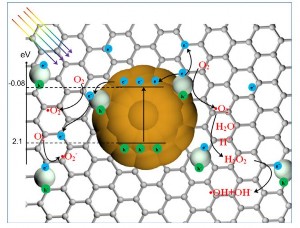
Hình 1.22. Cơ chế của quá trình quang xúc tác trên vật liệu Ag-MoS2/rGO [110]
Đầu tiên, dưới bức xạ vùng ánh sáng khả kiến, các electron quang sinh trong MoS2 được chuyển đến vùng dẫn của MoS2 và nhờ các Ag trên bề mặt rGO vận chuyển đến bề mặt của rGO. Sau đó, các electron quang sinh này phản ứng với O2 để tạo ra gốc O2•-. Các gốc O2•- và h+ trên bề mặt vật liệu sẽ phân hủy tetracycline (TC).
Trong quá trình này, MoS2 và rGO hoạt động như những chất nhận electron làm tăng tốc độ phân tách electron và lỗ trống quang sinh. Khi MoS2 bị kích thích dưới bức xạ vùng ánh sáng khả kiến, electron quang sinh có thể di chuyển đến các Ag, làm hạn chế sự tái tổ hợp electron-lỗ trống quang sinh. Thêm vào đó, các gốc O2•- phản ứng với H2O tạo ra các gốc •OH. Những quá trình này làm cải thiện một cách đáng kể hiệu quả quá trình quang xúc tác của vật liệu.
Như vậy, trong số các kim loại sử dụng để biến tính MoS2/rGO, Mn có giá thành rẻ và không độc hại [112]. Mặt khác, ion Mn2+ và Mo4+ có các bán kính ion gần giống nhau, là một trong những lợi thế cho quá trình biến tính kim loại chuyển tiếp vào mạng lưới MoS2. Hơn nữa, cho đến nay, chưa có công trình nào nghiên cứu về cơ chế quang xúc tác của vật liệu MoS2/rGO biến tính với Mn. Do vậy, trong luận án này, Mn được lựa chọn để nghiên cứu biến tính vào MoS2/rGO nhằm cải thiện hoạt tính quang xúc tác của vật liệu trong vùng ánh sáng khả kiến.

![Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-3-1-120x90.jpg)
![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-4-1-120x90.jpg)
![Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-5-1-120x90.jpg)