nhận là của Dékány [62], với sự chấp nhận logic trong mô hình của Ruess và cấu trúc mạng lưới cacbon của mô hình Scholz–Boehm [63] bằng cách thêm 1,3-ete trong cấu trúc GO để mở rộng mạng lưới cyclohexyl liên kết trans. Mô hình này được minh họa trên hình 1.12.
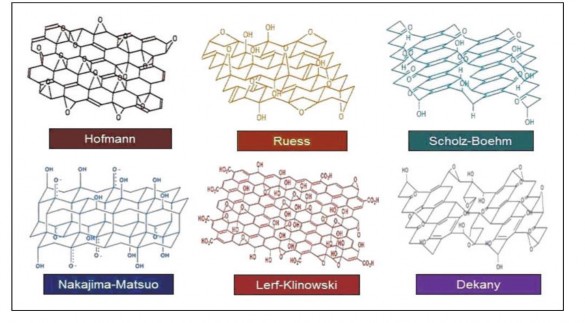
Hình 1.12. Cấu trúc của GO [63]
1.4.2. Tính chất của GO
GO có tính chất ưa nước cao, oxi hóa mạnh và dễ dàng tách lớp trong nước để đạt độ phân tán ổn định [64]. GO cũng phân tán tốt trong nhiều dung môi như etylen glycol (EG), N-metylpyrolidine (NMP), N-N-dimetylformamide (DMF), n- hexan và tetrahydrofuran (THF). Cấu trúc mạng lưới trong GO là các loại liên kết C-C dạng lai hóa sp2 nhưng có một số lượng lớn liên kết C-O dạng lai hóa sp3 (chiếm hơn 55%) do sự có mặt của các nhóm chức chứa oxi [61]. Điều này đã làm giảm độ dẫn điện và hạn chế ứng dụng của vật liệu. Do vậy, để khôi phục lại mạng lưới dạng lai hóa sp2 như cấu trúc so với graphen cũng như độ dẫn điện của vật liệu, các nhóm chức chứa oxi trên bề mặt của GO cần được loại bỏ để tạo thành vật liệu graphen oxit dạng khử (rGO).
1.4.3. Các phương pháp tổng hợp GO
GO được Schafhaeutl tổng hợp lần đầu tiên vào năm 1840 [65] và Brodie tổng hợp vào năm 1859 [66] khi đang khám phá cấu trúc của graphit bằng cách
kiểm tra khả năng phản ứng của vảy graphit (loại graphit đã tinh chế loại bỏ hàm lượng các tạp chất như sắt và lưu huỳnh). Một trong những phản ứng mà Brodie đã thực hiện là thêm KClO3 vào graphit huyền phù trong HNO3 để tổng hợp graphen oxit. Vật liệu thu được chứa hydro, oxy và cacbon nên làm tăng tổng khối lượng của graphit, và có cấu trúc bị biến dạng, kích thước nhỏ, hạn chế về độ dày. Sau bốn phản ứng liên tiếp, quá trình oxy hóa làm tăng hàm lượng oxy đến một giới hạn nhất định. Thành phần C:H:O được tính toán là 61,04:1,85:37,11 với công thức hóa học là C2,19H0,80O1,00. Brodie cũng nhận thấy rằng vật liệu này dễ dàng phân tán trong môi trường nước tinh khiết và không phân tán trong môi trường axit. Tỷ lệ thành phần C:H:O của vật liệu thay đổi thành 80,13:0,58:19,29 khi được đun nóng đến nhiệt độ 220oC do mất CO2 và H2CO3. Cuối cùng, Brodie đã xác định được trọng lượng phân tử của graphit là 33 [66].
Sau đó, vào năm 1898, Staudenmaier đã cải thiện phương pháp tổng hợp của Brodie bằng cách thêm các hợp chất clorat vào phản ứng [67]. Về cơ bản, phương pháp cũng dựa trên cơ sở các quá trình oxi hóa như của Brodie. Tuy nhiên, cả hai phương pháp đều tốn thời gian (1 tuần) và độc hại vì phải bổ sung KClO3. Điều quan trọng là phải loại bỏ được khí ClO2 có khả năng gây nổ bằng cách sử dụng khí trơ. Bên cạnh đó, HNO3 là một tác nhân oxi hóa mạnh dùng để phản ứng với bề mặt cacbon thơm của GO, dẫn đến hình thành các nhóm chức như cacboxyl, keton và lacton. Quá trình oxi hóa GO bằng HNO3 có thể giải phóng ra các khí NO2 hoặc N2O4 ở dạng hơi màu vàng như đã xác định trong phương pháp Brodie [68]. Tương tự, KClO3 cũng là một tác nhân oxi hóa mạnh, là nguồn để sản xuất dioxygen hoạt động như các tác nhân phản ứng và trong quá trình phản ứng cũng tạo khí ClO2 gây nổ. Do đó, phương pháp này chỉ được sử dụng ở quy mô phòng thí nghiệm.
Sau Staudenmaier, hai nhà hóa học từ Viện nghiên cứu công nghiệp Mellon (Mellon Institution of Industrial Research) là Hummer và Offeman đã phát triển một phương pháp thay thế để tổng hợp GO [69]. GO được tổng hợp bằng cách oxi hóa graphit với hỗn hợp H2SO4 khan, KMnO4 và NaNO3. Phản ứng xảy ra khi một hỗn hợp của KMnO4 đóng vai trò như một tác nhân oxi hóa mạnh kết hợp với H2SO4 (phương trình 1.4). Trong đó, Mn2O7 là tác nhân chính cho quá trình oxi hóa
Có thể bạn quan tâm!
-
 Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 2
Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 2 -
![Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]
Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12] -
![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]
Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32] -
![Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]
Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95] -
 Ứng Dụng Làm Xúc Tác Quang Trong Xử Lý Chất Màu Của Mos 2
Ứng Dụng Làm Xúc Tác Quang Trong Xử Lý Chất Màu Của Mos 2 -
 Phương Pháp Hiển Vi Điện Tử Truyền Qua (Tem) Và Kính Hiển Vi Điện Tử Truyền Qua Phân Giải Cao (Hr-Tem)
Phương Pháp Hiển Vi Điện Tử Truyền Qua (Tem) Và Kính Hiển Vi Điện Tử Truyền Qua Phân Giải Cao (Hr-Tem)
Xem toàn bộ 192 trang tài liệu này.
graphit như được thể hiện trong phương trình 1.5. Mn2O7 là tác nhân bền có thể phản ứng trong thời gian dài với nhiệt độ tăng lên đến 55oC [69].
KMnO4 + H2SO4 → K+ + MnO3+ + H3O+ + 3HSO4- (1.4) MnO3+ + MnO4- → Mn2O7 (1.5)
Phương pháp này cho thời gian phản ứng ngắn hơn rất nhiều và sản phẩm cuối cùng có độ oxi hóa cao hơn phương pháp của Staudenmaier. Điều này cho thấy sản phẩm GO phụ thuộc đáng kể vào các tác nhân oxi hóa, nguồn graphit và điều kiện phản ứng.
Một số tác nhân oxi hóa khác cũng được sử dụng cho quá trình tổng hợp GO như hỗn hợp H2SO4/H3PO4 được sử dụng để oxi hóa graphit [70]. Phản ứng của graphit với KMnO4 trong hỗn hợp H2SO4/H3PO4 (9/1) cho phép tạo GO với mức độ oxi hóa cao.
Các phương pháp hóa học được sử dụng để tổng hợp GO có thể tóm tắt như mô tả trên hình 1.13.

Hình 1.13. Các phương pháp tổng hợp GO sử dụng graphit, axit và các tác nhân oxi hóa hóa học [71]
Trong số các phương pháp này, mặc dù việc dùng tác nhân NaNO3 theo phương pháp Hummers sẽ có bất lợi là tạo ra khí NO2 độc hại, nhưng phương pháp này vẫn được sử dụng khá phổ biến vì có nhiều ưu điểm như có thể điều khiển mức độ oxi hóa trên các mặt phẳng (basal plane) và các cạnh (sheet edges) của các tấm
graphit nhờ điều chỉnh kích thước tinh thể của tiền chất graphit. Bên cạnh đó, việc bổ sung NaNO3 trong quá trình tổng hợp GO cũng làm tăng cường quá trình oxi hóa trên các mặt phẳng của các tấm graphit. Chính điều này là nguyên nhân làm vỡ các tấm graphit theo dọc trục a là trục trong các mặt phẳng lớp cacbon (a-axis in the carbon layer planes) và đồng thời bóc tách ra các tấm graphit dọc theo trục c là trục vuông góc với các lớp cacbon (c-axis perpendicular to the carbon layers).
Bên cạnh đó, ion nitrat kết hợp với ion hydro tạo ra axit nitric là chất có khả năng oxi hóa mạnh. Hai tác nhân axit nitric và axit sunfuric sẽ phản ứng với graphit để chèn các nguyên tử oxy vào trong graphit (phương trình 1.6 và 1.7), còn KMnO4 cũng oxi hóa các nguyên tố cacbon để tạo ra graphen oxit và oxysulfide (phương trình 1.8) [72].
NaNO3 + H2SO4 → NaHSO4 + HNO3 (1.6)
6nH2SO4 + 2nGraphit + n[O] → nH2O + 2n[Graphit+.HSO4-.2H2SO4]n (1.7) MnO4- +2H+ + SO42- + [Graphit+.HSO4-.2H2SO4] → Mn2+ + SOx + H2O + GOy (1.8)
Chính các yếu tố này đã giúp cải thiện chất lượng graphen cũng như mở rộng các ứng dụng của nó [56].
1.5. Vật liệu graphen oxit dạng khử (rGO)
1.5.1. Cấu trúc vật liệu rGO
Graphen oxit dạng khử (rGO) có mức độ lai hóa sp2 cao hơn so với graphen oxit (GO), dẫn đến các tính chất như độ dẫn điện, diện tích bề mặt riêng... cũng cao hơn nhiều so với GO. rGO có cấu trúc gần giống với graphen nhưng trên bề mặt vật liệu vẫn còn có một số nhóm chức chứa oxi dạng cacbonyl và ete do chúng chỉ có thể loại bỏ được khi phá hủy cấu trúc mặt phẳng vật liệu. Hơn thế nữa, trên rGO còn có các vị trí defect gọi là Stone-Wales (cặp heptagons và pentagons) cũng như các lỗ hổng do mất cacbon dưới dạng CO và CO2 trong quá trình khử [73] (hình 1.14).
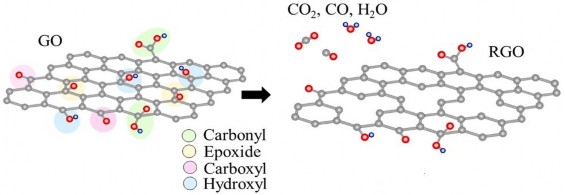
Hình 1.14. Quá trình khử GO về rGO [74]
Chính điều này làm tăng khả năng hoạt động và mở rộng ứng dụng của vật liệu trong các lĩnh vực cần các tính chất tương tự của graphen, đặc biệt là lĩnh vực hấp phụ và xúc tác.
1.5.2. Các phương pháp tổng hợp rGO
1.5.2.1. Phương pháp khử nhiệt
Quá trình khử nhiệt có thể tiến hành theo 2 phương pháp:
- Phương pháp ủ: thực hiện tách lớp GO ở nhiệt độ 2000oC trong vòng 1 phút [75]. Cơ chế hình thành rGO được có thể được giải thích như sau: khi gia nhiệt với tốc độ rất lớn (2000ºC/phút), CO và CO2 có trong các lớp GO chịu sự giãn nở đột ngột dẫn đến làm tăng khoảng cách giữa các lớp GO. Thêm vào đó, sự phân hủy các nhóm chứa oxy cũng tạo ra áp suất cao, thắng lực liên kết Vanderwaals của các liên kết trong vật liệu, làm tách các lớp GO. Tuy nhiên, phương pháp này chỉ cho phép tạo ra các tấm rGO kích thước nhỏ và không phẳng. Việc sử dụng nhiệt độ rất cao cũng hạn chế ứng dụng của phương pháp, chỉ thực hiện trên quy mô nhỏ.
- Phương pháp khử vi sóng và quang: sử dụng nguồn nhiệt bức xạ vi sóng (MWI - microwave irradiation) [76] và bức xạ quang [77]. Ưu điểm của phương pháp MWI là làm nóng các chất đồng đều và nhanh chóng. Bằng cách xử lý nhiệt GO trong lò vi sóng thông thường, có thể nhanh chóng thu được rGO trong vòng 1 phút. Khử quang có thể thực hiện với đèn flash đơn có năng lượng photon phát ra ở khoảng cách gần (< 2mm, 1J/cm2) cho phép gia nhiệt lên đến trên 100oC, dẫn tới xảy ra phản ứng khử GO. Nhờ quá trình khử khí nhanh, các lớp GO có thể được mở rộng tới hàng chục lần và hình thành rGO với độ dẫn điện tăng đến 10 S/cm.
1.5.2.2. Phương pháp khử hóa học
Quá trình có thể được thực hiện theo 4 phương thức:
- Khử điện hóa: bản chất là quá trình trao đổi điện tử giữa GO và chất điện phân [78]. Hướng đầu tiên, quá trình khử điện hóa một bước từ dung dịch huyền phù của GO với sự có mặt của chất điện phân tạo ra rGO trên bề mặt của điện cực. Hướng thứ hai, quá trình được thực hiện một hoặc hai bước với màng mỏng GO đặt trên đế của điện cực (thủy tinh, plastic, tổ hợp oxyt indium-thiếc ITO...) để tạo ra điện cực bọc GO, sau đó tiến hành khử điện hóa trong hệ thống ba điện cực chuẩn tạo rGO [79]. Phương pháp này thân thiện với môi trường và có thể kiểm soát được, nhưng không cho phép sản xuất rGO với khối lượng lớn.
- Khử quang xúc tác: GO có thể được khử bằng các phản ứng quang hóa với sự hỗ trợ của các chất xúc tác quang như TiO2. Gần đây, William và cộng sự [80] đưa ra quá trình khử GO về rGO ở trạng thái keo với xúc tác TiO2 dưới vùng ánh sáng UV. Khi tiến hành chiếu xạ tia UV, sự phân tách điện tích xảy ra trên bề mặt các hạt TiO2. Với sự có mặt của etanol, các lỗ trống được quét để tạo ra các gốc etoxy, làm cho các electron tích tụ bên trong các hạt TiO2. Các electron này sẽ tương tác với các tấm GO để khử các nhóm chức chứa oxy. Trước khi khử, các nhóm cacboxyl trong các tấm GO có thể tương tác với các nhóm hydroxyl trên bề mặt của TiO2 bằng cách trao đổi điện tích, tạo ra kết nối giữa các hạt TiO2 và các tấm GO. Các tấm rGO đóng vai trò như một chất thu nhận và vận chuyển điện tích để tạo điều kiện cho quá trình phân tách của electron-lỗ trống trong một số thiết bị quang điện như thiết bị quang xúc tác [81] và pin mặt trời nhạy quang [82]. Ngoài ra, một số vật liệu khác có hoạt tính quang xúc tác như ZnO [83] và BiVO4 [84] cũng được sử dụng cho quá trình khử GO.
- Khử nhiệt dung: quá trình thực hiện trong môi trường kín nên khi gia nhiệt, nhiệt độ sôi của dung môi có thể cao hơn bình thường nhờ việc tăng áp suất [85]. Dubin và cộng sự [86] đã đưa ra phương pháp khử nhiệt dung sử dụng dung môi N- metyl-2-pyrolidinone (NMP). Quá trình tách oxy của GO được thực hiện bằng sự kết hợp giữa ủ nhiệt với dung môi NMP ở nhiệt độ cao. rGO thu được có độ dẫn điện 3,74 S/cm nhỏ hơn so với khi dùng dung môi hydrazin (82,8 S/cm). Ưu diểm
của phương pháp này là tạo ra các tấm rGO có sự phân tán ổn định, có giá trị ứng dụng cao.
- Khử bằng các tác nhân hóa học: bản chất quá trình là dựa trên phản ứng hóa học của các tác nhân này với GO. Thông thường quá trình khử được thực hiện ở nhiệt độ phòng hoặc nhiệt độ vừa phải. Do đó, yêu cầu về thiết bị và môi trường không đòi hỏi cao như ở phương pháp ủ nhiệt, làm cho quá trình này có thể được thực hiện dễ dàng và đơn giản hơn, chi phí cũng rẻ hơn, cho phép quá trình sản xuất với số lượng lớn. Có nhiều tác nhân hóa học được sử dụng cho quá trình khử này, bao gồm hydrazin, dimetylhidrazin, hydrazin hydrat, natri hydride, natri borohydride (NaBH4), liti nhôm hydride, HI, hydroquinon, axit citric, KOH, NaOH, hydroxylamin, ure, thiourea... Trong đó, chất khử NaBH4 có hiệu quả hơn hydrazin cho quá trình khử GO về rGO [87]. Mỗi tác nhân có hoạt tính với một nhóm chức nhất định. Hydrazin có hoạt tính mạnh với các nhóm chức epoxy và axit cacboxylic còn NaBH4 có hiệu quả nhất cho quá trình khử nhóm cacbonyl [88], tuy nhiên không khử được nhóm ancol. Gần đây, theo nghiên cứu của Pei và cộng sự [89], HI được xem là chất khử có hiệu quả cho quá trình khử GO. Ion I- có hoạt tính mạnh với các nhóm epoxy và hydroxyl trên GO. Tuy nhiên, các chất khử này độc và khả năng gây nổ cao khi sử dụng, cần có biện pháp phòng ngừa an toàn khi sử dụng với số lượng lớn.
Do đó, xu hướng hiện nay là phải sử dụng các tác nhân thân thiện với môi trường, hiệu quả cao cho quá trình khử GO về rGO. Các chất khử được quan tâm hiện nay, đó là axit ascorbic, bột nhôm, axit amin, Na2CO3, caffeine...[55]. Nhóm tác giả Vũ Thị Thu Hà - Viện Hóa học Công nghiệp Việt Nam đã sử dụng tác nhân khử xanh là caffeine để khử GO về rGO [90]. Kết quả cho thấy sau quá trình khử, tỷ lệ nguyên tố C/O tăng từ 1,96 (GO) lên đến 6,5 (rGO). Theo nghiên cứu của Fernandez-Merino và cộng sự [91], sản phẩm rGO của quá trình khử bằng axit ascorbic có tỷ lệ C/O khoảng 12,5 và độ dẫn điện là 77 S/cm tương đương với rGO thu được từ quá trình sử dụng chất khử là hydrazin. Ngoài ra, axit ascorbic còn có lợi thế là không độc hại, có độ ổn định hóa học cao với nước (trong khi NaBH4 ít ổn định hóa học trong nước), an toàn và tránh được sự kết tụ của các tấm rGO so với khi khử bằng hydrazin. Trong quá trình khử bằng axit ascorbic, các nhóm chức
chứa oxy phần lớn được loại khỏi GO chủ yếu ở dạng khí CO2 thoát ra. Đồng thời axit ascorbic bị oxi hóa thành axit dehydroascorbic, axit guluronic, axit oxalic, cuối cùng là CO2 và H2O [92]. Quá trình khử GO về RGO bằng tác nhân axit ascorbic được minh họa trên hình 1.15.
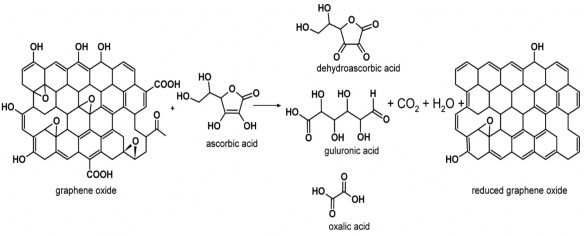
Hình 1.15. Sơ đồ quá trình khử GO về rGO bằng tác nhân khử axit ascorbic [93]
Với những đặc tính ưu việt như vậy, trong luận án này, axit ascorbic được lựa chọn làm tác nhân khử cho quá trình khử GO về rGO. Đây được xem như là một hướng thay thế lí tưởng đối với các chất khử độc hại như hydrazin.
1.6. Các phương pháp chế tạo vật liệu compozit MoS2/rGO
Các tổ hợp compozit trên cơ sở các vật liệu 2D như MoS2, graphen hay rGO có cấu trúc lai hóa như thể hiện trên hình 1.16 [94].
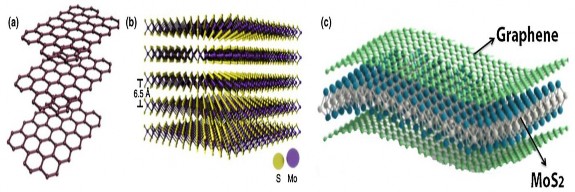
Hình 1.16. Mô hình của vật liệu graphen (a), MoS2 (b) và compozit MoS2/rGO (c) [94]
Để chế tạo tổ hợp compozit này, có thể sử dụng nhiều phương pháp khác nhau như vi sóng, nhiệt phân, thủy nhiệt.


![Cơ Chế Quang Xúc Tác Của Vật Liệu Biến Tính [12]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-3-1-120x90.jpg)
![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-4-1-120x90.jpg)
![Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-6-1-120x90.jpg)