4. Nội dung và phương pháp nghiên cứu
- Tổng hợp vật liệu: tổng hợp GO bằng phương pháp Hummers, tổng hợp rGO bằng phương pháp khử với tác nhân axit ascorbic kết hợp quá trình xử lý ở nhiệt độ cao, tổng hợp MoS2 và biến tính với Mn bằng phương pháp nung, tổng hợp MoS2/rGO và Mn-MoS2/rGO bằng phương pháp thủy nhiệt. Một số yếu tố ảnh hưởng đến quá trình tổng hợp vật liệu như nhiệt độ thủy nhiệt và tỉ lệ thành phần được nghiên cứu.
- Đặc trưng cấu trúc vật liệu: các vật liệu được đặc trưng bằng các phương pháp hóa lý hiện đại như: XRD, IR, EDX, SEM, TEM, HR-TEM, ICP, UV-Vis, UV-Vis DRS, BET, EPR, EIS, XPS.
- Đánh giá hoạt tính quang xúc tác của vật liệu: vật liệu được thử nghiệm hoạt tính quang xúc tác phân hủy RhB trong vùng ánh sáng khả kiến. Các yếu tố ảnh hưởng đến hiệu suất phân hủy RhB như nồng độ đầu của dung dịch RhB, pH, cường độ chiếu sáng được khảo sát. Khả năng tái sử dụng chất xúc tác và các yếu tố ảnh hưởng đến cơ chế của phản ứng quang xúc tác của vật liệu cũng được nghiên cứu.
5. Ý nghĩa khoa học và thực tiễn của luận án
Ý nghĩa khoa học: luận án đã có những đóng góp mới vào các nghiên cứu về cải thiện hoạt tính quang xúc tác của MoS2 trong vùng ánh sáng khả kiến và quá trình quang xúc tác phân hủy RhB trong môi trường nước trên tổ hợp Mn- MoS2/rGO.
Ý nghĩa thực tiễn: các kết quả nghiên cứu của luận án có thể ứng dụng để triển khai xử lý RhB trong môi trường nước bằng quá trình quang phân hủy dưới ánh sáng mặt trời, với sự có mặt của xúc tác Mn-MoS2/rGO.
6. Điểm mới của luận án
Đã sử dụng phương pháp nung trong môi trường khí trơ để tổng hợp được vật liệu MoS2 và Mn-MoS2 từ tiền chất amonimolipdat, thioure và mangan axetat.
Đã xác định được các điều kiện thích hợp để tổng hợp vật liệu compozit MoS2/rGO và vật liệu biến tính Mn-MoS2/rGO có khả năng quang xúc tác trong vùng ánh sáng khả kiến.
Có thể bạn quan tâm!
-
 Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 1
Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 1 -
 Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 2
Nghiên cứu tổng hợp, đặc trưng xúc tác MoS2/rGO biến tính với Mn và ứng dụng cho quá trình quang phân hủy rhodamine B trong vùng ánh sáng khả kiến - 2 -
![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]
Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32] -
![Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]
Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71] -
![Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]
Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]
Xem toàn bộ 192 trang tài liệu này.
Đã xác định được các điều kiện thích hợp cho quá trình quang xúc tác phân hủy RhB trên hệ xúc tác MoS2/rGO và Mn-MoS2/rGO trong vùng ánh sáng khả kiến. Với tổ hợp Mn-MoS2/rGO, hiệu quả quang xúc tác phân hủy RhB đạt 90% sau 4 giờ phản ứng dưới ánh sáng nhìn thấy, cao hơn nhiều so với các hệ xúc tác khác.
CHƯƠNG 1. TỔNG QUAN LÝ THUYẾT
1.1. Quá trình quang xúc tác
1.1.1. Khái niệm quang xúc tác
Trong hóa học, quang xúc tác được dùng để chỉ những phản ứng xảy ra dưới tác dụng đồng thời của chất xúc tác và ánh sáng. Đây là một trong những quá trình phản ứng mà xúc tác hoạt động nhờ tác động của ánh sáng, và được ứng dụng rộng rãi, đặc biệt trong xử lý môi trường. Các xúc tác quang được sử dụng thường là trên cơ sở các vật liệu bán dẫn.
Theo lí thuyết vùng, cấu trúc điện tử của kim loại gồm có một vùng hóa trị (Valance band-VB), gồm những obitan phân tử liên kết được xếp đủ electron, và một vùng dẫn (Condutance band-CB), gồm những obitan phân tử liên kết còn trống electron. Hai vùng này được chia cách nhau bởi một hố năng lượng, gọi là vùng cấm, đặc trưng bởi năng lượng vùng cấm Eg (Band gap energy), chính là độ chênh lệch năng lượng giữa hai vùng nói trên. Sự khác nhau giữa vật liệu dẫn điện, cách điện và bán dẫn chính là sự khác nhau về vị trí và năng lượng vùng cấm. Vật liệu bán dẫn là vật liệu có tính chất trung gian giữa vật liệu dẫn điện và vật liệu cách điện. Khi có một kích thích đủ lớn (lớn hơn năng lượng vùng cấm Eg), các electron trong vùng hóa trị của vật liệu bán dẫn có thể vượt qua vùng cấm nhảy lên vùng dẫn, trở thành chất dẫn điện có điều kiện [7],[8].
1.1.2. Cơ chế quang xúc tác
Khi vật liệu bán dẫn được chiếu sáng với năng lượng photon (hν) thích hợp, lớn hơn hoặc bằng năng lượng vùng cấm Eg (hν ≥ Eg), các electron (e-) sẽ được chuyển lên vùng dẫn (quang electron) và lỗ trống (h+) sẽ hình thành ở vùng hóa trị [9]. Dưới tác dụng của ánh sáng, cơ chế quang xúc tác trên chất bán dẫn sẽ xảy ra qua các quá trình sau (hình 1.1):
+ Vật liệu bán dẫn hấp thụ năng lượng ánh sáng mặt trời tạo thành cặp electron - lỗ trống quang sinh (1):
CB
C (chất bán dẫn) + hν e+
h(1.1)
VB
+ Quá trình di chuyển cặp electron - lỗ trống quang sinh lên bề mặt chất bán dẫn (2);
+ Quá trình tái kết hợp cặp electron - lỗ trống quang sinh bên trong (vùng hóa trị - vùng dẫn) và trên bề mặt chất bán dẫn (3 và 6);
+ Quá trình tạo các gốc tự do bởi electron và lỗ trống quang sinh (4 và 5).
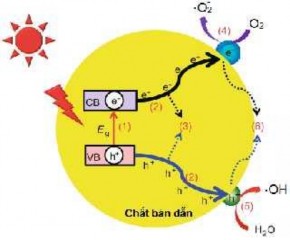
Hình 1.1. Cơ chế xúc tác quang của chất bán dẫn [10]
Các electron - lỗ trống quang sinh di chuyển đến bề mặt và tương tác với một số chất bị hấp thụ như nước và oxy, tạo ra những gốc tự do trên bề mặt chất bán dẫn theo cơ chế [11]:
h
2
VB
H O HOH (1.2)
eO hO
(1.3)
CB 2 2
2
Các gốc tự do HO•, Ođóng vai trò quan trọng trong cơ chế quang phân hủy
các hợp chất hữu cơ khi tiếp xúc. Sản phẩm của quá trình phân hủy chất hữu cơ gây ô nhiễm là CO2, H2O và các chất vô cơ khác.
Tuy nhiên, chất bán dẫn có nhược điểm lớn nhất là sự tái kết hợp giữa electron
- lỗ trống quang sinh nhanh nên làm giảm hiệu quả của quá trình quang xúc tác của vật liệu. Để khắc phục nhược điểm này, xu hướng hiện nay thường ghép các chất bán dẫn với một nguyên tố khác (vật liệu xúc tác quang biến tính), hay phủ lên nó một chất khác (tạo vật liệu compozit). Quá trình này làm cải thiện đáng kể khả năng quang xúc tác của vật liệu nhờ "bẫy electron". Cơ chế của quá trình này được thể hiện trên hình 1.2.
Khi chất bán dẫn được chiếu xạ ánh sáng có Ehν ≥ Eg, các electron tách khỏi vùng hóa trị nhảy lên vùng dẫn tạo nên các cặp electron - lỗ trống quang sinh. Nhưng khác với các chất bán dẫn đơn, electron quang sinh trên vùng dẫn ở chất bán
6
dẫn A, thay vì trở lại vùng hóa trị kết hợp với lỗ trống quang sinh (như chất bán dẫn đơn), chúng lại nhảy sang vùng dẫn của chất bán dẫn B, hay nhảy vào các tâm bẫy electron (các vị trí defects đối với dạng vật liệu biến tính). Điều này làm giảm khả năng tái tổ hợp giữa electron - lỗ trống quang sinh, tạo ra càng nhiều gốc tự do có tính oxi hóa mạnh làm tăng hiệu quả của quá trình quang xúc tác của vật liệu.
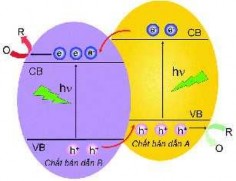
Hình 1.2. Cơ chế quang xúc tác của vật liệu biến tính [12]
Trong những năm gần đây các vật liệu bán dẫn làm xúc tác quang đã được nghiên cứu rộng rãi trong lĩnh vực xử lý ô nhiễm môi trường và tạo nguồn năng lượng sạch. Trong số đó, TiO2 và các oxit kim loại chuyển tiếp có cấu hình electron d0 và oxit kim loại điển hình có cấu hình electron d10 được nghiên cứu sâu nhất. You-Ji và cộng sự [13] dùng xúc tác nano tinh thể TiO2-zeolit để phân hủy RhB. Changchun và cộng sự [14] sử dụng xúc tác ZnO để phân hủy metyl da cam. Nhiều vật liệu khác được sử dụng làm chất xúc tác quang như SrO2 (Neppolian Choi và cộng sự [15]), ZrO2, CdS, SrTiO3 (Shuang và cộng sự [16]) và ZnS (Alemseged và cộng sự [17]) để loại bỏ các loại thuốc nhuộm khác nhau trong nước thải [18]. Tuy nhiên, các loại xúc tác này có vùng năng lượng vùng cấm lớn chỉ hoạt động trong vùng ánh sáng UV nên bị giới hạn ứng dụng vào trong thực tế do nguồn ánh sáng mặt trời chiếm đến 45% vùng ánh sáng khả kiến [19]. Trong khi đó, những năm gần đây, MoS2 đang thu hút dược sự quan tâm nghiên cứu của các nhà khoa học nhờ những đặc tính ưu việt như năng lượng vùng cấm hẹp (từ 1,2 eV (đối với MoS2 đa lớp) đến 1,97 eV (MoS2 đơn lớp)), có khả năng hấp thụ mạnh ánh sáng mặt trời, không độc hại và thân thiện với môi trường [20]. Chính vì vậy, với mong muốn chế tạo được tổ hợp quang xúc tác có khả năng làm việc tốt trong vùng ánh sáng khả kiến để tận dụng nguồn năng lượng ánh sáng mặt trời, MoS2 được lựa chọn nghiên cứu trong luận án này.
1.2. Vật liệu molypden disunfua (MoS2)
1.2.1. Cấu trúc của MoS2
MoS2 có cấu trúc tinh thể bao gồm các liên kết yếu S-Mo-S, trong đó lớp nguyên tố Mo nằm xen giữa hai lớp nguyên tố S. Tinh thể MoS2 có các lớp xếp chồng lên nhau và tương tác với nhau bằng lực liên kết yếu Vanderwaals như thể hiện ở hình 1.3. Các lớp này có thể tách ra thành các đơn lớp MoS2 bằng phương pháp vi cơ và kỹ thuật tách lớp trong pha lỏng [21].
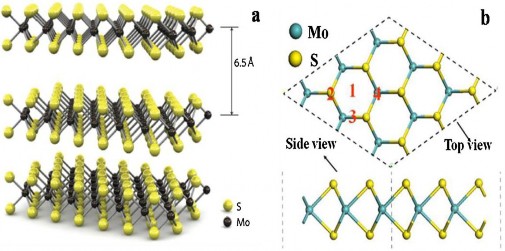
Hình 1.3. (a) Cấu trúc không gian 3 chiều của MoS2 và (b) Cấu trúc MoS2 đơn lớp [21]
Từ hình 1.3a có thể thấy mỗi lớp đơn MoS2 có độ dày khoảng 6,5 Ao. Hình 1.3b cho thấy một đơn vị cấu trúc cơ bản của MoS2 sắp xếp với nhau theo hình lục giác. Liên kết Mo-S có độ dài 2,42 Ao với hằng số mạng thích hợp của đơn lớp MoS2 là 3,18 Ao.
Cấu trúc tinh thể của MoS2 phân ra ba pha: 1T-MoS2, 2H-MoS2 và 3R-MoS2
[22] được thể hiện trên hình 1.4.
Các pha này khác nhau bởi kiểu phối trí của các nguyên tử lưu huỳnh xung quanh nguyên tử Mo và trật tự sắp xếp mỗi lớp. Trong số các pha này, chỉ có pha 2H và 3R bền và tồn tại trong tự nhiên. Cả hai pha này đều có kiểu phối trí lăng trụ hình tam giác và khác nhau về trình tự sắp xếp các lớp Mo-S-Mo dẫn đến sự khác nhau về nhóm không gian.
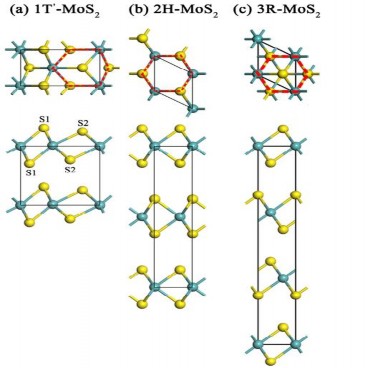
Hình 1.4. Mô hình cấu trúc đa tinh thể của MoS2 [22]
Trong pha 1T, sáu nguyên tử S phối trí bát diện xung quanh nguyên tử Mo để thành ô cơ sở. Trong pha 2H, mỗi nguyên tử Mo chiếm các vị trí lăng trụ tam giác được bao quanh bởi sáu phối tử S sắp xếp kiểu lăng trụ hình tam giác với hai đơn vị S-Mo-S trong một ô cơ sở. Còn ở pha 3R cũng có kiểu sắp xếp lăng trụ tam giác tương tự pha 2H nhưng tồn tại 3 đơn vị S-Mo-S trong mỗi ô cơ sở dọc theo trục c của mạng. Cả hai pha 2H và 3R đều có các kích thước tinh thể tương đồng với khoảng cách từ nguyên tử Mo đến nguyên tử S gần nhất khoảng 2,41Ao [22].
1.2.2. Ứng dụng của MoS2
MoS2 có năng lượng vùng cấm lý tưởng, khiến nó được sử dụng trong các thiết bị chuyển mạch và quang điện thế hệ mới [23],[24].
MoS2 còn đóng vai trò quan trọng trong nhiều lĩnh vực như sản xuất hydro, lưu trữ và chuyển hóa năng lượng, xúc tác môi trường, sinh hydro [24].
1.2.3. Các phương pháp tổng hợp MoS2
Nhiều phương pháp đã được áp dụng trong nghiên cứu tổng hợp MoS2, nhưng nhìn chung có thể tạm chia thành hai nhóm: các phương pháp vật lý và các phương pháp hóa học.
Các phương pháp vật lý bao gồm các kỹ thuật năng lượng cao như siêu âm plasma, bào cắt bằng xung laser, tẩy bằng hồ quang điện, … Vollath và các cộng sự
[25] đã thành công trong việc tổng hợp MoS2 bằng phản ứng giữa tiền chất hexacacbonyl Mo(CO)6 và H2S trong khí trơ argon theo phương pháp siêu âm plasma. Việc tổng hợp MoS2 có độ tinh khiết cao 98% bằng kỹ thuật bóc tách xung laser đã được thực hiện bởi nhóm của Parrilla [26]. Tuy nhiên các cấu trúc nano thu được bằng các phương pháp này thường thưa thớt và dễ kết tụ làm giảm diện tích bề mặt của vật liệu và ngăn cản các quá trình phân tán hoặc chức năng hóa bề mặt.
Các phương pháp hóa học thường được áp dụng rộng rãi hơn như: bốc bay hóa học các hợp chất cơ kim, nung và phân hủy nhiệt, thủy nhiệt hoặc siêu âm hóa học. Ở trong nước, MoS2 được tổng hợp bằng phương pháp hóa học với sự có mặt của HCl và nhiệt phân trong lò ngưng tụ hơi hóa học (CVD) theo nghiên cứu của nhóm tác giả Lê Văn Thăng và cộng sự [27].
Trong các phương pháp trên thì phương pháp đơn giản nhất để tổng hợp MoS2 là nung các tiền chất là muối amoni molypdat và thiourea trong môi trường khí nitơ. Do đó, phương pháp này được lựa chọn để tổng hợp MoS2.
1.3. Vật liệu graphen
Để giảm thiểu tốc độ tái tổ hợp electron - lỗ trống quang sinh trong quá trình quang xúc tác của vật liệu bán dẫn, một số vật liệu có thể sử dụng để tạo tổ hợp compozit với MoS2, ví dụ, graphen [6], g-C3N4 [28] hay các chất bán dẫn khác (TiO2 [29], ZnO [30])... Trong nghiên cứu này, graphen được lựa chọn do có cấu trúc 2D gần giống với cấu trúc của MoS2 và một số đặc tính ưu việt khác như phân tích dưới đây.
1.3.1. Cấu trúc của graphen
Kể từ khi được phát hiện bởi nhà khoa học Novoselov và cộng sự [31], graphen đã thu hút các nhà nghiên cứu ngày càng lớn bởi các tính chất vật lý rất hấp dẫn của nó. Graphen là một loại vật liệu điển hình có cấu trúc hai chiều (2D), nó được tách từ vật liệu graphit (3D). Cấu trúc của graphit gồm nhiều lớp được xếp chồng lên nhau với khoảng cách giữa các lớp là 3,34 Ao. Lớp các hydrocacbon



![Tinh Thể Graphit (A), Dạng 3D Của Các Tấm Graphen Trong Mạng Lưới Graphit (B) Và Sự Phân Cấp Của Các Hydrocacbon Thơm Từ Benzen Đến Graphen [32]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-4-1-120x90.jpg)
![Các Phương Pháp Tổng Hợp Go Sử Dụng Graphit, Axit Và Các Tác Nhân Oxi Hóa Hóa Học [71]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-5-1-120x90.jpg)
![Mô Hình Tổng Hợp Vật Liệu Mos 2 /gr Bằng Phương Pháp Vi Sóng [95]](https://tailieuthamkhao.com/uploads/2022/07/14/nghien-cuu-tong-hop-dac-trung-xuc-tac-mos2-rgo-bien-tinh-voi-mn-va-ung-dung-6-1-120x90.jpg)