37
nghiên cứu chuyển gen vào đốt lá mầm đậu tương nhận thấy khi thay đổi nồng độ chọn lọc ở các giai đoạn tái sinh chọn lọc chồi dẫn đến sự thay đổi đáng kể hiệu quả chuyển gen với các nồng độ glufosinate thay đổi 8-5, 8-8, 10-5, 10-10 mg/l kết quả ghi nhận nồng độ 8-8 cho kết quả tốt nhất với 5,9% hiệu quả chuyển gen, trong khi ở các nồng độ khác hiệu quả chuyển gen đạt được từ 0,1 - 1,4% [124]. Paz và cộng sự (2004) sử dụng glufosinate 6 mg/l ở cả giai đoạn chọn lọc chồi và kéo dài chồi đạt được hiệu quả chuyển gen tốt nhất 6,3% [125]. Ngoài ra, Olhoft và cộng sự (2003) áp dụng hệ thống chọn lọc sử dụng gen chọn lọc hygromycin phosphotransferase (hptII) với chất chọn lọc hygromycin 5 mg/l ở giai đoạn tạo chồi, 10 mg/l giai đoạn kéo dài chồi, đồng thời kết hợp sử dụng bổ sung tổ hợp các hợp chất thiol chống oxy hóa giúp tăng hiệu quả chuyển gen từ 0,7% lên 16,4% [126]. Mặc dù cho hiệu quả chọn lọc tốt, ngay cả khi bổ sung các hợp chất thiol, nhưng do độc tính của hygromycin rất cao, tác động lên các giống khác nhau nên khả năng chọn lọc hiệu quả bị giới hạn bởi giống đậu tương sử dụng.
Các nghiên cứu trên cho thấy trong ba hệ thống được sử dụng để chọn lọc thể chuyển gen ở đậu tương, hệ thống dùng gen gen bar được sử dụng phổ biến nhất và thành công trên nhiều giống đậu tương khác nhau, hạn chế hình thành thể khảm, đồng thời vẫn đạt được hiệu quả chọn lọc thể chuyển gen tốt trên nhiều giống. Do đó, trong nghiên cứu này, gen bar và glufosinate sẽ được sử dụng để chọn lọc thể chuyển gen. Tuy nhiên, việc áp dụng nồng độ glufosinate thích hợp quyết định lớn đến khả năng chuyển gen. Nồng độ này thay đổi tùy giống, trạng thái hạt và điều kiện nuôi cấy in vitro nên chúng tôi sẽ tiến hành khảo sát nồng độ thích hợp nhất để chọn lọc thể chuyển gen với các giống đậu tương được sử dụng trong nghiên cứu.
Mẫu mô đậu tương khi được tạo vết thương để chuyển gen bằng vi khuẩn A. tumefaciens nhanh chóng bị oxy hóa, mô chuyển thành màu nâu, chết dần, làm giảm hiệu quả biến nạp gen. Khắc phục hiện tượng này là một trong những yêu cầu cần thiết để cải thiện hiệu quả chuyển gen vào đậu tương. Nghiên cứu dùng các chất chống oxy hóa để giảm sự hóa nâu của mẫu qua đó giúp nâng cao hiệu quả chuyển gen đã được thực hiện bởi nhiều tác giả. Olhoft và Somers (2001) bổ sung 400 mg/l L-cysteine vào môi trường đồng nuôi cấy giúp tăng hiệu quả chuyển gen gấp 5 lần khi xét biểu hiện GUS ở mầm chồi sau 28 ngày chuyển gen [110]. Nghiên cứu của
38
Olhoft và cộng sự (2001) cho thấy các hợp chất thiol: L-cystetine, D-cysteine, Sodium thiosulfate, dithiothreitol (DTT)… giúp tăng hiệu quả chuyển gen đáng kể [127]. Khả năng này được chứng minh không phụ thuộc vào giống đậu tương, dòng vi khuẩn cũng như plasmid. Hiệu quả chuyển gen tăng do nhóm thiol trong các hợp chất này ức chế hoạt động của các enzyme đáp ứng với vết thương và sự xâm nhiễm của vi khuẩn như peroxidases (PODs) và polyphenol oxidases (PPOs) làm giảm đáng kể hiện tượng hóa nâu, chết mẫu đồng thời tăng khả năng chuyển gen. Nghiên cứu của Xinping và Deyue (2006) cho thấy việc sử dụng kết hợp các hợp chất thiol (3,3 mM cysteine; 1 mM DDT; 1 mM sodium thiosulfate) giúp tăng hiệu quả chuyển gen trên nhiều giống đậu tương Trung Quốc hơn so với chỉ sử dụng 3,3 mM cysteine [128]. Hiệu quả chuyển gen cao nhất đạt được với giống Nannong 88-1 là 2,2%. Tuy nhiên, khi sử dụng hệ thống chọn lọc với gen kháng thuốc diệt cỏ, những hợp chất thiol cho thấy làm giảm khả năng chọn lọc của glufosinate. Như vậy việc sử dụng các hợp chất chống oxy hóa gốc thiol đã được chứng minh giúp giảm hiện tượng hóa nâu của mẫu khi tạo vết thương và bị xâm nhiễm bởi vi khuẩn A. tumefaciens. Điều này hữu hiệu trên hầu hết giống nên trong nghiên cứu của chúng tôi không nghiên cứu yếu tố này mà áp dụng kết quả của các nghiên cứu trước đó.
Phương pháp tạo vết thương mẫu đóng vai trò quan trọng ảnh hưởng đến hiệu quả chuyển gen vào đậu tương thông qua vi khuẩn A. tumefaciens. Nghiên cứu của nhiều tác giả cho thấy bằng cách tối ưu các phương pháp tạo vết thương đã giúp hiệu quả chuyển gen tăng đáng kể, đặc biệt khi sử dụng đốt lá mầm để chuyển gen. Vùng này (vùng mô phân sinh nối giữa trụ hạ diệp và lá mầm) có thể được tạo vết thương bằng nhiều cách khác nhau như bắn gen (đạn vàng hoặc tungsten không chứa vật liệu di truyền được dùng để tạo vết thương), siêu âm (SAAT), thấm hút chân không (vacuum), kim châm nhiều mũi, kim tiêm, dao mổ... Sau đây là những nghiên cứu tối ưu hóa cách tạo vết thương để tăng hiệu quả chuyển gen.
Đối với vùng đốt lá mầm, phương pháp thông thường được nhiều tác giả sử dụng là dùng dao mổ số 15 (có vùng đầu hình vòng cung) loại bỏ chồi đỉnh, cắt nhẹ theo phương vuông góc với trụ dưới lá mầm 7 - 10 lần. Thao tác này đòi hỏi kỹ năng khéo léo cắt chính xác, không quá mạnh hoặc quá nhẹ, đảm bảo loại chồi đỉnh và vừa đủ tạo vết thương. Một số tác giả đã sử dụng các dụng cụ khác và ghi nhận
Có thể bạn quan tâm!
-
![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]
Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40] -
 Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs)
Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs) -
 Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ
Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ -
 Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen
Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen -
 Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt
Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt -
 Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Xem toàn bộ 176 trang tài liệu này.
39

hiệu quả chuyển gen tốt hơn. Xue và cộng sự (2006) sử dụng kim châm nhiều mũi (30 mũi) tạo vết thương mẫu một nửa hạt giúp tăng hiệu quả chuyển gen đáng kể [129]. Những mẫu không xử lý kim châm, không tạo được thể chuyển gen, ngược lại khi được xử lý với kim châm một cách tối ưu, châm 2 lần, hiệu quả chuyển gen đạt được 12%. Tuy nhiên, khi tạo vết thương quá mức, châm 3-4 lần dẫn đến giảm dần hiệu quả chuyển gen. Yamada và cộng sự (2010) cũng sử dụng kim châm nhiều mũi, rạch 10 lần để tạo vết thương mẫu đốt lá mầm, kết hợp sử dụng chất hoạt động bề mặt Silwet L-77 0,02% đã giúp tăng hiệu quả chuyển gen đáng kể từ 1% lên 4,4% [130].
Nghiên cứu sử dụng sóng siêu âm tạo vết thương đã được sử dụng thành công trên nhiều đối tượng. Trên đậu tương, Trick và Finer (1998) đã nghiên cứu sử dụng sóng siêu âm hỗ trợ chuyển gen vào cụm mô có khả năng sinh phôi thông qua vi khuẩn A. tumefaciens [131]. Nghiên cứu cho thấy hiệu quả rõ ràng của việc tăng khả năng chuyển gen vào cụm mô phôi khi chỉ nhận được những cụm mô chuyển gen khi có xử l sóng siêu âm, ngược lại mẫu không được xử lý không nhận được mô chuyển gen. Điều này do nhiều vết thương nhỏ tạo ra bởi sóng siêu âm giúp sự xâm nhiễm của vi khuẩn sâu vào bên trong mô và nâng cao khả năng chuyển gen bền vững. Thời gian xử lý mẫu với sóng siêu âm là yếu tố cần được tối ưu, do sóng siêu âm có thể ảnh hưởng đến sức sống và khả năng tái sinh của mẫu sau chuyển gen. Trong nghiên cứu này, thời gian xử lý sóng siêu âm tối ưu được ghi nhận là 30s. Tuy nhiên, nghiên cứu của Meurer và cộng sự (1998) chuyển gen vào đốt lá mầm của 28 giống đậu tương khác nhau cho thấy, xử lý mẫu với sóng siêu âm không giúp tăng hiệu quả chuyển gen với biểu hiện GUS ổn định ở 45 ngày so với phương pháp thông thường ngâm trong dung dịch (1 - 2%) [132]. Mariashibu và cộng sự (2012) nghiên cứu chuyển gen vào lá mầm non [133] với mẫu được xử lý áp suất âm trong môi trường chân không hoặc sóng siêu âm. Kết quả cho thấy cả áp suất âm và sóng siêu âm đều giúp tăng hiệu quả chuyển gen với kết quả tối ưu đạt được khi xử lý với môi trường -750 mm Hg trong 2 phút là 9,45%, còn với sóng siêu âm thời gian xử lý 2s cho kết quả tối ưu 5,21%, mẫu đối chứng không xử lý cho hiệu quả chuyển gen 3,21%. Arun và cộng sự (2015) nghiên cứu ảnh hưởng của sóng siêu âm, áp lực âm khi chuyển gen vào đốt lá mầm đậu tương [134]. Kết quả
40
cho thấy sóng siêu âm giúp tăng đáng kể hiệu quả chuyển gen với thời gian xử lý 20s đạt hiệu quả chuyển gen tối ưu 10,3% so với tạo vết thương bằng mũi kim tiêm 4,6%. Ngoài ra, khi kết hợp với áp lực âm trong môi trường chân không tối ưu ở - 250 mm Hg trong 2 phút giúp tăng thêm hiệu quả chuyển gen lên 18,6%. Điều này có thể do tác động cộng gộp khi sóng siêu âm giúp tạo các vết thương nhỏ trên bề mặt mô còn áp lực âm giúp kéo vi khuẩn xâm nhập sâu vào các vết thương trên vùng tế bào mô phân sinh. Các tác giả cũng ghi nhận khi xử lý sóng siêu âm với thời gian lâu hơn cũng như áp lực âm được áp dụng với thời gian và áp lực lâu sẽ làm giảm dần hiệu quả chuyển gen so với nghiệm thức tối ưu. Khi áp dụng phương pháp chuyển gen này trên các giống đậu tương khác nhau cũng giúp đạt được hiệu quả chuyển gen khá cao từ 13,3 - 16,6%. Điều này cho thấy phương pháp có thể áp dụng cho nhiều giống đậu tương. Ngoài ra một số nghiên cứu khác cũng ghi nhận hiệu quả của sóng siêu âm giúp tăng hiệu quả chuyển gen trên đậu tương [135][136].
Tóm lại, nhiều phương pháp tạo vết thương mẫu khác nhau được sử dụng đã cho thấy việc tối ưu hóa yếu tố này có thể giúp nâng cao đáng kể hiệu quả chuyển gen vào đậu tương thông qua vi khuẩn A. tumefaciens. Để tìm cách thức tạo vết thương thích hợp, chúng tôi tiến hành khảo sát ảnh hưởng của các cách xử lý mẫu khác nhau đến hiệu quả chuyển gen để so sánh, đánh giá và lựa chọn phương pháp thích hợp giúp nâng cao hiệu quả chuyển gen vào các giống đậu tương.
Ngoài ra, nhiều nghiên cứu đã được thực hiện nhằm đánh giá ảnh hưởng của các yếu tố khác nhau trong qui trình thực hiện đến hiệu quả chuyển gen. Trên nhiều giống đậu tương khác nhau ở Mỹ, Parkistan, Trung Quốc, Ấn Độ, một số thông số có ảnh hưởng đến hiệu quả chuyển gen đạt được các thông số tối ưu như: sử dụng hạt đậu có sức sống tốt, thời gian khử trùng được rút ngắn (12 - 16 giờ); khi sử dụng gen chọn lọc bar, chất lọc lọc glufosinate cho hiệu quả tốt hơn bialaphos; nồng độ vi khuẩn thích hợp cho chuyển gen OD600nm = 0,6 - 1; thời gian xâm nhiễm tối ưu là 1 giờ; chuẩn bị mẫu trong dịch vi khuẩn cho hiệu quả chuyển gen tốt hơn so với trong môi trường hoặc nước; thời gian đồng nuôi cấy 3 - 5 ngày; môi trường đồng nuôi cấy có pH 5,4; nồng độ acetosyringone 0,1 - 0,2 mM [125][137][138][139].
Dựa trên các nghiên cứu này, chúng tôi áp dụng các kết quả tối ưu cho nghiên cứu chuyển gen vào các giống đậu tương trong đề tài.
Nghiên cứu chuyển gen đậu tương trong nước
Một số nghiên cứu chuyển gen vào đậu tương cũng đã được thực hiện, các tác giả chủ yếu sử dụng vật liệu chuyển gen là mẫu đốt lá mầm và một nửa hạt. Nguyễn Tiến Dũng và Ngô Xuân Bình (2011) nghiên cứu khả năng tiếp nhận gen của 20 giống đậu tương Việt Nam thông qua chuyển gen bằng vi khuẩn A. tumefaciens vào mẫu một nửa hạt [108]. Kết quả biểu hiện GUS sau 14 ngày nuôi cấy trên môi trường không có glufosinate cho thấy khả năng tiếp nhận gen thay đổi rất khác nhau tùy giống đậu tương (16 - 90%), trong đó một số giống có tỉ lệ biểu hiện cao (76 - 90%) như DT84, DVN6, DVN9, DT90. Trần Thị Cúc Hòa và cộng sự (2008) nghiên cứu chuyển gen bar và gus vào giống đậu tương PC 19 thông qua vi khuẩn A. tumefaciens dùng đốt lá mầm, tạo vết thương bằng cách cắt 7-10 lần ở vùng mô phân sinh, với hệ thống chọn lọc gen bar và chất chọn lọc glufosinate 8 mg/l ở giai đoạn tái sinh chồi, 3 mg/l giai đoạn kéo dài chồi [140]. Trong môi trường có sử dụng các hợp chất chống oxy hóa (L-Cysteine, sodium thiosulfate, DDT) để giảm hiện tượng hóa nâu của mẫu. Kết quả thu được hiệu quả chuyển gen 2% (số dòng dương tính Southern blot/mẫu xử lý). Tuy nhiên, Trần Thị Cúc Hòa và cộng sự (2013) sử dụng qui trình tương tự để chuyển gen kháng sâu vào giống Williams 82 cho hiệu quả chuyển gen còn 0,38% [141]. Điều này cho thấy hiệu quả chuyển gen phụ thuộc khá lớn vào giống sử dụng. Phan Lê Tư và cộng sự (2018) nghiên cứu chuyển gen vào đốt lá mầm 3 giống đậu tương DT22, DT84, MTD176, tạo vết thương bằng cách cắt 7-10 tại vùng đốt lá mầm [109]. Kết quả chọn lọc với 10 mg/l hygromycin, chỉ giống DT22 tạo được chồi chuyển gen (1,33%), các giống còn lại không nhận được thể chuyển gen. Nghiên cứu cũng cho thấy việc bổ sung 0,12 mM liponic acid giúp giảm hiện tượng bị hoại tử, hóa nâu vàng của mẫu dẫn đến tăng hiệu quả chuyển gen khi chỉ nhận được chồi chuyển gen trong thí nghiệm có bổ sung 0,12 mM liponic acid. Các nghiên cứu trên cho thấy, phương pháp chuyển gen phổ biến dùng mẫu đốt lá mầm hoặc nửa hạt có thể được sử dụng để tạo cây chuyển gen với các giống đậu tương Việt Nam, tuy nhiên hiệu quả chuyển gen đạt được tương đối thấp và phụ thuộc nhiều vào giống sử dụng.
1.3.3.2. Chuyển gen vào đậu tương bằng phương pháp bắn gen
Phương pháp bắn gen sử dụng đạn vàng hoặc tungsten đưa gen mong muốn vào tế bào thực vật. Phương pháp này được sử dụng để chuyển gen vào vùng mô phân sinh của hạt, phôi soma và mô phân sinh đỉnh. Trong đó, phôi soma cho hiệu quả chuyển gen cao nhất. Tuy nhiên khả năng tạo phôi soma phụ thuộc nhiều vào giống sử dụng nên phương pháp chuyển gen này bị giới hạn [92]. Sự tạo phôi soma của đậu tương có sự khác biệt lớn giữa các giống và ở các giai đoạn khác nhau của sự phát sinh phôi (cảm ứng, nhân lên, trưởng thành và nảy mầm). Rất khó để tìm ra một giống có khả năng đáp ứng cao ở tất cả các giai đoạn. Yang và cộng sự (2009), đã sàng lọc 98 giống đậu tương Trung Quốc và chỉ chọn được 12 giống dựa trên khả năng tạo phôi, trong đó số cây trung bình cao nhất tái sinh từ mẫu là 1,35 [142].
1.3.3.3. Nghiên cứu chuyển gen làm biến đổi chất lượng hạt và những đặc điểm nông học trên đậu tương
Biến đổi chất lượng hạt
Thành phần protein và amino acid: mặc dù protein trong đậu tương có giá trị dinh dưỡng tương đương với thịt, trứng nhưng nó thiếu một số amino acid sulfur như methionine. Do đó, một số nghiên cứu đã chuyển gen giúp tăng tổng hợp các amino acid trong hạt đậu như lysine, tryptophan, threonine… [143][144][145]. Ngoài ra, đậu tương cũng được sử dụng để chuyển gen sản xuất những protein dược phẩm như hocmon sinh trưởng người, nhân tố phát triển nguyên bào sợi, các loại vaccin ăn được… [81][146]. Một số protein trong đậu tương có thể gây dị ứng với một số người như Gly m Bd 30K, do đó nghiên cứu làm im lặng gen tổng hợp protein này cũng đã được thực hiện [147].
Dầu đậu tương chiếm tỉ trọng lớn trong sản lượng dầu thực vật và được sử dụng rộng rãi trong nghành công nghiệp thực phẩm, mực in, dầu bôi trơn, nhiên liệu sinh học. Do đó nhiều nghiên cứu chuyển gen đã được thực hiện để nâng cao hàm lượng và cải thiện chất lượng dầu đậu tương như: chuyển gen acetyltransferase giúp tăng hàm lượng dầu, kỹ thuật RNAi giúp giảm hàm lượng acid béo không no và chuyển gen tăng hàm lượng vitamin E…
Trong hạt đậu tương cũng chứa một số hợp chất có hoạt tính sinh học tốt cho sức khỏe như isoflavone, saponin giúp chống ung thư, tốt cho tim mạch. Nhiều
nghiên cứu tăng hàm lượng các chất này trong hạt cũng đã được thực hiện. Ngoài ra hạt đậu tương chứa nhiều phytic acid (phytate), không sử dụng được bởi nhiều loài động vật như gà, lợn, người… do đó nhiều nghiên cứu chuyển gen làm giảm hàm lượng chất này trong hạt.
Tăng cường tính kháng stress sinh học và stress phi sinh học
Đậu tương có thể bị sâu bệnh ảnh hưởng làm giảm năng suất. Nhiều nghiên cứu chuyển gen đã tạo được các giống đậu tương giúp kháng sâu bệnh như chuyển gen kháng sâu Bt, kháng ký sinh trùng Hs1pro-1, kháng virus SMV, virus gây bệnh lùn cây, gen kháng nấm...
Đậu tương cũng được chuyển gen chống chịu với các điều kiện khô hạn bằng cách chuyển gen P5CR mã hóa L-Δ1-pyrroline-5-carboxylate reductase… [148][149]. Đặc tính thành công nhất trong đậu tương chuyển gen là tính kháng thuốc diệt cỏ với nhiều loại thuốc khác nhau như gen mã hóa một loại EPSPS kháng với glyphosate, acetohydroxyacid synthase kháng imazapyr, 4-hydroxyphenylpyruvate dioxygenase kháng với isoxaflutole và phosphinothricin N-acetyltransferase kháng phosphinothricin [150][151][152]. Kể từ khi giống đậu tương kháng thuốc diệt cỏ được thương mại hóa năm 1996, hiện nay phần lớn diện tích trồng đậu tương trên thế giới sử dụng các giống này.
1.4. Cách tiếp cận của đề tài
Nghiên cứu dựa trên các thành tựu về nuôi cấy mô và chuyển gen ở cây đậu tương của các tác giả trong và ngoài nước. Tổng hợp astaxanthin được ứng dụng từ con đường chuyển hoá tự nhiên của cây hoa Adonis aestivalis.
Chiến lược chuyển gen đề xuất chuyển 3 gen liên quan đến con đường tổng hợp astaxanthin, gồm Zm-psy (gen mã hoá enzyme phytoene synthase), cbfd2 (gen mã hoá enzyme carotenoid β-ring 4-dehydrogenase của Adonis aestivalis), hbfd1 (gen mã hoá enzyme carotenoid 4-hydroxy-β-ring 4-dehydrogenase của Adonis aestivalis) vào đậu tương có nghĩa như sau: gen Zm-psy biểu hiện enzyme phytoene synthase tăng cường tổng hợp phytoene thúc đẩy gia tăng tổng hợp β- carotene trong hạt; gen cbfd2, hbfd1 biểu hiện các enzyme có thể sử dụng cơ chất β-carotene trong hạt đậu tương để tổng hợp astaxanthin (được tổng hợp theo trình tự công bố tại Genbank với số truy cập tương ứng là AY644758 và ABK41045); gen
bar quy định tính kháng phosphinothricin được sử dụng như yếu tố chọn lọc mô và cây chuyển gen.
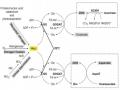
Plasmid pITB-AST là binary plasmid trong hệ thống binary của Agrobacterium tumefaciens dùng để chuyển gen (hình 1.16). Plasmid này có khả năng nhân lên trong E. coli và A. tumefaciens, vùng T-DNA mang các gen chuyển vào thực vật, vùng bên ngoài T-DNA mang gen kháng kanamycin npt II biểu hiện ở vi khuẩn.
Plasmid pITB-AST, kích thước khoảng 15,5 kb, T-DNA mang tổ hợp gen Pglycinin-cbfd2-Tglycinin/Pglycinin-hbfd1-Tglycinin/Pglycinin-ZmPsy-Tglycinin và gen chọn lọc Pnos-bar-Tnos biểu hiện ở thực vật.
Pglycinin : promoter của gen mã hoá glycinin ở đậu tương. Tglycinin : terminator của gen mã hoá glycinin ở đậu tương. bar : gen quy định tính kháng phosphinothricin.
cbfd2 : gen mã hoá enzyme carotenoid β-ring 4-dehydrogenase ở
Adonis aestivalis.
hbfd1 : gen mã hoá enzyme carotenoid 4-hydroxy-β-ring 4-dehydrogenase ở Adonis aestivalis.
Zm-psy : gen mã hoá enzyme phytoene synthase.
Pnos : promoter của gen mã hoá enzyme nopalin synthase.
Tnos : terminator của gen mã hoá enzyme nopalin synthase.

![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](https://tailieuthamkhao.com/uploads/2022/12/28/nghien-cuu-tao-cay-dau-tuong-glycine-max-l-bien-doi-gen-co-kha-nang-tong-4-1-120x90.jpg)