Hình 1.16. Cấu trúc plasmid pITB-AST
CHƯƠNG 2. VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. Vật liệu
2.1.1. Giống đậu tương
Bảy giống đậu tương được thu thập, sử dụng, trong đó có 6 giống Việt Nam (giống lai đã thuần hóa) và một giống Nhật Bản (bảng 2.1). Cụ thể, các giống đậu tương gồm giống MTĐ 176, MTĐ 760-3, MTĐ 860-3, MTĐ 885-1 từ Bộ môn Di truyền - Giống nông nghiệp, Khoa Nông nghiệp & Sinh học Ứng dụng - Trường Đại học Cần Thơ; giống HL 07-15; OMĐN 29 từ Trung tâm Nghiên cứu Thực nghiệm Nông nghiệp Hưng Lộc, Viện Khoa học Kỹ thuật Nông nghiệp Miền Nam; giống Edamame là giống đậu tương Nhật Bản từ Công ty TNHH Yên Khê.
ảng 2 1 Nguồn gốc và một số đặc điểm của các giống đậu tương được sử dụng.
MTĐ 176 | MTĐ 760-4 | MTĐ 860-3 | MTĐ 885-1 | Edamame | HL 07- 15 | OMĐN 29 | |
Nguồn gốc | ĐH4 x CES 97- 13 | MTĐ176 x A70 | TWK* x MTĐ176 | DT 2000 x MTĐ65 | Không có thông tin | HL 203 x HL 92 | OMQDN 1 x Kettum |
TG sinh trưởng (ngày) | 80-85 | 85-90 | 80-85 | 85 | 78-85 | 80-85 | |
Năng suất (tấn/ha) | 2,0-3,2 | 2,8-3,8 | 1,9-2,8 | 2,5-3,5 | 2,19-2,37 | 2-2,5 | |
Tỉ lệ hạt nảy mầm | >95% | >95% | >95% | >95% | >95% | >95% | >95% |
Nơi cung cấp | Bộ môn Di truyền - Giống nông nghiệp, Khoa Nông nghiệp & Sinh học Ứng dụng - Trường Đại học Cần Thơ | Cty TNHH Yên Khê | Trung tâm Nghiên cứu Thực nghiệm Nông nghiệp Hưng Lộc | ||||
Có thể bạn quan tâm!
-
 Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs)
Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs) -
 Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ
Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ -
 Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen
Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen -
 Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt
Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt -
 Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro
Đánh Giá Các Giai Đoạn Sinh Trưởng Cây Chuyển Gen Trong Điều Kiện Ex Vitro -
 Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy.
Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy.
Xem toàn bộ 176 trang tài liệu này.
2.1.2. Chủng vi khuẩn, plasmid
Chủng vi khuẩn Agrobacterium tumefaciens EHA 105 dùng để biến nạp gen vào đậu tương
Plasmid pCAMBIA3301 (CAMBIA - Trung tâm Nghiên cứu ứng dụng Sinh học Phân tử trong Nông nghiệp Quốc tế, Úc) có kích thước khoảng 11,3 kb. Vùng T-DNA mang tổ hợp gen PCaMV35S-bar-Tnos/PCaMV35S-gus-Tnos.
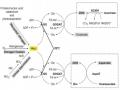
Plasmid pITB-AST (Phòng Công nghệ Gen - Viện Sinh học Nhiệt đới cấu trúc) là binary plasmid trong hệ thống binary dùng để chuyển gen của Agrobacterium tumefaciens có kích thước khoảng 15,5 kb, T-DNA của plasmid mang tổ hợp gen Pglycinin-cbfd2-Tglycinin/Pglycinin-hbfd1-Tglycinin/Pglycinin- Zm-psy-Tglycinin và gen chọn lọc Pnos-bar-Tnos biểu hiện ở thực vật. Trong đó, gen Zm-psy biểu hiện enzyme phytoene synthase tăng cường tổng hợp phytoene thúc đẩy gia tăng tổng hợp β-carotene trong hạt; gen cbfd2, hbfd1 biểu hiện các enzyme có thể sử dụng cơ chất β-carotene trong hạt đậu tương để tổng hợp astaxanthin.
2.1.3. Kim châm để tạo vết thương cho mẫu chuyển gen
Kim châm được chuẩn bị từ đoạn dây điện 10 cm với phần lõi bên trong gồm 30 dây đồng nhỏ (kích thước dây đồng là 0,1 mm). Đường kính mặt cắt ngang dây điện là 3,15 mm, với phần lõi là 1,7 mm. Khoảng 0,5 cm vỏ nhựa ở 1 đầu được tách bỏ để lộ phần sợi đồng bên trong, sau đó cắt bỏ, chỉ giữ lại 10 sợi đồng, các sợi này được mài cho nhọn bằng giấy nhám (hình 3.17 b).
2.1.4. Môi trường nuôi cấy mô
Môi trường nuôi cấy mô, trình bày ở bảng 2.2 sử dụng các thành phần cơ bản, khoáng, vitamin, của môi trường MS [153] và Gamborg B5 (B5) [154], tham khảo thêm các thành phần khác của Paz và cộng sự (2006), Ma và Wu (2008) [111] [102]. Các thành phần môi trường sản xuất bởi hãng Ducefa (Hà Lan), ngoại trừ đường mía sucrose (đường tinh luyện Biên Hòa, Việt Nam); agar (Nam Hạ Long, Việt Nam).
ảng 2.2. Thành phần các loại môi trường nuôi cấy mô và chuyển gen
Khoáng | Vitamin | Chất điều hòa sinh trưởng | Thành phần khác | |
Môi trường nảy mầm hạt (GM) | 1X MS | B5 | 30 g/l Sucrose; 10 g/l agar ; pH 5,7 | |
Môi trường tái sinh chồi (SI) | 1X B5 | B5 | (0; 0,5; 1; 1,5; 2; 2,5; 3) mg/l BA | 30 g/l Sucrose; 0,59 g/l MES; và 10 g/l agar; 500 mg/l cefotaxime. pH 5,7 |
Môi trường tăng trưởng | 1X MS | B5 | 0,1 mg/l IAA; 0,5 mg/l GA3; | 30 g/l Sucrose; 0,59 g/l MES; 10 g/l agar; 500 |
1 mg/l Zeatin- R | mg/l cefotaxime; 50 mg/l Asparagine; 100 mg/l L-Pyroglutamic Acid. pH 5,7 | |||
Môi trường lây nhiễm (IF) | 1/10 X B5 | 1/10X B5 | 0,25 mg/l GA3; 2 mg/l BA | 30 g/l Sucrose; 3,9 g/l MES; 100 µM acetocyringone. pH 5,4 |
Môi trường nuôi chung (CC) | 1/10X B5 | 1/10X B5 | 0,25 mg/l GA3; 2 mg/l BA | 30 g/l Sucrose, 3,9 g/l MES và 10 g/l agar, 400 mg/l Cysteine; 154,2 mg/l Dithiothrietol; 100 µM acetosyringone. pH 5,4 |
Môi trường phát triển cây (RM) | 1X MS | B5 | (0; 0,5; 1; 1,5; 2) mg/l IBA | 20 g/l Sucrose; 0,59 g/l MES; 10 g/l agar pH 5,6. |
2.1.5. Hóa chất trong các thí nghiệm khác
- Tách chiết DNA từ thực vật
Phương pháp của Dellaporta và cộng sự (1983) [155].
+ NaCl 5 M. + SDS 10%.
+ β Mercaptoethanol. + Potassium acetate 5M.
+ Tris-HCl 1 M. + RNAse.
+ EDTA 0.5 M. + Ethanol 80%.
+ Isopropanol. + Phenol/Chloroform 1:1.
Bộ DNeasy Plant Mini Kit (Qiagen)
- Phản ứng PCR
Kit PCR của Promega gồm: dNTPs (ATP, CTP, GTP, TTP), dung dịch đệm PCR 10X, Taq Polymerase, nước PCR
+ Mồi xuôi (Primer F) và mồi ngược (Primer R).
+ Mẫu DNA thực vật.
- Hóa mô GUS
+ Dung dịch stock X-gluc 0,02 M: 70 mg X-gluc, 2 ml DMSO, 8 ml nước cất vô trùng.
+ Dung dịch X-gluc nhuộm mẫu: 5 ml stock X-gluc, 10 ml dung dịch đệm Na2HPO4 (pH 7), 4 ml EDTA 0,25 M (pH 7), 1 ml triton-X 100 10%.
- Điện di trên gel agarose
+ Agarose.
+ Gelred.
+ Dung dịch đệm TAE (10X stock): Tris base 48,4 g/l, glacial acetic acid 11,4 ml, EDTA Disodium 3,72 g/l pH 8 800 ml, nước lên thể tích 1 lít.
- Thí nghiệm chuyển gen
+ Phosphinothricin (PPT): pha trong nước cất, lọc vô trùng, nồng độ stock 2,5 mg/ml dùng để chọn lọc đối với gen bar.
+ Kanamycin: nồng độ stock 10 mg/ml, pha trong nước cất, lọc vô trùng.Sử dụng chọn lọc vi khuẩn A. tumefaciens mang plasmid chuyển gen.
+ Rifamicin: stock 10 mg/ml, pha trong nước cất và lọc vô trùng. Sử dụng cho chọn lọc vi khuẩn A. tumefaciens mang helper plamid.
+ Acetosyringone: 2 mg/ml hòa tan trong cồn, thêm nước cất, lọc vô trùng.
+ Cefotaxime: 500 mg/ml pha trong nước cất, lọc vô trùng, dùng diệt khuẩn.
- Southern bot
Bộ kit Amersham ECL Direct Nucleic Acid Labelling And Detection Systems của công ty GE Healthcare UK.
+ Depurination solution: HCl 250 mM.
+ Denaturation solution: NaCl 1,5 M ; NaOH 0,5 M.
+ Neutralizing solution: NaCl 1,5 M; Tris HCl 0,5 M.
+ 20x SSC: Na3citrate 0,3 M; NaCl 3 M.
+ Primary wash buffer: Urea 6 M; SDS 0,4%; 20 x SSC.
+ Secondary wash buffer: 20 x SSC.
- Thử nghiệm tính kháng thuốc diệt cỏ của cây chuyển gen
+ Thuốc diệt cỏ Basta: Có thành phần DL-Phosphinothricin (glufosinate ammonium) 200 g/l.
2.1.6. Thiết bị sử dụng
- Máy PCR Techne® - Tủ cấy vô trùng (Sanyo, Nhật)
- Máy cất nước (Schott) - Máy lắc (Innova 2100, Flatform Shaker)
- Nồi hấp (Hirayama) - Tủ ổn nhiệt (Incubator – SANYO)
- Máy lắc Innova 4230 - Máy điện di Biorad®
- Máy chụp gel Biorad - Máy li tâm lạnh Eppendorf®, 5417R
- Máy xung điện BTX ECM - Máy đo OD Thermo, Mỹ
- Máy đánh sóng siêu âm - Buồng áp lực âm của máy bắn gen (Bio-Rad, Mỹ)
2.2. Nội dung và Phương pháp
Nội dung 1: Xây dựng hệ thống tạo cây con hoàn chỉnh in vitro từ đốt lá mầm và một nửa hạt.
2.2.1. Tuyển chọn giống đậu tương
Tuyển chọn các giống đậu tương đã thuần hóa, có năng suất cao, chống chịu sâu bệnh tốt, trồng phổ biến.
Kiểm tra hàm lượng β-carotene của các giống đậu tương tuyển chọn được bằng phương pháp sắc k HPLC do đây là cơ chất cần có để các enzyme (mã hóa bởi các gen biến nạp) chuyển hóa tạo astaxanthin.
Những dòng đậu tương có hiện diện β-carotene được kiểm tra khả năng nảy mầm nhằm đảm bảo sự ổn định, chính xác, hiệu quả trong quá trình thí nghiệm. Kiểm tra khả năng nảy mầm của hạt bằng cách gieo hạt trên giấy thấm ướt đặt trong đĩa petri. Mỗi đĩa gieo 20 hạt, lặp lại 3 lần. Sau 5 ngày kiểm tra số lượng hạt nảy mầm.
2.2.2. Khử trùng hạt
Khử trùng bằng khí clo
Cho hạt đậu tương vào đĩa petri 90 x 15 mm trải thành một lớp. Xếp các đĩa này, với nắp được để mở, và một cốc đong 250 ml vào bình hút ẩm kín. Cho vào cốc đong 100 ml nước Javel (Hàm lượng clo 38 g/l) và thêm 3,5 ml HCl (12 N) bằng cách đổ dọc theo thành cốc. Đóng nắp bình hút ẩm và giữ trong thời gian khác nhau (16, 24 giờ). Sau thời gian tiếp xúc với khí clo, đóng các đĩa petri đựng hạt và đưa vào tủ cấy vô trùng. Mở đĩa cho khí clo bay toàn bộ ra ngoài trong 30 phút [111].
Khử trùng bằng dung dịch Javel
Hạt đậu tương được khử trùng bằng cách ngâm vào dung dịch nước Javel 50% (hàm lượng clo 38 g/l) trong các thời gian khác nhau 30, 40, 50 phút, sau đó
51
rửa sạch mẫu lại 3 lần bằng nước cất vô trùng [102][150].
Hạt sau khi khử trùng bởi các tác nhân được cấy trên môi trưởng rắn gồm khoáng MS, vitamin B5, pH 5,6 [111][154]. Các nghiệm thức được thực hiện với 12 mẫu/bình môi trường, lặp lại 3 lần. Thí nghiệm được bố trí theo kiểu đơn yếu tố hoàn toàn ngẫu nhiên.
Chỉ tiêu theo dõi: Tỉ lệ hạt không nhiễm, tỉ lệ hạt không nhiễm nảy mầm.
2.2.3. Ảnh hưởng của BA lên sự tái sinh chồi của đốt lá mầm và một nửa hạt
Khảo sát ảnh hưởng BA lên khả năng tạo chồi bất định của đốt lá mầm và một nửa hạt. Qua đó xác định môi trường thích hợp kích thích tạo chồi.
Phương pháp khử trùng hạt áp dụng theo qui trình tối ưu nhận được từ mục
2.2.2. Mẫu đốt lá mầm được chuẩn bị theo qui cách của Hinchee và cộng sự (1988), Olhoft và cộng sự (2003) [121][126] (QC 1) với các bước gồm gieo hạt đậu trên môi trường MS-vitamin B5 trong 5 ngày để hạt nảy mầm. Sau đó, cây nảy mầm được loại bỏ phần rễ, giữ lại đoạn trụ dưới lá mầm dài khoảng 3 -5 mm, liền với lá mầm. Dùng dao mổ 15 tách rời hai lá mầm bằng cách chẻ dọc từ đốt đến hết đoạn trụ dưới lá mầm, rồi loại bỏ chồi đỉnh, chồi bên. Tiếp theo cắt nhẹ 7 lần theo phương vuông góc với trụ dưới lá mầm để tạo vết thương cho vùng mô phân sinh nách. Mẫu đốt lá mầm gồm lá mầm, đoạn trụ dưới lá mầm, vùng phân sinh nách, được dùng để cảm ứng chồi (hình 2.1).
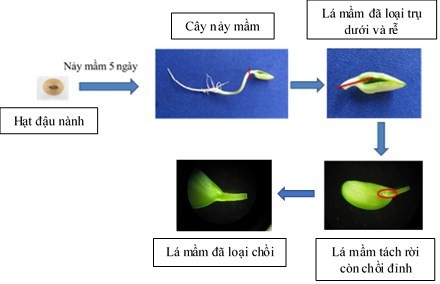
Hình 2.1. Sơ đồ các bước chuẩn bị mẫu đốt lá mầm
Mẫu một nửa hạt được chuẩn bị theo qui cách của Paz và cộng sự (2006)
[111] (QC 2) với các bước thực hiện gồm ngâm hạt đậu trong nước cất vô trùng
khoảng 20 giờ. Sau đó, tách đôi hai lá mầm dọc theo phần rốn hạt (hilum). Tiếp theo, loại bỏ trục phôi (hình 2.2).



Hạt đậu tương Hạt đậu tương ngâm trong nước 20 giờ
Một nửa hạt còn trục phôi
Một nửa hạt đã loại trục phôi
Hình 2.2. Sơ đồ các bước chuẩn bị mẫu một nửa hạt
Đốt lá mầm và một nửa hạt chuẩn bị theo các cách trên được đặt lên môi trường tái sinh SI bổ sung BA (0; 0,5; 1; 1,5; 2; 2,5; 3) mg/l. Mỗi nghiệm thức gồm 10 mẫu, lặp lại 3 lần. Thí nghiệm được bố trí theo kiểu đơn yếu tố, hoàn toàn ngẫu nhiên. Mẫu được nuôi trên kệ sáng (18 giờ chiếu sáng/ngày) với cường độ 2.000 -
3.000 lux, nhiệt độ 25±2oC. Ghi nhận kết quả sau 3 tuần.
Chỉ tiêu theo dõi: Tỉ lệ mẫu tái sinh chồi, số chồi tái sinh trung bình (số chồi tái sinh/số mẫu khảo sát), hình thái chồi bình thường, đồng đều.
Cụm chồi hình thành trên môi trường tạo chồi tối ưu, được chuyển sang môi trường tăng trưởng thân SE. Các chồi cao khoảng 3 cm được tách riêng và cấy lên môi trường khảo sát tạo rễ.
2.2.4. Ảnh hưởng của IBA lên sự tạo rễ của chồi in vitro
Thí nghiệm nhằm xác định nồng độ IBA thích hợp kích thích tạo rễ cho chồi
in vitro để tạo cây con hoàn chỉnh.
Chồi in vitro cao khoảng 3 cm được cấy lên môi trường khoáng MS, vitamin B5, 0,59 g/l MES, bổ sung IBA với các nồng độ khác nhau (0; 0,5; 1; 1,5; 2) mg/l, PH 5,6. Ghi nhận kết quả sau 3 tuần nuôi cấy.
Mỗi nghiệm thức gồm 10 mẫu, lặp lại 3 lần. Thí nghiệm được bố trí theo kiểu đơn yếu tố, hoàn toàn ngẫu nhiên.
Điều kiện nuôi cấy: mẫu được nuôi cấy trên kệ sáng (18 giờ chiếu sáng/ngày) với cường độ 2.000 - 3.000 lux, nhiệt độ 25±2oC.
Chỉ tiêu theo dõi: tỉ lệ chồi tạo rễ, số rễ trung bình (số rễ tạo thành/số mẫu khảo sát).