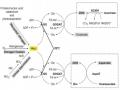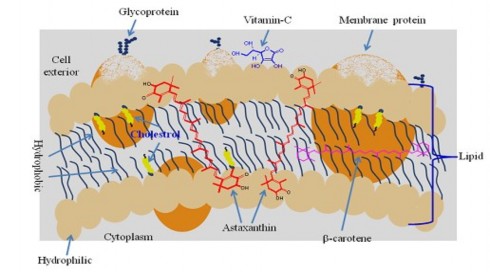
Hình 1.4. Vị trí của phân tử astaxanthin trong màng tế bào [40]
Triệu Euro
Ngoài ra, từ năm 2009, cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (FDA) và Ủy ban Châu Âu đã cho phép sử dụng astaxanthin làm chất tạo màu tự nhiên cho thực phẩm. Đến nay, astaxanthin đã được sử dụng phổ biến để tạo màu đỏ tự nhiên cho sản phẩm trong ngành chăn nuôi gia cầm, thủy sản [38][46].
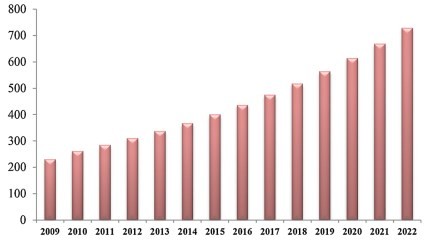
Hình 1.5. Qui mô thị trường astaxanthin đến năm 2022 [4]
Astaxanthin có nhiều công dụng trong bảo vệ sức khỏe, đồng thời cũng được dùng phổ biến làm chất tạo màu nên nhu cầu astaxanthin rất lớn và ngày càng tăng (hình 1.5) [4][47][48]. Năm 2014, thị trường thế giới tiêu thụ khoảng 280 tấn, đạt giá trị 447 triệu USD, đến năm 2019 qui mô thị trường astaxanthin đã đạt mức 1 tỉ USD, với mức tăng ước tính khoảng 16,2%/năm đến năm 2027 [3][4][49]. Hiện nay, giá astaxanthin trên thị trường rất cao, với astaxanthin tự nhiên là 2.500-7.000 USD/kg, astaxanthin tổng hợp khoảng 1.000 USD/kg [4], khoảng 95% astaxanthin
trên thị trường có nguồn gốc tổng hợp từ các sản phẩm hóa dầu, chỉ được sử dụng để tạo màu cho thực phẩm [50]. Năm 2013, quy mô thị trường astaxanthin cho người khoảng 200 triệu USD, dự đoán tăng lên 700 triệu USD năm 2017 [5].
1.1.3.3. Nguồn gốc astaxanthin
Astaxanthin tổng hợp: astaxanthin có thể được tổng hợp hóa học từ các sản phẩm dầu mỏ và là hỗn hợp của 3 dạng đồng phân khác nhau là (3R, 3′R), (3R, 3′S), và (3S, 3′S) với tỉ lệ xấp xỉ 1:2:1 [37]. Loại astaxanthin này ở dạng tự do, không ester hóa, thường chứa sản phẩm phụ hoặc các chất trung gian do đó được dùng làm chất tạo màu trong chăn nuôi gia cầm và nuôi trồng thủy sản.
Astaxanthin tự nhiên: trong tự nhiên, astaxanthin được tìm thấy ở cả động vật, thực vật và vi sinh vật. Trong đó, động vật gồm tôm, cua, cá hồi, cá hồng, cò mỏ bẹt hồng…[51][52]; vi sinh vật gồm Haematococcus pluvialis, Xanthophyllomyces dendrorhous, Pandalus borealis, Pandalus clarkia… [40]; trên thực vật astaxanthin chỉ có ở một số cây có hoa thuộc chi Adonis như Adonis aestivalis [6].
Astaxanthin tự nhiên trên thị trường chủ yếu được sản xuất thông qua nuôi cấy tảo Haematococcus pluvialis, nấm men Xanthophyllomyces dendrorhous, hoặc ly trích từ những động vật có hàm lượng astaxanthin cao như vỏ của tôm, cua... Tảo Haematococcus pluvialis sản xuất astaxanthin ở dạng (3S, 3′S), mono hoặc diester, chiếm 4 - 5 % trọng lượng khô [53]. Trạng thái ester hóa giúp tăng độ ổn định cho astaxanthin. Astaxanthin từ loại tảo này thường được sử dụng trực tiếp làm tác nhân trị liệu, tăng cường sức khỏe. Nấm men Xanthophyllomyces dendrorhous sản xuất astaxanthin, thường ở dạng (3R, 3′R), tự do không ester hóa chiếm 0,5 % trọng lượng khô.
1.1.3.4. Con đường biến dưỡng tạo astaxanthin ở Adonis aestivalis
Trong tất cả các sinh vật, astaxanthin đều được hình thành từ phân tử β- carotene, là một carotenoid hiện diện ở hầu hết sinh vật quang hợp giải phóng oxy [54]. Phân tử β-carotene có hai vòng β ở hai đầu, việc tạo thành astaxanthin được thực hiện bằng cách thêm một nhóm OH (hydroxyl) và một nhóm CO (carbonyl) lần lượt tại nguyên tử cacbon số 3 và 4 ở mỗi vòng β. Các bước diễn ra và enzyme liên quan đến quá trình chuyển hóa này khác nhau ở các sinh vật. Ở thực vật, ngoài
15
một số loài thuộc chi Adonis có thể thực hiện được việc chuyển hóa β-carotene thành astaxanthin, còn lại đa số chỉ có enzyme thêm nhóm hydroxyl vào vòng β- carotene [6][55].
Sau đây là quá trình chuyển hóa β-carotene thành astaxanthin ở cây hoa Adonis aestivalis (hình 1.6) [6]. Bước đầu tiên, enzyme carotenoid β-ring 4- dehydrogenase (CBFD, mã hóa bởi gen cbfd) kích hoạt vị trí cacbon số 4 trên vòng β của phân tử β-carotene. Sản phẩm tạo thành gồm hai phân tử 4-hydroxy-β-ring và 3,4-didehydro-β-ring. Tiếp theo, enzyme carotenoid 4-hydroxy-β-ring 4- dehydrogenase (HBFD, mã hóa bởi gen hbfd) xúc tác phản ứng chuyển hóa các sản phẩm trên gồm 4-hydroxy-β-ring và/hoặc 3,4-didehydro-β-ring thành phân tử 4- keto-β-ring. Cuối cùng, enzyme CBFD xúc tác phản ứng thêm nhóm hydroxyl (OH) vào cacbon số 3 của phân tử 4-keto-β-ring. Như vậy, hai enzyme CBFD và HBFD (mã hóa bởi các gen cbfd và hbfd) qua ba bước phản ứng đã chuyển hóa β-carotene thành astaxanthin trong cây Adonis aestivalis.
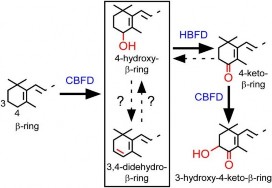
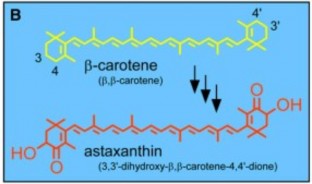
Hình 1.6. Con đường chuyển hoá tạo astaxanthin ở Adonis aestivalis [6]
Một số sinh vật như vi khuẩn, nấm men, vi tảo lục cũng có các con đường chuyển hóa tạo astaxanthin từ β-carotene riêng với các enzyme xúc tác và thứ tự phản ứng khác nhau như trong hình 1.7 [6][56][57].
Ngoài các loài thuộc chi Adonis, con đường tổng hợp astaxanthin không diễn ra tự nhiên ở thực vật mà cần chuyển thêm các gen ngoại lai, gồm gen giúp tăng cường biểu hiện β-carotene, là cơ chất ban đầu để tạo astaxanthin, như psy, pds,... và các gen chuyển hóa β-carotene thành astaxanthin. Đậu tương không có khả năng tổng hợp astaxanthin một cách tự nhiên, chu trình tổng hợp carotenoid diễn ra theo
16
sơ đồ chung ở thực vật như đã trình bày ở hình 1.1, kết thúc chu trình là ABA. Trong nghiên cứu này, để giúp cây đậu tương có thể tổng hợp astaxanthin, chúng tôi đã chuyển vào đậu tương các gen psy từ ngô và cbfd, hbfd từ Adonis aestivalis qua đó giúp tăng cường con đường tổng hợp β-carotene và chuyển hóa cơ chất này thành astaxanthin.
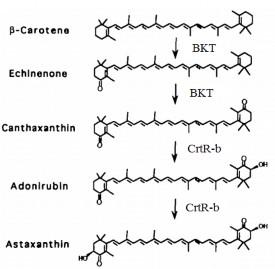
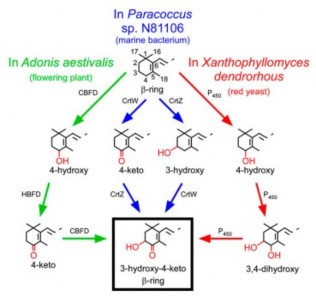
Haematococcus pluvialis
Hình 1.7. Con đường tổng hợp astaxanthin ở một số loài khác nhau [6][57]
1.1.3.5. Chuyển gen tạo astaxanthin vào thực vật
Thực vật biến đổi gen có khả năng sản xuất astaxanthin là một hướng nghiên cứu triển vọng để cung cấp nguồn astaxanthin tự nhiên có nhu cầu ngày càng lớn hiện nay. Để tạo astaxanthin từ β carotene cần sự hoạt động đồng thời của hai enzyme β-carotene ketolase và β-carotene hydroxylase [58]. Hầu hết thực vật đều có khả năng tổng hợp β carotene và có enzyme β-carotene hydroxylase, tuy nhiên khả năng chuyển hóa β-carotene thành astaxanthin chỉ có ở một số loài thuộc chi Adonis [6]. Nhiều nghiên cứu đã tạo được cây tổng hợp astaxanthin thông qua chuyển các gen mã hóa enzyme β-carotene ketolase, β-carotene hydroxylase và một số gen khác giúp tăng cường con đường sinh tổng hợp carotenoid như phytoene synthase, phytoene desaturase. Các gen này có thể từ nhiều nguồn khác nhau như vi khuẩn, nấm men, tảo lục.
Trên thuốc lá, một số nghiên cứu đã chuyển gen thành công vào lục lạp để tạo cây tích lũy astaxanthin. Mann và cộng sự (2000) chỉ chuyển gen mã hóa β- carotene ketolase (CrtO từ Haematococcus pluvialis) đã tạo được cây tích lũy
17
astaxanthin và một số ketocarotenoid không có trong cây đối chứng, hàm lượng ketocarotenoid chiếm 0,2% trọng lượng khô [59]. Hasunuma và cộng sự (2008) chuyển 2 gen mã hóa β-carotene ketolase và β-carotene hydroxylase (CrtW và CrtZ từ vi khuẩn Brevundimonas sp.) tạo được cây thuốc lá tích lũy astaxanthin chiếm 0,5% trọng lượng khô lá [60].
Trên cà chua, Huang và cộng sự (2013) nghiên cứu chuyển các gen mã hóa β-carotene ketolase (từ Chlamydomonas reinhardtii) và β-carotene hydroxylase (từ Haematococcus pluvialis) đã tạo được cây cà chua biểu hiện astaxanthin chiếm 1,6% trọng lượng khô quả [7].
Trên xà lách, Harada và cộng sự (2014) chuyển các gen mã hóa β-carotene ketolase và β-carotene hydroxylase ( từ Brevundimonas sp.) và gen mã hóa enzyme isopentenyl diphosphate isomerase vào lục lạp đã tạo được lá xà lách có hàm lượng astaxanthin 178 µg/g trọng lượng tươi và chiếm 77,4% hàm lượng carotenoid tổng [61].
Trên ngô, Farré và cộng sự (2016) nghiên cứu chuyển các gen mã hóa β- carotene ketolase (từ Chlamydomonas reinhardtii) và β-carotene hydroxylase (từ Brevundimonas sp.) và gen mã hóa enzyme phytoene synthase (từ ngô) đồng thời bất hoạt gen mã hóa enzyme lycopene e-cyclase để hướng tiền chất vào nhánh β, β giúp tăng cường con đường chuyển hóa tạo astaxanthin. Kết quả, các tác giả đã tạo được dòng ngô chuyển gen chứa astaxanthin 16,77 µg/g trọng lượng khô hạt và chiếm 60% tổng carotenoid [31].
Trên lúa gạo, Zhu và cộng sự (2018) nghiên cứu chuyển các gen mã hóa enzymm phytoene synthase (ngô), phytoene desaturase (vi khuẩn Pantoea ananatis), β-carotene ketolase (tảo Chlamydomonas reinhardtii), và β-carotene hydroxylase (tảo Haematococcus pluvialis) tạo được hạt gạo tích lũy astaxanthin 16,23 µg/g trọng lượng khô, chiếm 74% lượng carotenoid tổng [8].
Trên táo, Jia và cộng sự (2019) chuyển gen mã hóa β-carotene ketolase và β- carotene hydroxylase (Haematococcus pluvialis) đã tạo được các dòng táo có hàm lượng astaxanthin 12,06 µg/g và canthaxanthin 6,38 µg/g lá tươi. Các dòng táo chuyển gen có khả năng chống oxy hóa cao và đề kháng với bệnh cháy nắng [62].
Trên đậu tương, Pierce và cộng sự (2015) chuyển các gen mã hóa enzyme β- carotene ketolase (Brevundimonas sp. và Haematococcus pluvialis) và phytoene
synthase (vi khuẩn Pantoea ananatis) đã tạo được hạt đậu tương chứa 52 μg/g canthaxanthin trọng lượng khô. Các tác giả cũng phát hiện astaxanthin trong hạt đậu (2-7 µg/g), điều này chứng tỏ trong đậu tương có enzyme β-carotene hydroxylase nội sinh hoạt động kết hợp với β-carotene ketolase để tạo thành astaxanthin (hình 1.8) [63]. Tuy nhiên, hàm lượng astaxanthin ghi nhận được khá thấp. Con đường chuyển hóa tạo astaxanthin trên cây hoa Adonis aetivalis với sự tham gia của các gen cbfd (carotenoid β-ring 4-dehydrogenase) và hbfd (carotenoid 4-hydroxy-β-ring 4-dehydrogenase) diễn ra mạnh. Ngoài ra, hoạt động liên hợp của hbfd và cbfd cũng có thể giúp nâng cao khả năng tạo astaxanthin nên đây là những gen tiềm năng giúp nâng cao sự tích lũy astaxanthin trong hạt đậu tương nói riêng và trên các đối tượng khác nói chung.
![]()
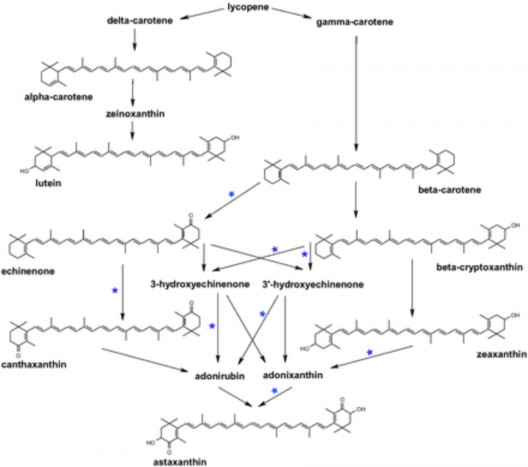
Hình. 1.8. Sơ đồ chuyển hóa tạo astaxanthin trên đậu tương khi được biến nạp các gen mã hóa phytoene synthase và ketolase. (*) hoạt động của enzyme ketolase [63].
1.2. Biến đổi gen thực vật
Hai hệ thống khác nhau có thể được sử dụng để chuyển gen vào thực vật là hệ thống sinh học (gián tiếp): sử dụng vi khuẩn Agrobacterium hoặc vector virus và hệ thống phi sinh học (trực tiếp): vi tiêm, xung điện, siêu âm, bắn gen... Trong đó, phương pháp dùng vi khuẩn Agrobacterium (gián tiếp) và bắn gen (trực tiếp) được sử dụng phổ biến và hiệu quả nhất trên nhiều loài thực vật khác nhau [64][65].
Phương pháp bắn gen được mô tả lần đầu tiên bởi Sanford và cộng sự (1987) [66]. Trong đó, vector biểu hiện bao gồm những gen đích được cố định trên đạn vàng hoặc tungsten. Tiếp theo, sử dụng áp lực tạo bởi khí hydro hoặc nitơ đẩy đạn về phía tế bào đích. Một số đạn mang vector sẽ xuyên qua màng tế bào dẫn đến quá trình gắn chèn gen ngoại lai vào bộ gen tế bào [67]. Trong phương pháp này, những tế bào có khả năng sinh phôi được sử dụng hiệu quả nhất do có độ đồng nhất, khả năng tái sinh cao và có thể được trải đều trên bề mặt để bắn gen. Ưu điểm của phương pháp là có thể áp dụng với nhiều loài, giống, và có hiệu quả chuyển gen cao trên nhiều loại cây trồng quan trọng. Tuy nhiên, hạn chế là chi phí cao, hiệu quả chuyển gen có thể thấp hơn khi dùng Agrobacterium, ngoài ra phân tử DNA chuyển vào tế bào dễ bị đứt gãy, thường tạo nhiều bản copy của gen chuyển trong tế bào đồng thời tạo nhiều dòng có sự biểu hiện của gen chuyển không ổn định [64][68].
1.2.1. Chuyển gen vào thực vật sử dụng Agrobacterium tumefaciens
Phân loại
Giới : Bacterium Ngành : Proteobacteria
Lớp : Alpha Proteobacteria
Bộ : Rhizobiales
Họ : Rhizobiaceae
Chi : Agrobacterium
Loài : Agrobacterium tumefaciens
Trong tự nhiên A. tumefaciens là một loại vi khuẩn đất, gram âm, gây bệnh trên thực vật, chủ yếu ở cây 2 lá mầm với triệu chứng điển hình là tạo thành khối u trên thân, rễ. Trong quá trình gây bệnh, A. tumefaciens chuyển một đoạn DNA của mình vào bộ gen cây [69]. Dựa vào khả năng này, hiện nay A. tumefaciens đã được
sử dụng phổ biến để chuyển nhiều loại gen ngoại lai qui định các đặc tính khác nhau vào thực vật như tính kháng sâu, thuốc diệt cỏ, khả năng khử độc môi trường, gia tăng chất dinh dưỡng, tổng hợp dược phẩm... [70].
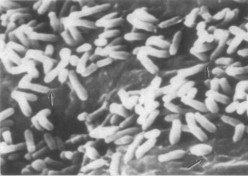

Hình 1.10. Vi khuẩn A. tumefaciens gây khối u trên thực vật [72] |
Có thể bạn quan tâm!
-
 Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 1
Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 1 -
 Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 2
Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 2 -
 Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài
Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài -
 Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs)
Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs) -
 Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ
Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ -
 Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen
Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen
Xem toàn bộ 176 trang tài liệu này.
Cấu trúc giúp A. tumefaciens có khả năng chuyển gen nằm trên Ti-plasmid (Tumour inducing plasmid) với các đặc tính điển hình: kích thước khoảng 200 - 800 kb, dạng vòng xoắn kép [55]. Trong Ti-plasmid có hai vùng quan trọng là vùng T- DNA (transferred DNA) và vùng gây độc (virulence - vir gen). Vùng gen vir gồm những gen mã hóa cho các protein cần thiết cho sự tổng hợp, vận chuyển và hợp nhất của vùng T-DNA vào tế bào chủ. Vùng gen vir có kích thước khoảng 30 - 40 kb, gồm 6 operon quan trọng là: VirA, VirB, VirC, VirD, VirE, VirG và 2 operon khác ít quan trọng hơn là VirF và VirH [73][74].
Vùng T-DNA trên Ti-plasmid đóng vai trò quan trọng trong kỹ thuật chuyển gen sử dụng A. tumefaciens, đây chính là vùng được chuyển vào tế bào thực vật, so với T-DNA tự nhiên, vùng T-DNA sử dụng trong kỹ thuật chuyển gen có nhiều cải biến gồm: sự loại bỏ các gen gây độc tổng hợp auxin, cytokinin, opine và thay thế bởi các gen mong muốn biểu hiện trong thực vật như gen kháng sâu bệnh, chậm chín trái... Đồng thời khi biến nạp với A. tumefaciens, chỉ một số ít tế bào nhận được sự hòa nhập bền vững gen mong muốn vào bộ gen nhân. Do đó cần thiết phải cấu trúc thêm các gen chọn lọc (selectable marker genes) và gen chỉ thị (reporter genes) trong cấu trúc đồng chuyển với gen mong muốn trên T-DNA.
Gen chọn lọc: được sử dụng để chọn lọc thể chuyển gen, mã hóa 1 protein cho phép những tế bào chuyển gen có khả năng phát triển trên môi trường có những hợp chất độc với tế bào không chuyển gen. Gen chọn lọc có thể mã hóa một enzyme