giải độc giúp phân hủy tác nhân chọn lọc, hoặc mã hóa cho một enzyme không nhạy cảm với sự ức chế của tác nhân chọn lọc, enzyme này sẽ thay thế enzyme đã bị biến đổi trong thể chuyển gen. Những gen chọn lọc thường được sử dụng trong các nghiên cứu chuyển gen vào thực vật gồm: nptII, hpt, bar... [75]
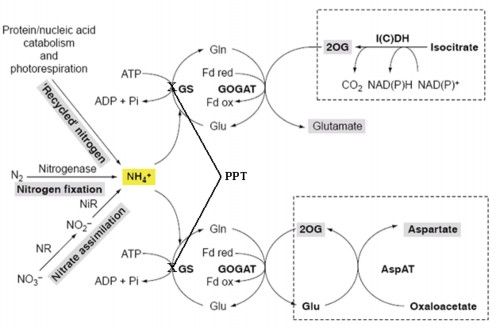
Hình 1.11. Sự ức chế của phosphinothricin lên hoạt động của enzyme glutamine synthetase (GS)
Gen bar được phân lập từ vi khuẩn Streptomyces hygroscopicus mã hóa cho enzyme phosphinothricin acetyl transferase có khả năng phosphoryl hóa và làm mất hoạt tính của phosphinothricin, đây là một loại thuốc diệt cỏ, được bổ sung vào môi trường để sàng lọc thể chuyển gen. Phosphinothricin ức chế enzyme glutamine synthetase (GS) trong tế bào thực vật do đó cản trở tế bào tổng hợp glutamine, đồng thời làm gián đoạn quá trình chuyển hóa NH4+, dẫn đến sự tích lũy amonia trong tế bào thực vật (hình 1.11). Amonia tích tụ nhiều sẽ trở thành chất độc gây chết tế bào thực vật, chỉ những tế bào được chuyển gen bar mới có khả năng bất hoạt phosphinothricin và sống được trên môi trường chọn lọc [76].
Gen chỉ thị: mã hóa sản phẩm thấy được, dùng để phát hiện thể chuyển gen, ví dụ như: gus, luc, gfp, trong đó gus là gen được sử dụng phổ biến nhất trong kỹ thuật chuyển gen thực vật. Gen gus do Jelferson phân lập từ E. coli năm 1986, mã hóa protein β-glucuronidase, là một hydrolase xúc tác sự phân giải các β- glucuronide tạo ra sản phẩm có màu xanh chàm đặc trưng, bền, dễ nhận biết (hình
1.12). β-glucuronide thường dùng nhất để nhận biết sự tồn tại của gen gus là X- Gluc (5-bromo-4-clo-3-indolyl--D-glucoronide).
Có thể bạn quan tâm!
-
 Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 2
Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 2 -
 Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài
Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài -
![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]
Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40] -
 Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ
Nghiên Cứu Phát Sinh Hình Thái Ở Đậu Tương Nghiên Cứu Phát Sinh Hình Thái Chồi Và Rễ -
 Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen
Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen -
 Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen
Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen
Xem toàn bộ 176 trang tài liệu này.

Hình 1.12. Phản ứng của X-Gluc với -glucuronidase [77]
Ưu và nhược điểm của phương pháp chuyển gen thông qua A. tumefaciens
Ưu điểm: Đây là phương pháp chuyển gen tương đối đơn giản, hiệu quả, không cần sử dụng những thiết bị phức tạp, cho phép chuyển những đoạn DNA có kích thước tương đối lớn, ít xảy ra đứt gãy hoặc tái sắp xếp lại trình tự nên các gen có tính toàn vẹn và biểu hiện ổn định ở mức độ cao trong tế bào chủ. Ngoài ra số lượng bản sao của gen biến nạp trong tế bào chủ thường thấp do đó giảm ảnh hưởng đến hoạt động của bộ gen cây chủ.
Nhược điểm: các chủng A. tumefaciens có phạm vi ký chủ tương đối hẹp, chủ yếu là cây hai lá mầm và một số cây một lá mầm. Tuy nhiên, dựa trên những hiểu biết về cơ chế chuyển gen vào tế bào thực vật của A. tumefaciens cùng với sự chọn lọc, cải thiện đối với các dòng A. tumefaciens tự nhiên, phạm vi ký chủ của A. tumefaciens ngày càng được mở rộng [74][78].
1.2.2. Sử dụng promoter trong công nghệ chuyển gen thực vật
Promoter thực vật
Promoter là một phần trong cấu trúc của gen, nằm ở phía thượng nguồn (upstream),
23
giúp điều khiển quá trình khởi đầu phiên mã để tạo các RNA. Về cấu trúc, promoter gồm các vùng chính là vùng lõi (core), vùng cận biên (proximal) và ngoại biên (distal) (hình 1.13). Vùng lõi, thường nằm cách vị trí bắt đầu phiên mã - 40 base pair (bp) về phía thượng nguồn, chứa các trình tự (TATA box, Initiator element) là vùng gắn của những nhân tố phiên mã chung (GTF, general transciption factor) và RNA polymerase, tạo thành phức hợp khởi đầu phiên mã (PIC, preinitiation complex). Những thay đổi ở vùng này sẽ ảnh hưởng lớn đến khả năng phiên mã, biểu hiện của gen. Vùng promoter cận biên thường và ngoại biên thường nằm ở phía thượng nguồn vùng promoter lõi (vùng ngoại biên nằm xa hơn cận biên). Hai vùng này gồm các trình tự nucleotide có chức năng điều hòa phiên mã khác nhau như tăng cường, ức chế, hoạt hóa... Trong quá trình khởi đầu phiên mã, những nhân tố phiên mã gắn với trình tự DNA chuyên biệt có chức năng điều hòa trên promoter đồng thời tương tác với phức hợp khởi đầu phiên mã (PIC). Phức hợp tương tác DNA/protein này giúp hoạt hóa, tăng cường hay ức chế sự phiên mã. Có thể thấy, điều hòa phiên mã phụ thuộc nhiều yếu tố như hoạt động của các nhân tố phiên mã, loại, số lượng, vị trí và sự kết hợp của các yếu tố điều hòa trên promoter [79][80].
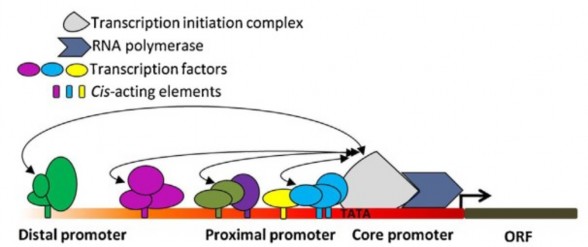
Hình 1.13. Mô hình cơ bản về cấu trúc và điều hòa phiên mã của gen mã hóa protein [79]
Các loại promoter được sử dụng trong công nghệ gen thực vật
Promoter đóng vai trò quan trọng hàng đầu quyết định sự biểu hiện của gen biến nạp trong thực vật chuyển gen, do đó tùy vào yêu cầu, mục đích nghiên cứu cụ thể cần có sự lựa chọn promoter phù hợp. Hiện nay, promoter sử dụng trong công nghệ gen thực vật có nguồn gốc từ nhiều sinh vật khác nhau như: thực vật, vi khuẩn,
vi rút... và được phân thành 4 nhóm chính gồm: promoter liên tục (constitutive promoter), promoter cảm ứng (inducible promoter), promoter chuyên biệt (spatiotemporal promoter) và promoter tổng hợp (synthetic promoter) [80].
Promoter liên tục: là những promoter luôn hoạt động dẫn đến gen biểu hiện liên tục không phụ thuộc loại mô, tế bào, điều kiện môi trường, giai đoạn phát triển. Những promoter này thường có thể hoạt động trên nhiều giống, loài, giới, như promoter của virus khảm súp lơ (CaMV35S), promoter opine, promoter ubiquitin thực vật (Ubi), promoter actin1 của gạo (Act-1)...
Promoter cảm ứng: là những promoter mà hoạt động được cảm ứng bởi các tín hiệu bên trong, bên ngoài tế bào, hay do ảnh hưởng của môi trường. Promoter cảm ứng được ứng dụng phổ biến trong công nghệ di truyền thực vật do sự biểu hiện gen có thể được bật hoặc tắt bởi sự phun các hóa chất hoặc xử lý các tín hiệu vật l , như các stress sinh học, phi sinh học gồm điều kiện sáng tối, nhiệt độ cao, thấp, mầm bệnh, hóa chất (cồn, hormone, kim loại, steroid, kháng sinh...).
Promoter chuyên biệt (vị trí, thời gian: spatiotemporal promoter): điều khiển sự biểu hiện gen trong tế bào, mô, cơ quan chuyên biệt của một sinh vật ở một giai đoạn phát triển cụ thể. Promoter chuyên biệt có thể giúp nâng cao khả năng biểu hiện của gen biến nạp ở một cơ quan nhất định do đó tiết kiệm được năng lượng và dinh dưỡng khi protein đích không cần thiết biểu hiện trên toàn cây. Ngoài ra, điều này cũng nâng cao hơn khía cạnh an toàn sinh học của cây chuyển gen. Nhiều promoter chuyên biệt đã được sử dụng, ly trích từ nhiều nguồn như: glycinin chuyên biệt hạt từ đậu tương, PGNpr2 chuyên biệt phôi từ ngô,...
Promoter tổng hợp là những promoter được thiết kế để kết hợp theo mong muốn những trình tự promoter lõi, vùng promoter cận biên (proximal) và vùng promoter ngoại biên (distal), do đó có thể giúp điều khiển sự biểu hiện gen theo cách không có trong tự nhiên. Promoter tổng hợp có thể được cấu trúc dựa trên sự kết hợp của các yếu tố cis gồm yếu tố tăng cường (enhancer), hoạt hóa (activator) hoặc ức chế (repressor) ở phía thượng nguồn (upstream) của trình tự promoter lõi. Những sắp xếp này có thể giúp promoter tổng hợp điều khiển sự biểu hiện gen một cách chính xác. Ví dụ: promoter CaMV35S có trình tự tăng cường được nhân đôi giúp nâng cao mức độ biểu hiện gen và đã được ứng dụng trong nhiều nghiên cứu [79].
Promoter biểu hiện gen chuyên biệt hạt ở đậu tương
Sự biểu hiện gen chuyên biệt ở hạt có thể giúp nâng cao hàm lượng chất quan tâm trong hạt, đồng thời hạn chế ảnh hưởng của gen biến nạp ở các bộ phận khác trên cây, cũng như đảm bảo sự sinh trưởng, phát triển bình thường của cây chuyển gen. Trong hạt đậu tương, protein chiếm hàm lượng rất cao, khoảng 40% trọng lượng khô, trong đó chủ yếu là glycinin (40% protein tổng) và β-conglycinin (30% protein tổng), có vai trò dự trữ cacbon và nitơ. Gen biểu hiện các protein này hoạt động mạnh, chuyên biệt ở hạt nên promoter của chúng rất phù hợp để điều khiển biểu hiện gen ngoại lai chuyên biệt hạt ở đậu tương nói riêng và các loại cây khác nói chung [81]. Một số nghiên cứu đã ghi nhận được các yếu tố điều hòa biểu hiện gen glycinine như như yếu tố RY (5'- CATGCATG-3') có vai trò quan trọng trong việc điều khiển mức độ biểu hiện gen trong hạt, yếu tố cis "CACA" nằm ở vùng 5' tương tác với yếu tố phôi trong điều hòa biểu hiện gen...[82].
Promoter của gen glycinin đậu tương đã được nhiều nghiên cứu sử dụng để biểu hiện gen ngoại lai trên hạt. Ding và cộng sự (2006) nghiên cứu chuyển gen tổng hợp yếu tố phát triển nguyên bào sợi cơ bản ở người (human basic fibroblast growth factor, bfgf) và gus vào đậu tương sử dụng promoter glycinin và CaMV35S cho các gen biến nạp. Kết quả khi sử dụng promoter glycinin cho cả gen bfgf và gus đều cho thấy sự biểu hiện chuyên biệt của gen (mRNA, protein) ở hạt, không có sự biểu hiện của các gen này trên các bộ phận khác của cây. Ngoài ra, khi so sánh mức độ biểu hiện cũng cho thấy promoter glycinin giúp tăng khả năng tổng hợp protein so với promoter liên tục điển hình là CaMV35S (trung bình 1,2% so với 0,04%) [81]. Moravec và cộng sự (2007) sử dụng promoter glycinine cũng đã biểu hiện được hàm lượng cao protein tái tổ hợp LB toxin của vi khuẩn E. coli trong hạt đậu tương chiếm 2,4% protein tổng số trong hạt, trong khi sử dụng promoter CaMV35S ở đậu tương chỉ thu được lượng protein tái tổ hợp cao nhất là 0,5% protein tổng [83]. Như vậy, các kết quả này chỉ ra rằng promoter glycinin có thể giúp biểu hiện gen ngoại lại ở mức độ cao và chuyên biệt ở hạt đậu tương, do đó là promoter tiềm năng có thể được ứng dụng khi cần biểu hiện gen chuyên biệt ở hạt đậu tương.
1.2.3. Sự di truyền của gen biến nạp trong cây chuyển gen
Gen biến nạp có thể được di truyền cho thế hệ sau theo qui luật Mendel. Thông thường, chuyển gen thông qua vi khuẩn Agrobacterium số bản sao thấp và gen biến nạp di truyền theo qui luật Mendel. Trong khi phương pháp bắn gen thường tạo nhiều bản sao và hay xảy ra sự tái sắp xếp của cấu trúc đoạn DNA biến nạp. Sự di truyền của gen biến nạp không theo Mendel có tần số khoảng 10-50%. Những đoạn DNA đa gen được biến nạp vào bộ gen cây thường liên kết hoàn toàn và di truyền theo kiểu một locus đơn. Nhiều yếu tố có thể ảnh hưởng đến sự di truyền của gen biến nạp như bản chất của bộ gen cây nhận, gen biến nạp, tương tác giữa chúng. Một số biến đổi đã được ghi nhận ở những loci của gen biến nạp như: mất gen, nhân đôi, tái sắp xếp, tái tổ hợp, tương tác gen… [84].
Tỉ lệ phân ly của gen biến nạp (tính trạng) theo qui luật di truyền Mendel ở thế hệ T1 khi có 1, 2, 3 bản sao của gen biến nạp được chèn vào bộ gen cây là 3:1, 15:1, 63:1. Qui luật này có thể được kiểm tra thông quan phân tích χ2 so sánh giữa giá trị thực tế và lý thuyết [85]. Ngoài ra, khi lai cây chuyển gen với đối chứng để nhận được cây F1 có tỉ lệ phân ly theo Mendel là 1:1 hoặc 3:1 tương ứng với 1 hay 2 bản sao của gen biến nạp được chèn vào bộ gen cây [86]. Các tính trạng biểu hiện ở cây chuyển gen như kháng kháng sinh, kháng thuốc diệt cỏ… hoặc sự hiện diện
của gen (thông qua PCR) có thể được sử dụng để kiểm tra tỉ lệ phân ly của gen biến nạp [85][86][87].
Một số nguyên nhân dẫn đến sự di truyền không theo qui luật Mendel
Bản chất bộ gen nhận có thể ảnh hưởng đến sự biểu hiện và ổn định của gen biến nạp. Ví dụ: sự thiếu ổn định của gen biến nạp có thể do những yếu tố di chuyển (transposable elements) trong bộ gen cây ngô.
Khả năng sống của giao tử: vị trí chèn của gen biến nạp có thể ảnh hưởng đến khả năng sống của giao tử dẫn đến những bất thường trong tỉ lệ phân ly. Limanton- Grevet và Jullien (2001) ghi nhận tỉ lệ phân ly 1:1 của tính kháng kanamycin và biểu hiện GUS, điều này là do vị trí chèn của gen biến nạp ảnh hưởng đến sức sống của giao tử cái, dẫn đến gen biến nạp chỉ được di truyền qua giao tử đực [88].
Sự bất thường của nhiễm sắc thể: hiện tượng methyl hóa gen biến nạp, các đột biến mất đoạn, lặp đoạn liên quan đến sự gắn chèn gen ảnh hưởng đến sự di truyền, ổn định của gen biến nạp [89].
Sự bắt cặp chéo trong nguyên phân và mất ổn định trong giảm phân: sự trao đổi chéo trong nguyên phân có thể dẫn đến sự đồng hợp tử của gen chuyển ở thế hệ T0 [90]. Ngoài ra, quá trình giảm phân cũng có thể dẫn đến sự mất gen biến nạp ở thế hệ sau [91].
1.3. Nghiên cứu phát sinh hình thái và biến đổi gen đậu tương
Đậu tương là cây trồng bị ảnh hưởng lớn bởi mầm bệnh, sâu hại và stress môi trường. Do đó, cải tạo giống đậu nhằm nâng cao năng suất và chất lượng hạt đậu là nhu cầu cần thiết. Tuy nhiên, cải tạo giống bằng các phương pháp truyền thống gặp nhiều khó khăn do đậu tương là cây tự thụ phấn và nguồn gen của các giống đậu tương ngày nay không phong phú, do hầu hết đều có cùng nguồn gốc chung. Việc ứng dụng các kỹ thuật hiện đại như chuyển gen, lai giống hỗ trợ bởi marker phân tử... đã giúp tạo nhiều giống mới với các đặc tính ưu việt. Thực tế, hiện nay phần lớn diện tích trồng đậu tương sử dụng cây biến đổi gen [92][93].
1.3.1. Giới thiệu chung về cây đậu tương
Phân loại

Tên khoa học: Glycine max (L.) Merrill Bộ: Fabales
Họ: Fabaceae Chi: Glycine Loài: Glycine max
Hình 1.14. Cây đậu tương
Cây đậu tương có nguồn gốc từ Trung Quốc, được trồng đầu tiên từ khoảng năm 1700 trước công nguyên (hình 1.14). Ở Việt Nam, đậu tương cũng đã được trồng từ hàng ngàn năm nay. Do có khả năng thích nghi rộng nên đậu tương được trồng ở khắp nơi trên thế giới. Tuy nhiên, hiện nay chỉ một số nước đóng vai trò
28
cung cấp chính cho toàn thế giới là Mỹ, Brazil, Argentina, Trung Quốc (hình 1.15) [94][95].
Năm
Hình 1.15. Sản lượng của 6 nước sản xuất đậu tương lớn nhất [94]
Đậu tương là cây thân thảo, ít phân cành, thân cây đậu tương có hình tròn, nhiều lông, mang nhiều đốt, thân thường đứng, có khi bò hay nửa bò. Mỗi cây có từ 8 - 14 đốt tùy loại hình sinh trưởng hữu hạn hoặc vô hạn. Lá kép, mỗi lá kép có 3 lá chét, đôi khi có 4 - 5 lá chét, lá có dạng dài, hẹp hình lưỡi mác hoặc hình thoi. Hoa rất bé dài khoảng 0,6 - 0,7 cm màu tím, tím nhạt hoặc trắng. Đậu tương là cây có hoa hoàn toàn tự thụ phấn. Quả đậu tương thuộc loại quả giáp, có nhiều lông, khi chín biến màu vàng hoặc xám. Mỗi quả có từ 1 - 4 hạt. Khối lượng hạt rất đa dạng từ 20 - 400 mg/hạt. Thời gian sinh trưởng có 3 loại: chín sớm (75 - 85 ngày), trung bình (80 - 100 ngày), muộn (110 - 120 ngày) [96].
Hạt đậu tương có thành phần dinh dưỡng cao, hàm lượng protein trung bình khoảng 35 - 40%, lipid từ 15 - 20%, carbonhydrate từ 15 - 16% theo trọng lượng khô. Protein trong đậu tương có phẩm chất tốt nhất trong số các protein của thực vật với đầy đủ và cân đối các loại acid amin cần thiết. Ngoài ra, trong hạt đậu tương còn chứa nhiều loại vitamin: B1, B2, PP, A, E, K, D, C…, khoáng chất: Ca, P, Fe..., các chất chuyển hóa hoạt động sinh l như isoflavone, lecithin, tocopherol và saponin, hơn nữa hạt đậu tương có chứa hàm lượng dầu cao hơn các loại đậu đỗ khác nên được coi là cây cung cấp dầu thực vật quan trọng. Ở nước ta, đậu tương là



![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](https://tailieuthamkhao.com/uploads/2022/12/28/nghien-cuu-tao-cay-dau-tuong-glycine-max-l-bien-doi-gen-co-kha-nang-tong-4-1-120x90.jpg)


