61
bước này hai lần, rồi rửa gel bằng nước cất. Tiếp theo, trung hoà gel trong dung dịch trung hòa, lắc nhẹ 15 phút trong khi ngâm gel, lặp lại hai lần bước này. Dung dịch 20X SSC được đổ vào khay có miếng kiếng thủy tinh đặt trên thành khay, dùng giấy thấm phủ lên tấm kiếng và hai đầu giấy nhúng vào dung dịch 20X SSC. Để gel vào trên giấy thấm, phủ màng Hypond-N đã thấm ướt bằng dung dịch 20X SSC lên trên miếng gel sao cho không có bọt khí. Đặt tiếp 3 miếng giấy thấm 3MM (đã thấm ướt bằng dung dịch 20X SSC) có kích thước bằng miếng gel lên trên màng, rồi phủ một chồng giấy thấm lên phía trên. Cuối cùng, đặt một vật nặng lên trên cùng và để qua đêm.
Chuẩn bị mẫu dò (Probe): Mẫu dò là trình tự DNA 500 bp đã được tinh sạch của gen cbfd2 tạo ra từ phản ứng PCR. Mẫu dò cho thang chuẩn HindIII cũng được thực hiện cùng với mẫu dò cho gen cbfd2. DNA mẫu dò được pha loãng với nước trong bộ kit để có nồng độ 10 ng/µl. Sau đó, biến tính 10 µl DNA (100 ng DNA) trong nước đang sôi 5 phút. Tiếp theo, làm lạnh trên đá trong 5 phút và ly tâm để DNA xuống đáy. Thêm 10 µl dung dịch đệm phản ứng (reaction buffer) và 2
µl dung dịch đánh dấu (labelling reagent), trộn đều nhẹ. 10µl dung dịch cross linker được thêm vào, rồi trộn đều và ly tâm để DNA xuống đáy. Cuối cùng, hỗn hợp được ủ ở 37oC trong 30 phút. Probe có thể dùng ngay hoặc giữ trên đá trong 2 giờ, giữ đến 6 tháng trong 50% glycerol ở -20oC.
Lai DNA: Dung dịch lai được làm nóng trước trong buồng lai (Techne) lên 55oC ít nhất 15 phút. DNA được gắn chặt trên màng bằng cách xử lý màng trong máy UVP TL – 2000 Ultra violet Translinker với thời gian 30 giây mỗi mặt. Sau đó, bỏ màng lai vào ống lai và lai qua đêm ở 55oC.
Rửa mẫu sau lai DNA: dung dịch rửa 1 được làm nóng lên 55oC. Sau đó,
cho dung dịch rửa 1 vào ống lai chứa màng (2-5ml/cm2 màng), đặt vào máy lai trong 10 phút ở nhiệt độ 55oC, lặp lại thêm một lần. Tiếp theo, lấy màng ra cho vào hộp sạch có chứa dung dịch rửa 2, lắc nhẹ trong thời gian 5 phút, lặp lại thêm một lần.
Phát hiện DNA bằng cơ chất: Màng được lấy ra khỏi dung dịch rửa 2, đặt lên miếng plastic. Sau đó, cho dung dịch phát hiện (RPN 3682) lên màng (30-40
µl/cm2) và ủ khoảng 5 phút. Tiếp theo, đặt miếng plastic khác lên trên, loại bỏ dung
62
dịch phát hiện còn dư, vuốt nhẹ cho hết bọt khí. Cuối cùng, hiện phim bằng Amersham HyperfilmTM ECL (GE Healthcare) với thời gian khác nhau.
2.2.14. Phân tích hàm lượng astaxanthin trong hạt
Astaxanthin trong hạt đậu tương được định tính và định lượng bằng phương pháp sắc ký lỏng ghép khối phổ (HPLC-MS) thực hiện tại Trung tâm phân tích trường Đại học Khoa học Tự nhiên tp. HCM.
Hạt đậu tương được sấy khô đến khối lượng không đổi ở 50oC sau đó nghiền
nhuyễn rồi ly trích carotenoid tổng. Tiếp theo, mẫu được phân tích định tính và định lượng astaxanthin theo qui trình của Trung tâm phân tích trường Đại học Khoa học Tự nhiên Tp. HCM dựa trên hệ thống sắc ký lỏng siêu cao áp Agilent 1900 (USA) và hệ thống khối phổ MS/MS phân giải cao 6500 series Q-TOF (Agilent). Tất cả các dữ liệu được ghi và xử lý trên phần mềm Masshunter quanlitative analysis
B.07.00 của Agilent.
Điều kiện chạy sắc ký: pha động gồm pha A là H2O chứa 0.1 % acid formic, pha B là 95% ACN chứa 0.1 % acid formic. Pha tĩnh là cột Waters spherusorb S5 C8 (2.0 150mm), được ổn nhiệt ở 40 0C. Mẫu được tiêm vào cột với thể tích 10 µl. Tốc độ dòng pha động là 0.5 ml/phút.
2.2.15. Đánh giá các giai đoạn sinh trưởng cây chuyển gen trong điều kiện ex vitro
Đánh giá kiểu hình qua các giai đoạn phát triển: Cây chuyển gen và đối chứng được trồng ở cùng điều kiện trong vườn ươm. Theo dõi, ghi nhận sự phát triển kiểu hình, năng suất hạt trong quá trình phát triển của cây. Sau đó, so sánh để xem xét sự gắn chèn của các gen biến nạp có ảnh hưởng lớn tới sự sinh trưởng, phát triển của cây.
Điều kiện nhà trồng cây chuyển gen (vườn ươm), qui trình làm việc đảm bảo an toàn sinh học cây biến đổi gen: Cây chuyển gen trồng trong điều kiện nhà kín để hạn chế sự phát tán các vật liệu, sinh vật biến đổi gen ra môi trường bên ngoài. Nhà kín làm bằng vật liệu polycacbonate trong, giúp trao đổi ánh sáng tự nhiên với bên ngoài. Nhiệt độ trong phòng được điều chỉnh ở 27-28oC. Nhà kín nằm bên trong nhà lưới, giúp tạo thêm cách ly vật lý với bên ngoài bằng lưới ngăn côn trùng. Để đảm
bảo không phát tán vật liệu biến đổi gen ra ngoài môi trường, trong quá trình thí
nghiệm, không mang các dụng cụ thí nghiệm ra ngoài khu vực nhà kín. Sau khi thí nghiệm, toàn bộ vật liệu liên quan đến cây biến đổi gen (thân, lá...) được hấp tiệt trùng ở 121oC/20 phút. Các dụng cụ được rửa sạch bằng chất tẩy Javel, xà phòng.
Chỉ tiêu theo dõi: chiều cao cây, đường kính thân, số nhánh cây, số lượng hạt, đường kính hạt, trọng lượng hạt.
Cách tính đường kính hạt: Đường kính hạt = (chiều dài + chiều rộng + độ dày)/3 [158]. Chiều dài, chiều rộng, độ dày hạt xác định như hình 2.3.
Chiều rộng Độ dày
Chiều dài
Hình 2.3. Minh họa kích thước theo chiều dài, rộng, dày của hạt đậu tương Cách tính đường kính thân: đường kính thân xác định bằng cách đo đường
kính đoạn thân trong khoảng từ nhánh 1 đến nhánh 2.
Đánh giá tính kháng thuốc trừ cỏ Basta của cây đậu tương chuyển gen:
Cây đậu tương chuyển gen có mang gen kháng glufosinate, hợp chất chính trong thuốc trừ cỏ Basta. Do đó, kiểm tra tính kháng của cây với Basta giúp xác định khả năng biến nạp cũng như biểu hiện của gen chuyển. Thử nghiệm quét dung dịch Basta ở nồng độ gây chết (100 mg/l glufosinate) lên mặt trên lá cây chuyển gen và đối chứng được thực hiện khi cây khoảng 1 tháng tuổi. Thuốc trừ cỏ Basta (100 mg/l glufosinate) được chuẩn bị bằng cách pha loãng từ nồng độ gốc 200 g/l glufosinate, bổ sung thêm 50 µl tween 20 trong 50 ml dung dịch. Kết quả được ghi nhận sau 7 ngày.
Chỉ tiêu theo dõi: sự mất màu diệp lục, hình thái lá.
2.2.16. Xử lý thống kê
Các nghiệm thức được bố trí theo kiểu đơn yếu tố, hoàn toàn ngẫu nhiên, lặp lại ba lần. Số liệu được xử lý bằng phần mềm SPSS 16.0, kiểm tra mức độ khác biệt giữa các nghiệm thức bằng phương pháp LSD hoặc Duncan với P ≤ 0,05. Các số liệu là tỉ lệ phần trăm biến động từ 0 - 100% được chuyển đổi sang dạng Arcsin√x và số chồi/mẫu, số rễ/chồi sang dạng Log(x+1) trước khi xử lý thống kê [159].
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
Nội dung 1: Xây dựng hệ thống tạo cây con hoàn chỉnh in vitro từ đốt lá mầm và một nửa hạt.
3.1. Tuyển chọn các giống đậu tương
Bảy giống đậu tương đã được thu thập, trong đó các giống MTĐ 176; MTĐ 760-4; MTĐ 860-3; MTĐ 885-1; HL 07-15; OMĐN 29 là các giống lai đã được thuần hóa, giống Edamame là giống nhập từ Nhật có hạt to dùng để ăn trực tiếp hạt non.
Phân tích hàm lượng β-carotene trong hạt của các giống đậu tương đã thu thập bằng phương pháp HPLC cho thấy ở tất cả các giống đều có sự hiện diện của β-carotene, tuy nhiên với hàm lượng thấp, trong đó giống MTĐ 176 có hàm lượng 1,97 µg/g (bảng 3.1).
Nhiều nghiên cứu phân tích hàm lượng β-carotene trong các giống đậu tương khác nhau cũng ghi nhận hàm lượng khá thấp của loại carotenoid này trong hạt đậu tương, trong nghiên cứu của Panwar và cộng sự 2015, ghi nhận hàm lượng β- carotene của giống Pusa (Ấn Độ) bằng HPLC, chỉ đạt 0,02 µg/g; nghiên cứu của Schmidt và cộng sự (2015) trên giống Jack đạt 0,5 µg/g [160][161]. Gần đây, nghiên cứu của Gebregziabher và cộng sự (2021) khi phân tích hàm lượng β- carotene trên các giống đậu tương Trung Quốc bằng HPLC đã ghi nhận hàm lượng lớn hơn nằm trong khoảng 3,25-6,61 µg/g [162]. Như vậy, mặc dù hàm lượng β- carotene có sự thay đổi giữa các giống đậu tương khác nhau nhưng nhìn chung sự tích lũy β-carotene trong hạt đậu tương khá thấp. Tuy nhiên, do β-carotene là tiền chất để tổng hợp astaxanthin nên việc tăng cường con đường tổng hợp β-carotene là điều cần thiết trong chiến lược thu nhận astaxanthin. Trong nghiên cứu này, gen mã hóa enzyme phytoene synthase sẽ được chuyển vào đậu tương để tăng cường sinh tổng hợp phytoene, là tiền chất có thể thúc đẩy chuỗi chuyển hóa nhằm tổng hợp β- carotene ở mức độ cao hơn.
Các giống trong bộ giống đậu thu thập được đều ghi nhận có sự hiện diện của β-carotene nên đủ điều kiện để thực hiện chuyển gen theo chiến lược đã đề ra. Tuy nhiên để đảm bảo sự ổn định và hiệu quả trong quá trình thí nghiệm, các hạt giống được kiểm tra tỉ lệ nảy mầm bằng cách gieo trên giấy thấm ướt đặt trong đĩa petri.
ảng 3.1. Kiểm tra thành phần β-carotene ở các giống đậu tương.
MTĐ176 | MTĐ 760-4 | MTĐ 860-3 | MTĐ 885-1 | Edamame | HL 07-15 | OMĐN 29 | |
β-carotene | 1,97 µg/g | Dương tính | Dương tính | Dương tính | Dương tính | Dương tính | Dương tính |
Có thể bạn quan tâm!
-
 Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen
Chuyển Gen Vào Đậu Tương Bằng Phương Pháp Bắn Gen -
 Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen
Kim Châm Để Tạo Vết Thương Cho Mẫu Chuyển Gen -
 Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt
Ảnh Hưởng Của Ppt Lên Khả Năng Tái Sinh Của Đốt Lá Mầm Và Một Nửa Hạt -
 Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy.
Sự Hình Thành Chồi Của Đốt Lá Mầm Giống Mtđ 176 Ở Các Nồng Độ Ba Khác Nhau Sau 3 Tuần Nuôi Cấy. -
 Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt.
Sự Tái Sinh Của Đốt Lá Mầm Giống Mtđ 176 Trên Môi Trường Có Ppt. -
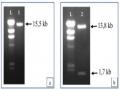
 Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli
Tạo Dòng Agrobacterium Tumefaciens Eha 105 Chứa Plasmid Pitb-Ast Ly Trích, Kiểm Tra Plasmid Pitb-Ast Từ E. Coli
Xem toàn bộ 176 trang tài liệu này.

Kết quả ghi nhận tỉ lệ nảy mầm cho thấy 4 giống MTĐ 176, HL 07-15; OMĐN 29 và Edamame có tỉ lệ nảy mầm cao (96-97%), 3 giống MTĐ 760-4; MTĐ 860-3; MTĐ 885-1 có tỉ lệ nảy mầm thấp hơn (89-92%) (bảng 3.2). Ngoài ra, lá mầm của giống Edamame dễ bị nứt, vỡ nên không thích hợp dùng cho các thí nghiệm cấy mô, chuyển gen (hình 3.1). Từ các kết quả này, hạt của 3 giống MTĐ 176, HL 07-15; OMĐN 29 được chọn để sử dụng trong các nghiên cứu tiếp theo của đề tài. Trong đó giống MTĐ 176 được Trần Thị Cúc Hòa (2008) ghi nhận có khả năng chuyển gen cao [163].
ảng 3.2. Tỉ lệ nảy mầm ở các giống đậu tương
MTĐ 176 | MTĐ 760-4 | MTĐ 860-3 | MTĐ 885-1 | Edamame | HL 07-15 | OMĐN 29 | |
Tỉ lệ nảy mầm (%) | 96 | 90 | 89 | 92 | 96 | 97 | 96 |
1 cm
a
b
c
d
e
f
g
Hình 3.1. Hạt đậu tương nảy mầm sau 5 ngày
a, b, c, d, e, f tương ứng với hạt đậu tương các giống MTĐ 860, MTĐ 760-4, MTĐ 885-1, Edamame, HL 07-15, OMĐN 29, MTĐ 176
3.2. Hiệu quả của các phương pháp khử trùng hạt đậu tương
Phương pháp xử lý hạt đậu tương với khí clo hoặc dung dịch Javel 50% ở các khoảng thời gian khác nhau đã được khảo sát. Với các nghiệm thức khử trùng bằng dung dịch Javel 50%, kết quả cho thấy thời gian xử lý mẫu có ảnh hưởng đến hiệu quả khử trùng và khả năng nảy mầm của hạt (bảng 3.3). Ở thời gian xử lý 30 phút, vẫn còn mẫu nhiễm. Khi tăng thời gian khử trùng lên 40 phút và 50 phút đã tạo được mẫu sạch 100%, tuy nhiên tỉ lệ mẫu nảy mầm giảm đáng kể ở cả hai giống HL 07-15 và OMĐN 29. Nghiệm thức tối ưu khi khử trùng bằng dung dịch Javel 50% tương ứng với thời gian xử lý 40 phút có tỉ lệ hạt nảy mầm giảm còn 75% (HL07- 15) và 77,78% (OMĐN 29).
Các nghiệm thức khử trùng bằng khí clo trong 16 hoặc 24 giờ đều tạo mẫu sạch 100%. Với thời gian xử lý 16 giờ nhận được tỉ lệ nảy mầm cao nhất là 94,44% (HL 07-15) và 91,67% (OMĐN 29), khi tăng thời gian xử lý lên 24 giờ làm giảm rõ rệt tỉ lệ nảy mầm (hình 3.2). Ngoài ra, khử trùng bằng khí clo giúp hạt nảy mầm đồng đều, thời gian nảy mầm ngắn, sau 5-6 ngày cây mầm vươn dài, lá mầm tách vỏ và chuyển màu xanh. Khử trùng bằng dung dịch Javel 50% làm thời gian cây nảy mầm chậm hơn 1-2 ngày, cây nảy mầm không đều. Nhiều nghiên cứu trên các giống đậu tương khác nhau cũng ghi nhận thời gian khử trùng bằng clo phù hợp là khoảng 16 giờ [111][125][164], có thể kéo dài đến 24 giờ [126][165]. Thời gian khử trùng tối ưu có thể còn phụ thuộc vào điều kiện của hạt (mức độ sạch ban đầu, điều kiện bảo quản hạt...), tuy nhiên để đảm bảo tỉ lệ hạt nảy mầm, sức sống cây mầm, thời gian hạt tiếp xúc khí clo không nên kéo dài. Kết quả ghi nhận ở thí nghiệm này cho thấy thời gian khử trùng hạt chỉ nên giới hạn ở khoảng 16 giờ. Khử trùng hạt là bước chuẩn bị mẫu đầu tiên trong thí nghiệm chuyển gen, đóng vai trò quan trọng ảnh hưởng đến sự ổn định và thành công của các bước tiếp theo. Ở giai đoạn này, mẫu hạt phải được khử trùng hoàn toàn đồng thời khả năng nảy mầm, sức sống của hạt không bị ảnh hưởng nhiều, từ đó đảm bảo được khả năng tái sinh, tạo chồi cao của mẫu ở thí nghiệm tái sinh. Các yếu tố này sẽ góp phần quyết định sự thành công của quá trình tạo mẫu, cây chuyển gen.
Tóm lại, khử trùng bằng khí clo trong thời gian 16 giờ được chọn áp dụng cho các giống đậu tương trong nghiên cứu nhằm tạo ra nguồn nguyên liệu sạch, có sức sống, khả năng nảy mầm tốt và đồng đều giúp cho các thí nghiệm có thể bố trí ổn định, độ đồng nhất cao và hiệu quả. Thí nghiệm sử dụng hai giống HL 07-15 và OMĐN 29, kết quả tối ưu được áp dụng cho giống MTĐ 176.
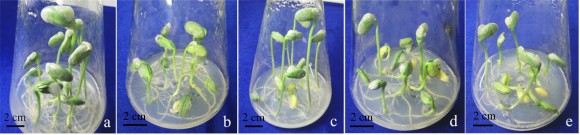
Hình 3.2. Hạt đậu tương (HL 07-15) nảy mầm 5 ngày sau khi khử trùng .
a. khí clo 16 giờ, b. Khí clo 24 giờ, c. Dung dịch Javel 50% 30 phút, d. Dung dịch Javel 50% 40 phút, e. Dung dịch Javel 50% 50 phút
ảng 3.3. Tỉ lệ hạt đậu tương không nhiễm và nảy mầm khi khử trùng bằng dung dịch Javel hoặc khí clo.
Tỉ lệ hạt không nhiễm (%) | Tỉ lệ hạt không nhiễm nảy mầm (%)1 | |||
HL 07-15 | OMĐN 29 | HL 07-15 | OMĐN 29 | |
Khí clo, 16 giờ | 100 | 100 | 94,44 a | 91,67 a |
Khí clo, 24 giờ | 100 | 100 | 52,78 c | 66,67 bc |
Javel 50%, 30 p | 97,22 | 94,44 | 83,33 b | 86,11 a |
Javel 50%, 40 p | 100 | 100 | 75,00 b | 77,78 ab |
Javel 50%, 50 p | 100 | 100 | 52,78 c | 50,00 c |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 theo kiểm định thống kê LSD. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x trước khi xử lý thống kê.
3.3. Ảnh hưởng của BA lên sự tái sinh của đốt lá mầm và một nửa hạt
Nghiên cứu khả năng cảm ứng tạo chồi bất định của BA ở các nồng độ khác nhau được thực hiện trên 3 giống MTĐ 176, HL 07-15, OMĐN 29 với 2 qui cách mẫu đốt lá mầm (QC1) và một nửa hạt (QC2).
Nhìn chung sự cảm ứng chồi của BA với hai loại mẫu của cả ba giống đậu tương khảo sát khá giống nhau (bảng 3.4, 3.5, 3.6). Ở các nghiệm thức đối chứng không bổ sung BA, tất cả mẫu đều không tạo chồi, một số mẫu hình thành rễ. Trên môi trường bổ sung từ 0,5 đến 2 mg/l BA, khả năng tạo chồi của mẫu đốt lá mầm và một nửa hạt đều tăng dần theo nồng độ BA. Ở nồng độ 2 mg/l BA, cả 2 loại mẫu của ba giống đều có mức tạo chồi tối ưu về tỉ lệ mẫu tạo chồi (trên 90%) và số chồi trung bình/mẫu, giống MTĐ 176 (QC1: 4,83; QC2: 5,13); HL 07-15 (QC1: 5,17;
QC2: 5,30); OMĐN (QC1: 5,03; QC2:5,10), chồi hình thành đồng đều, ít mô sẹo (hình 3.3, 3.5, 3.6, 3.7). Khi tăng nồng độ BA lên 2,5-3 mg/l, ở giống MTĐ 176 khả năng tạo chồi của mẫu giảm cả về tỉ lệ mẫu tạo chồi và số chồi trung bình/mẫu; giống HL 07-15 và OMĐN 29 tuy tỉ lệ mẫu tạo chồi không thay đổi nhiều nhưng số chồi trung bình/mẫu giảm dần. Đồng thời, ở cả ba giống, hình thái chồi nhận được không đồng đều, nhiều mẫu có mô sẹo trắng xốp hình thành (hình 3.4).
ảng 3.4. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống MTĐ 176
Tỉ lệ mẫu tạo chồi (%)1 | Số chồi/mẫu2 | |||
QC1 | QC2 | QC1 | QC2 | |
0 | 0,00 e | 0,00 e | 0,00 f | 0,00 f |
0,5 | 33,33 d | 36,67 d | 0,6 ± 0,17 e | 0,67 ± 0,15 e |
1 | 40,00 d | 43,33 d | 1,07 ± 0,21 d | 1,20 ± 0,26 d |
1,5 | 63,33 c | 73,33 c | 2,20 ± 0,36 c | 2,63 ± 0,35 c |
2 | 93,33 a | 96,67 a | 4,83 ± 0,59 a | 5,13 ± 0,57 a |
2,5 | 90,00 a | 86,67 b | 4,03 ± 0,40 a | 4,00 ± 0,36 b |
3 | 76,67 b | 73,33 c | 2,90 ± 0,36 b | 2,43 ± 0,32 c |
Các chữ cái khác nhau (a, b, c…) trên cùng một cột biểu diễn sự khác biệt có ý nghĩa với P ≤ 0,05 trong phép thử Duncan. Số liệu (1) đã được chuyển đổi sang dạng arcsin√x; số liệu (2) được chuyển sang dạng log(x+1) trước khi xử lý thống kê.