qua hệ thống cảm ứng tạo rễ tơ trên đậu tương trong các nghiên trước đây. Jacobs và đồng tác giả sử dụng hệ thống này để tạo đột biến gen ngoại lai (gfp) ở rễ tơ trên giống đậu tương Jack và ghi nhận tỉ lệ đột biến khoảng 95% [80]. Trong khi đó, Cai và đồng tác giả đã thành công trong gây tạo đột biến hai gen trong hệ gen đậu tương với tỉ lệ chỉnh sửa gen dao động từ 1,3% tới 30% [59].Trong nghiên cứu của chúng tôi được trình bày ở mục 3.2.2, cấu trúc CRISPR/Cas9 được thiết kế theo định hướng tạo đột biến trên hai gen GmGOLS03và GmGOLS19trong hệ gen đậu tương. Toàn bộ mẫu rễ tơ được kiểm tra đều xuất hiện băng vạch DNA sai khác khi phân tích đột biến thông qua điện di, khẳng định hiệu quả chỉnh sửa hệ gen rất cao thông qua cảm ứng tạo rễ tơ trên giống đậu tương ĐT26.
4.2 Việc lựa chọn trình tự mục tiêu trong thiết kế cấu trúc chỉnh sửa gen trên đậu tương
Đã có nhiều nghiên cứu thành công trong việc sử dụng hệ thống CRISPR/Cas9 có cùng một gRNA định hướng gây đột biến đồng thời hai hoặc nhiều gen tương đồng trên một số dòng cây đa bội [80] [58], đặc biệt ứng dụng thành công ở đậu tương điển hình như nghiên cứu của Yo và cộng sự (2020) đã chỉnh sửa đa gen (GmF3H1, GmF3H2 và GmFNSI ‐1) nhằm cải thiện hàm lượng isoflavone và khả năng kháng virus khảm [67]. hay nghiên cứu loại bỏ gen GmJAG1 thực hiện bởi nhóm nghiên cứu của Zhandong Cai (2021) nhằm cải tạo tính chống chịu nhiệt tăng năng suất giống đậu tương Huachun 6 trồng ở khu vực có vĩ độ thấp [65]. Căn cứ trên cơ sở khoa học của các nghiên cứu trước đây ở lúa gạo, cà chua và đậu tương, chúng tôi đã phát triển phức hệ gRNAs kép có khả năng tạo ra các vết cắt lớn, với độ chính xác cao đảm bảo loại bỏ đúng đoạn gen mục tiêu, đồng thời có thể dễ dàng xác định kết quả thông qua phương pháp điện di trên gel [87] [95-96]. Với những tiêu chí này, chúng tôi đã lựa chọn và xác định được một đoạn trình tự ngắn với vị trí nhắm sát 2 đoạn gen mục tiêu GmGOLS03 và GmGOLS19. Các vị trí mục tiêu này được đảm bảo giống hệt nhau và được giới hạn bởi ở vùng exon 2 trong cả hai gen đã chọn. Các vị trí được nhắm mục tiêu được thiết kế mang 23-25 cặp base, tương đối ngắn so với các nghiên cứu trước đây đã sử dụng các gRNA kép để phân cắt các vị trí mục tiêu ở khoảng cách xa. Kết quả là khoảng cách ngắn giữa các vị trí phân cắt đã làm tăng độ cắt chính xác của protein Cas9. Kết quả nghiên cứu được trình bày trong mục 3.3.3. của luận án.
Cụ thể, đối với trình tự mục tiêu dài tỉ lệ chỉnh sửa gen đạt 83,3% đối với gen
GmGOLS03 và 63,3% đối với gen GmGOLS19 ở ba dòng chuyển gen thế hệ T0 (Hình 3.14). Trong khi đó, với đoạn trình tự mục tiêu chứa ít hơn 5 nucleotide thì chỉnh sửa gen giảm mức rất thấp, chỉ đạt 3,3% ở gen GmGOLS03 và 10% ở gen GmGOLS19; kết quả này phù hợp các báo cáo trước đó [97-98]. Kết quả nghiên cứu của luận án một lần nữa khẳng định tầm quan trọng của việc lựa trình tự cắt cách mục tiêu (target) đối với các vị trí cắt đồng thời trong việc chỉnh sửa gen bằng hệ thống CRISPR/Cas9.
4.3 Khả năng xuất hiện đột biến định hướng muộn thông qua hệ thống chỉnh sửa gen CRISPR/Cas9
Thông thường, khi cấu trúc chỉnh sửa hệ gen CRISPR/Cas9 được chuyển vào tế vào thực vật, họat động của hệ thống này sẽ gây tạo đột biến định hướng. Các đột biến này có thể được phát hiện và xác định ở các dòng cây tái sinh. Tuy nhiên, việc tồn tại và hoạt động của hệ thống chỉnh sửa gen trong tế bào cây chủ có thể gây tạo các đột biến ở giai đoạn tiếp theo, thậm chí là ở các thế hệ tiếp theo của các dòng cây mang cấu trúc chỉnh sửa gen. Điều này được chúng tôi phát hiện và phân tích trong nghiên cứu này, kết quả được thể hiện trong mục 3.4.
Đối với dòng đột biến DT1.1, tất cả các alen tìm thấy ở thế hệ T1 đều được quan sát thấy ở thế hệ T0 (Hình 3.14 và 3.16). Ngoài ra, những đột biến này được di truyền ổn định sang thế hệ T2. Tuy nhiên, đối với giống Marverick các cây T1 có nguồn gốc từ cây dòng chuyển gen thế hệ T0 dòng M3.1 và dòng M4.1 lại mang một số alen đột biến không được tìm thấy ở thế hệ T0 (Hình 3.14 và 3.16). Chứng tỏ, trên cây đậu tương việc chỉnh sửa gen tạo bằng CRISPR/Cas9 tạo được đột biến ở thế hệ T0, nhưng không phải lúc nào các đột biến của thế hệ T0 cũng di truyền sang thế hệ T1, kết quả nghiên cứu của luận án giống với kết quả nghiên cứu của Kanazashi và Kurtin đã công bố [58] [99]. Các mâu thuẫn trong kết quả của luận án có thể do sự hoạt động CRISPR xảy ra một cách độc lập muộn trong giai đoạn phát triển của cây T0, tạo ra đột biến khảm ở một số mô dùng phân tích và những mô khác cũng có nhưng chưa được xác định. Và các đột biến trong các mô chưa xác định có thể được di truyền ở các cây T1. Hiện tượng này trước đây đã được Kanazashi và cộng sự chứng minh, trong đó phân tích DNA của từng mẫu riêng lẻ được thực hiện và các alen quan sát được của chúng phù hợp với các hạt mang đột biến [58]. Phương pháp này có thể ứng dụng để nghiên cứu chỉnh sửa bộ gen trên đậu tương và một số loài
Có thể bạn quan tâm!
-
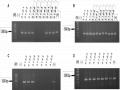
 Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2
Sàng Lọc Các Dòng Đậu Tương Chỉnh Sửa Gen Qua Các Thế Hệ T1 Và T2 -
 Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2
Kết Quả Phân Tích Sản Phẩm Pcr Của Chỉ Thị Phân Tử Gols-Seg F1 Và Gols-Seg F3 Với Các Cây Đột Biến T2 -
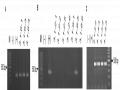
 Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương
Tỉ Lệ Carbohydrate Dạng Stachyose Và Sucrose Trên Tổng Khối Lượng Carbohydrate Hòa Tan Trong Hạt Đậu Tương -
 Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 14
Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 14 -
 Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 15
Nghiên cứu ứng dụng công nghệ CRISPR/Cas9 trong tạo đột biến gen GmGOLS03, GmGOLS19 trên cây đậu tương Glycine max L. Merrill nhằm giảm lượng đường họ Raffinose trong hạt - 15
Xem toàn bộ 122 trang tài liệu này.
thực vật phức tạp khác trong tương lai.

4.4 Đột biến gen GmGOLS và sự nảy mầm của hạt đậu tương
RFOs được chứng minh còn có vai trò trong sự nảy mầm hạt do năng lượng từ carbonhydrat dự trữ trong hạt được cho là cần thiết cho sự nảy mầm. Cụ thể là các nhà khoa học đã kiểm tra sự nảy mầm của hạt đậu khi bỏ sự trao đổi raffinose and stachyose, kết quả là sự nảy mầm đã bị chậm đáng kể [18]; nghiên cứu của Obendorf chỉ ra rằng các dòng đậu tương có lượng raffinose, stachyose, và phytin thấp nhạy cảm với nhiệt độ thấp, ẩm [100]. Một số nghiên cứu về thực vật có hàm lượng cao raffinose trong điều kiện sinh trưởng bình thường đã cho thấy khả năng chịu hạn và chịu lạnh cao hơn các loại cây hoang dại [101-102]. Ví dụ như ở cây Arabidopsis, sự tích lũy của raffinose rất quan trọng đối với stress khô hạn để duy trì vách tế bào và ổn định protein tế bào [37]. Tuy nhiên, trong nghiên cứu của Dierking và Bilyeu đánh giá sự nảy mầm của hạt bằng các phương pháp khác nhau với nước hoặc DGJ, kết quả đã chỉ ra sự giảm hàm lượng RFOs không ảnh hưởng đáng kể sự nảy mầm của hạt đậu tương [103]. Cùng kết quả thí nghiệm về tỉ lệ nảy mầm hạt đậu tương dòng SGUL có hàm lượng raffinose và stachyose siêu thấp là 83% so với dòng đậu tương chứa hàm lượng raffinose and stachyose trung bình là 100% [57]. Điều này chứng tỏ RFOs không phải là nguồn năng lượng thiết yếu trong quá trình nảy mầm của hạt đậu tương.
Trong nghiên cứu này của luận án, một thí nghiệm về độ nảy mầm trong môi trường nước đã được thực hiện, kết quả được trình bày trong mục 3.5.2. Hạt của cây đột biến có hàm lượng đường sucrose và raffinose thay đổi cho thấy không có sự khác biệt đáng kể về sức sống của hạt so với hạt giống của cây đối chứng. Kết quả nghiên cứu của luận án cho thấy những thay đổi trong thành phần đường có trong hạt đậu tương của các dòng đột biến GmGOLS không ảnh hưởng đến sức khỏe và khả năng nảy mầm của hạt, kết quả này phù hợp với các nghiên cứu đã được công bố.
4.5 Đột biến gen GmGOLS ảnh hướng đến sự thay đổi của hàm lượng cacbohydrat có trong hạt
Các kết quả nghiên cứu khoa học trước đây đã chỉ ra rằng đột biến tự nhiên hay tác động vào RNA trung gian tạo nên sự bất hoạt của nhóm gen tổng hợp raffinose synthase ở cây đậu tương đã làm hàm lượng RFOs ở mức thấp [14-15] [104]. Trong nghiên cứu của luận án, hai gen GmGOLS mã hóa cho galactinol synthase - một loại
enzyme đầu tiên tham gia vào quá trình sinh tổng hợp raffinose trong và có vai trò quan trọng trong con đường chuyển hóa RFOs [31] [105] bị gây đột biến bởi hệ thống CRISPR/Cas9. Kết quả nghiên cứu được chúng tôi trình bày ở mục 3.5.3 cho thấy: hạt của các dòng đậu tương mang đột biến GmGOLS có tổng hàm lượng RFOs giảm so với hạt của cây đối chứng không mang đột biến. Thành phần của RFOs (như: raffinose, sucrose, stachyose, verbascose...) có sự thay đổi. Cụ thể là hàm lượng raffinose tăng lên đến 65% trong khi stachyose và verbascose đều giảm tới 45%. Trong hạt đậu tương, stachyose là thành phần chính của RFOs, thế nên ở các dòng mang đột biến gen GmGOLS có tổng lượng RFOs trong hạt giảm 30,2% ở thể đột biến đơn và 35,2% ở thể đột biến kép. Ngoài ra, đối với những dòng mang đột biến kép (gen GmGOLS03 và gen GmGOLS19) có hàm sucrose giảm một cách đáng kể, nhưng đối với đột biến đơn gen GmGOLS03 lại không cho kết quả tương ứng.
Dòng đậu tương PI 200508 được biết đến như dòng đậu tương điển hình có hàm lượng stachyose và raffinose thấp [104]. Sử dụng dòng này, Dierking và Bilyeu đã chứng minh raffinose synthase 2 (RS2) là gen có mang alen PI200508 [14], việc loại bỏ RS2 đã làm giảm hàm lượng stachyose ba lần và giảm 5 lần lượng raffinose cũng như tăng 50% hàm lượng sucrose trong hạt của cây trồng trong nhà kính [15].
Trong nghiên cứu này chúng tôi nhận thấy việc đột biến gen GmGOLS gây ảnh hưởng lớn đến sự tích tụ đường sucrose, raffinose và stachyose. Đáng ghi nhận nhất là sự gia tăng hàm lượng của đường raffinose, và sự giảm đồng thời hàm lượng stachyose, điều cho thấy mối liên hệ giữa chức năng của GmGOLS và rafinose tuy chưa rõ ràng nhưng điều này đã được các nhà khoa học lưu tâm trước đó. Các nghiên cứu trong tương lai hứa hẹn sự giải thích rõ hơn về mối tương quan của hàm lượng các carbohydrate được tạo ra theo phương thức chuyển gen với một số chất trung gian như myo-inositol và galactinol và có thể kết hợp kiểu gen gây bệnh được biết đến.
Khi chúng tôi so sánh về RFOs có nguồn gốc từ các dòng mang đột biến đơn gen GmGOLS03 và đột biến kép (GmGOLS03, GmGOLS19) đã nhận thấy một số khác biệt kiểu hình có thể được cho là do GmGOLS19 mất chức năng. Tuy nhiên không có sự khác biệt về hàm lượng RFOs của hai dạng đột biến trên. Tổng hợp các dữ liệu nghiên cứu, chúng tôi nhận thấy rằng gen GmGOLS03 có thể có những ảnh hưởng quan trọng hơn đối với sự tổng hợp RFOs. Ở các dòng đột biến hàm lượng RFOs vẫn được tạo ra một lượng đáng kể trong hạt, điều này có thể giả định do hoạt
tính của enzyme Galactinol synthase vẫn hoạt động, do enzyme này được mã hoá bởi các gen khác thuộc nhóm gen GmGOLS có biểu hiện trong hạt. Cụ thể là Glyma.19G227800 và Glyma.10G145300. Ý tưởng loại bỏ bổ sung các gen này (trong nền đột biến kép của chúng tôi) dự kiến sẽ tạo sự tác động đáng kể đến kiểu hình trong sinh tổng hợp RFO.
4.6. Tiềm năng trong chọn tạo giống đậu tương trong nước thông qua hệ thống chỉnh sửa hệ gen
Đậu tương là cây trồng có khả năng chỉnh sửa và biến đổi gen hiệu quả. Các báo cáo trước đây cho thấy những thành công về chuyển gen chỉ đạt ở một số giống đậu tương nhất định như William 82, Jack, Thorne và Mr [97] [106-107]. Trong luận án này chúng tôi đã thành công trong việc tạo giống đậu tương biến đổi gen bằng kỷ thuật chỉnh sửa bộ gen từ giống đậu tương ưu tú của Việt Nam (ĐT26). Các dòng đột biến không mang gen chuyển và đồng hợp tử mang gen chuyển được quan sát ở thế hệ T2 cho thấy tiềm năng của việc ứng dụng phương pháp chuyển gen gián tiếp bằng Agrobacterium kết hợp hệ thống CRISPR/Cas9 trong cải biến các giống đậu tương ưu tú khác cũng như một số giống cây trồng quan trọng.
KẾT LUẬN VÀ KIẾN NGHỊ
KẾT LUẬN
1. Hai gen GmGOLS03 và GmGOLS19 được lựa chọn để gây tạo đột biến làm giảm hoạt động của enzyme galactinol synthase trên cây đậu tương dựa vào việc phân tích trình tự và mức độ biểu hiện gen. Cấu trúc chỉnh sửa gen CRISPR/Cas9 mang hai trình tự định hướng gRNA đã được thiết kế thành công để gây tạo đột biến trên hai gen GmGOLS03 và GmGOLS19. Cấu trúc này được gắn vào vector chuyển gen với hệ chọn lọc sử dụng thuốc trừ cỏ.
2. Hệ thống cảm ứng rễ tơ in vitro đã được thiết lập trên hai giống đậu tương ĐT22 và ĐT26 của Việt Nam với hiệu suất cao (71%- 79,8%). Các hệ thống cảm ứng rễ tơ này đã được áp dụng thành công trong đánh giá hiệu quả chuyển gen và biểu hiện của các gen chỉ thị gus và gfp. Tỉ lệ chuyển gen ghi nhận ở mức 72,33% đối với gen gus và 79,8% với gen gfp. Hệ thống này đã được ứng dụng để kiểm tra hoạt động của cấu trúc CRISPR/Cas9 trong việc gây tạo đột biến trên hai gen GmGOLS03 và GmGOLS19 trên các dòng rễ tơ của giống đậu tương nghiên cứu. Tỉ lệ gây tạo đột biến trên các dòng rễ tơ ghi nhận ở mức trên 80%.
3. Cấu trúc chỉnh sửa gen CRISPR/Cas9 đã hoạt động hiệu trong việc tạo các đột biến trên cả 2 gen GmGOLS03 và GmGOLS19 của hai giống đậu tương Maverick và ĐT26 . Các đột biến này nằm chính xác trong vùng định hướng gây tạo đột biến cho thấy sự hoạt động chính xác của hệ thống vector chỉnh sửa gen.
4. Các dòng đậu tương mang đột biến định hướng ở dạng đồng hợp tử của đơn gen hoặc cả hai gen GmGOLS03 và GmGOLS19 đã được xác định sự di truyền qua các thế hệ bằng kỹ thuật PCR.
5. Hạt của các dòng đậu tương mang đột biến đồng hợp tử một hoặc cả hai gen GmGOLS03 và GmGOLS19 có hàm lượng đường khó tiêu họ raffinose giảm đáng kể (giảm từ 30,2% đến 34,1%), hàm lượng đường succrose tăng lên (tăng từ 48% đến 51%) so với cây đậu tương giống gốc không mang đột biến. Ở một số dòng đậu tương đột biến (DT1.1-7-2, DT1.1-14-3) ghi nhận sự tăng lên đáng kể hàm lượng protein trong hạt. Tuy nhiên, không ghi nhận sự khác biệt về hình thái, khả năng sinh trưởng và phát triển của các dòng cây đậu tương đột biến so với cây giống gốc.
6. Các đột biến đồng hợp tử đơn gen hoặc cả hai gen GmGOLS, có hàm lượng
đương họ raffinose thấp và không mang gen chuyển đã được xác định ở thế hệ T2 của dòng đậu tương đột biến có nguồn gốc từ giống ĐT26. Các phân tích không ghi nhận đột biến ngoài định hướng (off-targets) trên các dòng đậu tương đột biến triển vọng này.
KIẾN NGHỊ
Tiếp tục đánh giá sinh trưởng, phát triển, năng suất và chất lượng hạt của các dòng đậu đột biến trong điều kiện đồng ruộng từ đó lựa chọn các dòng tiềm năng cho công tác phát triển các giống đậu tương mới phục vụ sản xuất.
Mở rộng việc ứng dụng công nghệ chỉnh sửa gen CRISPR/Cas9 nhằm giảm hàm lượng đường khó tiêu rafinose của các giống đậu tượng tiềm năng trong nước đồng thời phát triển trong cải tạo các tính trọng quý khác của cây đậu tương.
TÀI LIỆU THAM KHẢO
1. Ngô Thế Dân, Trần Đình Long, Trần Văn Lài, Đỗ Thị Dung và Phạm Thị Đào,
Cây đậu tương, Nhà xuất bản Nông nghiệp, Hà Nội, 1999, 24 - 23.
2. FAO, 2019. [Online]. Available: http://iasvn.org/chuyen-muc/Tinh-hinh-san- xuat,-tieu-thu-dau-nanh-tren-the-gioi-11444.html.
3. Tổng cục thống kê Việt Nam, Niên Giám Thống Kê Tóm Tắt – 2020 (Statistical summary book), Hà Nội, 2020, 300. https://www.gso.gov.vn/du-lieu-va-so- lieu-thong-ke/2021/07/nien-giam-thong-ke-tom-tat-2020/.
4. Trần Văn Lài, Thu thập và đánh giá nguồn vật liệu di truyền đậu đỗ 1991 – 1995, Tạp chí Nông nghiệp và Phát triển nông thôn, 1995, 21, 5-6.
5. Trần Duy Quý, Các phương pháp mới trong chọn tạo giống cây trồng, Nhà xuất bản Nông nghiệp, Hà Nội, 1999, 17 – 18.
6. Y. Hwang, Y. Nakamoto et al., Genetic diversity of cultivated and wild soybeans including Japanese elite cultivars as revealed by length polymorphism of SSR markers, Breeding Science, 2008, 58, 3, 315 –323.
7. Nguyễn Lộc Hiền, Trần Thanh Xuyên và cộng sự, Sự đa dạng di truyền của các giống đậu tương rau Nhật Bản, Tạp chí Khoa học 2010. Đại học Cần Thơ, 2017, 16, 51-59.
8. K. B. Hari, et al., Engineering soybean for enhanced sulfur amino acid content,
Crop Science, 2005, 45, 454 – 461.
9. A. M. Cabrejas, F.M. Disaz, et al., Influence of germination on the soluble carbohydrates and dietary fibre fractions in non-conventional legumes, Food Chemical, 2008, 107, 1045-1052.
10. N.C. Coon, L.K. Leske, et al., Effect of oligosaccharide-free soybean meal on true metabolizable energy and fiber digestion in adult roosters, Poultry Science, 2009, 6, 787–793.
11. A. Hou, P. Chen, et al., Sugar Variation in Soybean Seed Assessed with a Rapid Extraction and Quantification Method, Int J Agron, 2009, 1-8.