DANH MỤC CÁC BẢNG
Bảng 2.1. Nguồn gốc và một số đặc điểm của các giống đậu tương được sử dụng. 46
Bảng 2.2. Thành phần các loại môi trường nuôi cấy mô và chuyển gen 47
Bảng 3.1. Kiểm tra thành phần β-carotene ở các giống đậu tương. 65
Bảng 3.2. Tỉ lệ nảy mầm ở các giống đậu tương 65
Bảng 3.3. Tỉ lệ hạt đậu tương không nhiễm và nảy mầm khi khử trùng bằng dung dịch Javel hoặc khí clo. 67
Bảng 3.4. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống MTĐ 176 68
Bảng 3.5. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống HL 07-15 70
Bảng 3.6. Ảnh hưởng của các nồng độ BA lên sự tái sinh của đốt lá mầm và một nửa hạt giống OMĐN 29 71
Có thể bạn quan tâm!
-
 Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 1
Nghiên cứu tạo cây đậu tương Glycine max L. biến đổi gen có khả năng tổng hợp astaxanthin chuyên biệt ở hạt - 1 -
 Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài
Đối Tượng, Phạm Vi Và Nội Dung Nghiên Cứu Của Đề Tài -
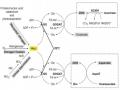
![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]
Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40] -
 Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs)
Sự Ức Chế Của Phosphinothricin Lên Hoạt Động Của Enzyme Glutamine Synthetase (Gs)
Xem toàn bộ 176 trang tài liệu này.
Bảng 3.7. Ảnh hưởng của IBA đến khả năng tạo rễ của chồi đậu tương in vitro 75
Bảng 3.8. Ảnh hưởng PPT lên sự tái sinh chồi của đốt lá mầm. 76

Bảng 3.9. Ảnh hưởng của PPT lên khả năng sống của chồi in vitro 78
Bảng 3.10. Kết quả khảo sát ảnh hưởng của việc sử dụng kim châm lên khả năng tái sinh của đốt lá mầm 80
ảng 3 11 Tỉ lệ mẫu dương tính GUS khi xử l sóng siêu âm ở các thời gian khác nhau 82
ảng 3 12 Tỉ lệ đốt lá mầm dương tính GUS khi xử l áp lực âm ở các thời gian khác nhau. 84
Bảng 3.13. Kết quả thu nhận hạt của các dòng chuyển gen D2 và D8 ở thế hệ T1103 Bảng 3.14. Kết quả định lượng astaxanthin trong hạt của các dòng chuyển gen ...106 Bảng 3.15. So sánh một số đặc điểm của cây chuyển gen và đối chứng. 109
DANH MỤC CÁC HÌNH VẼ, ĐỒ THỊ
Hình 1.1. Sơ đồ con đường sinh tổng hợp carotenoid [19] 9
Hình 1.2. Bột astaxanthin [36] 11
Hình 1.3. So sánh khả năng chống gốc oxy tự do có hại cho cơ thể của một số chất chống oxy hóa [43] 12
Hình 1.4. Vị trí của phân tử astaxanthin trong màng tế bào [40] 13
Hình 1.5. Qui mô thị trường astaxanthin đến năm 2022 [4] 13
Hình 1.6. Con đường chuyển hoá tạo astaxanthin ở Adonis aestivalis [6] 15
Hình 1.7. Con đường tổng hợp astaxanthin ở một số loài khác nhau [6][57] 16
Hình. 1.8. Sơ đồ chuyển hóa tạo astaxanthin trên đậu tương khi được biến nạp các gen mã hóa phytoene synthase và ketolase [63]. 18
Hình 1.9. Vi khuẩn A. tumefaciens bám trên bề mặt tế bào thực vật [71] 20
Hình 1.10. Vi khuẩn A. tumefaciens gây khối u trên thực vật [72] 20
Hình 1.11. Sự ức chế của phosphinothricin lên hoạt động của enzyme 21
Hình 1.12. Phản ứng của X-Gluc với -glucuronidase [77] 22
Hình 1.13. Mô hình cơ bản về cấu trúc và điều hòa phiên mã của gen mã hóa protein [79] 23
Hình 1.14. Cây đậu tương 27
Hình 1.15. Sản lượng của 6 nước sản xuất đậu tương lớn nhất [94] 28
Hình 1.16. Cấu trúc plasmid pITB-AST 45
Hình 2.1. Sơ đồ các bước chuẩn bị mẫu đốt lá mầm 51
Hình 2.2. Sơ đồ các bước chuẩn bị mẫu một nửa hạt 52
Hình 2.3. Minh họa kích thước theo chiều dài, rộng, dày của hạt đậu tương 63
Hình 3.1. Hạt đậu tương nảy mầm sau 5 ngày 65
Hình 3.2. Hạt đậu tương (HL 07-15) nảy mầm 5 ngày sau khi khử trùng 67
Hình 3.3. Sự hình thành chồi của đốt lá mầm giống MTĐ 176 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy. 69
Hình 3.4. Sự đáp ứng của đốt lá mầm và một nửa hạt của giống MTĐ 176 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy. 69
Hình 3.5. Sự hình thành chồi của mẫu một nửa hạt giống MTĐ 176 ở các nồng
độ BA khác nhau sau 3 tuần nuôi cấy. 70
Hình 3.6. Sự hình thành chồi của đốt lá mầm giống HL 07-15 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy. 71
Hình 3.7. Sự hình thành chồi của đốt lá mầm giống OMĐN 29 ở các nồng độ BA khác nhau sau 3 tuần nuôi cấy. 72
Hình 3.8. Sự tạo rễ của chồi in vitro của các giống MTĐ 176, HL 07-15 và OMĐN 29 ở các nồng độ IBA khác nhau sau 3 tuần nuôi cấy. 74
Hình 3.9. Sự tái sinh của đốt lá mầm giống MTĐ 176 trên môi trường có PPT. 77
Hình 3.10. Sự sinh trưởng đoạn thân giống MTĐ 176 trên môi trường có PPT. 79
Hình 3.11. Ảnh hưởng của số lần châm đến khả năng tái sinh của đốt lá mầm giống MTĐ 176 80
nh 3 12. Mẫu dương tính GUS khi xử l sóng siêu âm ở các thời gian khác nhau. 82
nh 3 13 Mẫu dương tính GUS khi xử l áp lực âm ở các thời gian khác nhau. 83
Hình 3.14. Kết quả điện di sản phẩm cắt plasmid ly trích từ E. coli 85
Hình 3.15. Các khuẩn lạc vi khuẩn Agrobacterium tumefaciens biến nạp sau khi
ủ qua đêm trên môi trường có kháng sinh. 86
Hình 3.16. Kết quả điện di sản phẩm PCR gen hbfd1 từ plasmid của vi khuẩn E. coli và A. tumefaciens. 86
Hình 3.17. Vật liệu chuyển gen và các giai đoạn phát triển cây chuyển gen. 88
Hình 3.18. Kiểm tra sự hiện diện của gen bar ở các cây kháng PPT bằng PCR 89
Hình 3.19. Kiểm tra sự hiện diện của gen hbfd1 ở các cây kháng PPT bằng PCR. .90
Hình 3.20. Kết quả phân tích DNA cây đậu tương chuyển gen bằng Southern blot 91
Hình 3.22. Kiểm tra sự hiện diện của gen bar ở các cây kháng PPT bằng PCR 95
Hình 3.23. Kiểm tra sự hiện diện của gen cbfd2 ở các cây kháng PPT bằng PCR..96 Hình 3.24. Kiểm tra sự hiện diện của gen hbfd1 ở các cây kháng PPT bằng PCR. .97 Hình 3.25. Kiểm tra sự hiện diện của gen Zm-psy ở các cây kháng PPT bằng
PCR. 97
Hình 3.26. Kết quả phân tích DNA cây đậu tương chuyển gen bằng Southern blot 99
Hình 3.27. Lá cây đối chứng và chuyển gen sau 7 ngày quét dung dịch Basta 100
Hình 3.28. Dòng chuyển gen D2 (a) và D8 (b) phát triển ngoài vườn ươm 101
Hình 3.29. Hạt màu đỏ của dòng D2 và D8 101
Hình 3.30. Các giai đoạn phát triển của cây chuyển gen trồng từ hạt 102
Hình 3.31. Kết quả điện di sản phẩm PCR gen biến nạp ở các dòng T1. 102
Hình 3.32. Thử nghiệm quét Basta trên lá cây chuyển gen và đối chứng. 103
Hình 3.33. Các hạt chuyển gen biểu hiện màu đỏ không đồng đều 104
Hình 3.34. Hạt của các dòng chuyển gen T2 105
Hình 3.35. Phổ ESI-MS của chuẩn astaxanthin 107
108
Hình 3.36. Phổ ESI-MS của mẫu ly trích từ hạt dòng D2-1 108
Hình 3.37. Phổ ESI-MS của mẫu ly trích từ hạt dòng D8-1 108
Hình 3.38. So sánh kiểu hình cây chuyển gen và cây đối chứng. 110
TÓM TẮT
Hiện nay, ứng dụng công nghệ gen để cải tạo giống cây trồng, tạo giống đã và đang đạt được nhiều thành tựu với ngày càng nhiều giống cây mới được tạo ra, đưa vào sản xuất. Một trong những ưu điểm nổi bật của công nghệ này là trong thời gian ngắn so với lai tạo giống truyền thống, giúp tạo được giống mới với nhiều đặc tính vượt trội, có thể gồm những đặc tính từ các sinh vật khác loài. Trong nghiên cứu này, chúng tôi hướng tới tạo giống đậu tương mang các gen ngoại lai từ cây hoa Adonis aestivalis nhằm tạo được astaxanthin, một hợp chất có giá trị kinh tế và ứng dụng cao, chuyên biệt ở hạt. Phương pháp chuyển gen thông qua vi khuẩn A. tumefaciens được sử dụng để chuyển vào đậu tương cấu trúc gen gồm: gen cbfd, hbfd đóng vai trò chuyển hóa β-carotene thành astaxanthin; gen zm-psy từ ngô giúp tăng cường con đường tổng hợp β-carotene, gen chọn lọc bar, với chất chọn lọc là phosphinothricin (PPT). Nhiều yếu tố được khảo sát nhằm tối ưu con đường nuôi cấy mô, chọn lọc thể chuyển gen, và nâng cao hiệu quả chuyển gen. Các khảo sát cụ thể gồm: khảo sát các phương pháp khử trùng hạt bằng khí clo và nước Javel; tìm nồng độ BA thích hợp để cảm ứng tạo chồi cho mẫu đốt lá mầm, một nửa hạt; nồng độ IBA thích hợp để cảm ứng tạo rễ cho chồi in vitro; nồng độ PPT tối ưu cho giai đoạn chọn lọc chồi và duy trì áp lực chọn lọc ở giai đoạn tạo rễ, phát triển cây; phương pháp tạo vết thương mẫu thích hợp sử dụng dao mổ, kim châm nhiều mũi, sóng siêu âm, thấm hút chân không. Sau đó, kết quả tối ưu từ các thí nghiệm này được áp dụng cho giai đoạn chuyển gen tạo astaxanthin vào đậu tương. Thể chuyển gen trong nghiên cứu được xác định bước đầu bằng phương pháp PCR, tiếp theo khẳng định sự gắn chèn bền vững của gen bằng phương pháp Southern blot. Các dòng chuyển gen phát triển trong vườn ươm sẽ được thử nghiệm tính kháng thuốc diệt cỏ Basta, nhằm kiểm tra biểu hiện của gen bar trong cây chuyển gen. Sự di truyền của gen biến nạp qua các thế hệ được kiểm tra bằng PCR và thử nghiệm với Basta. Hàm lượng astaxanthin trong hạt đậu tương được ghi nhận bằng phương pháp HPLC-MS. Ngoài ra, cây chuyển gen ở thế hệ T0, T1 và cây đối chứng không chuyển gen cũng được so sánh các chỉ tiêu kiểu hình và năng suất hạt. Những kết quả chính đạt được như sau. Thu thập được 7 giống đậu tương, các giống này được kiểm tra và xác nhận có sự hiện diện của β-carotene trong hạt bằng HPLC, đây là cơ
chất ban đầu, điều kiện cần thiết để tổng hợp astaxanthin. Các giống đậu tương MTĐ 176, HL 07-15 và OMĐN 29 được ghi nhận có khả năng nảy mầm cao, sức sống tốt, lá mầm không bị nứt, vỡ nên được chọn cho các nghiên cứu tiếp theo. Khảo sát khử trùng hạt đậu tương bằng khí clo trong 16 h cho thấy hiệu quả khử trùng tốt nhất. Mẫu đốt lá mầm và một nửa hạt được cảm ứng tạo chồi tốt nhất với môi trường bổ sung 2 mg/l BA, chồi tạo rễ tốt nhất khi bổ sung IBA 1 mg/l với giống MTĐ 176; HL 07-15 và 1,5 mg/l với giống OMĐN 29, chất chọn lọc PPT ở nồng độ 6 mg/l phù hợp để chọn lọc thể chuyển gen với giống MTĐ 176 và 5 mg/l cho giống HL 07-15; OMĐN 29. Các kết quả khảo sát tạo vết thương mẫu cho thấy sử dụng phương pháp tạo vết thương mẫu thích hợp giúp tăng đáng kể hiệu quả chuyển gen, cụ thể với khả năng biến nạp cấu trúc gen tạo astaxanthin vào giống đậu tương MTĐ 176: dùng kim châm đâm nhẹ 3 lần để thay thế dao mổ tạo vết thương cho vùng đốt lá mầm đã tăng hiệu quả chuyển gen từ 0,33% lên 1%; kết hợp sử dụng sóng siêu âm 30s; thấm chân không 60s ở áp lực -20 in Hg trong quá trình tạo vết thương mẫu đốt lá mầm cũng giúp tăng hiệu quả chuyển gen từ 0,67 % lên 2%. Nghiên cứu đã tạo được nhiều dòng đậu tương chuyển gen, trong đó hai dòng có khả năng sản xuất astaxanthin chuyên biệt ở hạt và di truyền gen chuyển cho các thế hệ tiếp theo. Hàm lượng astaxanthin trong hạt thế hệ T1 của hai dòng đậu tương chuyển gen lần lượt là 0,31 µg/g (D2) và 0,77 µg/g (D8). Trong các giai đoạn sinh trưởng, phát triển cũng như năng suất hạt cho thấy cây chuyển gen và đối chứng không có nhiều khác biệt. Như vậy, đề tài đã tạo được các dòng đậu tương có khả năng sản xuất astaxanthin ở hạt, làm cơ sở cho các nghiên cứu tiếp theo để ứng dụng tạo các sản phẩm có giá trị ứng dụng thực tế.
ABSTRACT
Currently, application of gene technology to improve plant varieties has been achieving many achievements with more and more new plant varieties being created and put into production. One of outstanding advantages of this technology is that in a short time compared to conventional crossbreeding, it helps to create new varieties with many superb characteristics, which may include those from other organisms. In this study, we aimed to produce soybean lines carrying foreign genes
3
from the red flowered-Adonis aestivalis to produce seed-specific astaxanthin, a compound with high economic and application value.
Method of Agrobacterium-mediated genetic transformation was used to transfer into soybean the genetic structure including: cbfd, hbfd gene, play the role of converting β-carotene into astaxanthin; zm-psy gene from corn, enhances the synthesis of β- carotene; bar-selective gene, with the selective agent phosphinothricin (PPT). Many factors were investigated to optimize tissue culture pathways, selection of transgenics, and transformation efficiency. Specific surveys include: methods of sterilizing seeds with chlorine gas and Javel detergent; appropriate concentrations of BA to induce shoot regeneration for cotyledonary node, half seed explant; suitable concentrations of IBA to induce rooting of in vitro shoots; optimal concentrations of PPT for transgenic shoot selection and maintenance of selective pressure at rooting and plant development stages; appropriate method of wounding explants using scalpel, multi-needle, ultrasound, vacuum infiltration. The optimal results from these experiments were then applied to generate transgenic soybean lines producing astaxanthin. Transformants in this study were initially determined by PCR, followed by the confirmation of stable insertion of the transgenes by Southern blot method. Transgenic lines grown in greenhouse will be tested for resistance to Basta herbicide, to check the expression of bar gene in transgenic plants. Inheritance of transgenes across generations was checked by PCR and herbicide leaf painting assay. Astaxanthin content in soybean seeds was analyzed by HPLC-MS method. In addition, the transgenic plants in the T0, T1 generation and the non-transgenic control plants were also compared for phenotypic parameters and seed yield. The main results obtained are as follows. Collected 7 soybean varieties, these varieties were tested and confirmed for the presence of β-carotene in seeds by HPLC, which is the initial substrate, necessary condition for astaxanthin synthesis. Soybean varieties MTD 176, HL 07-15 and OMDN 29 were recorded with high germination ability, good vigor, and cotyledons were not cracked or broken, so they were selected for further studies. Sterilizing of soybean seeds with chlorine gas for 16 h showed the best sterilization effect. Cotyledonary node and half seed explants were best induced to produce shoots in the medium supplemented with 2 mg/l BA;
The best rooting efficiency was achieved in 1 mg/l IBA with the MTD 176; HL 07-
15 varieties and 1.5 mg/l for OMDN 29 variety; PPT selective agent at a concentration of 6 mg/l is suitable for selecting transformants with variety MTD 176 and 5 mg/l for HL 07-15; OMDN 29. The results of the appropriate wounding survey showed that using proper explant wounding method significantly increased efficiency of gene transfer, specifically, in transferring astaxanthin biosynthesis genes into MTD 176 soybean variety: puncturing 3 times with multi- needle to replace scalpel for wounding MTD 176 cotyledonary node has increased the transformation efficiency from 0.33% to 1%; combined use of 30s ultrasound; 60s vacuum infiltration at -20 in Hg during wounding of cotyledonary nodes also increased efficiency of gene transfer from 0.67% to 2%. This study generated many transgenic soybean, in which, two lines have ability to produce seed-specific astaxanthin and pass astaxanthin biosynthesis genes to next generations. Astaxanthin content in the T1 generation seeds of two transgenic soybean lines was
0.31 µg/g (D2) and 0.77 µg/g (D8), respectively. In stages of growth, development as well as seed yield, there was not much differences between transgenic and control plants. Thus, this research has gernerated value-added soybean lines capable of producing astaxanthin in seeds, serving as a basis for further studies to create products with practical applications.



![Vị Trí Của Phân Tử Astaxanthin Trong Màng Tế Bào [40]](https://tailieuthamkhao.com/uploads/2022/12/28/nghien-cuu-tao-cay-dau-tuong-glycine-max-l-bien-doi-gen-co-kha-nang-tong-4-1-120x90.jpg)