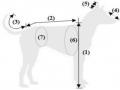
Nội dung thực hiện đo kích thước được thực hiện kết hợp giữa các tài liệu khoa học trên thế giới cùng với trao đổi thông tin về chó Phú Quốc cùng các chủ trại nuôi lâu năm và có nhiều kinh nghiệm. Các phương pháp đo kích thước cũng được tham vấn và ghi nhận thông qua các cuộc thi Dog show của VKA, các hội thảo khoa học trước đây từ các nghiên cứu khác.
2.3.2. Nội dung 02: Nghiên cứu xây dựng tiêu chuẩn hình thái để chọn lọc chó Phú Quốc dựa trên các chỉ số hình thái đặc trưng
a) Địa điểm thực hiện và số mẫu nghiên cứu: như nội dung 2.2.1
b) Phương pháp bố trí thí nghiệm, phương pháp điều tra thu thập số liệu: như nội dung 2.2.1
c) Các kỹ thuật sử dụng: chọn lọc các kích thước có tỷ lệ tương quan; đánh giá sinh trắc học cơ thể theo mô hình động vật. Chỉ số cơ thể của chó Phú Quốc được chọn lựa, đánh giá và điều chỉnh dựa trên các công bố trước đây trên các giống chó khác như giống chó Italian Cane Corso hay chó Spanish [47], [74].
Đánh giá sự tương quan giữa chiều cao vai và chiều dài cơ thể, chu vi vòng ngực và chu vi vòng hông thông qua phân tích hồi quy nhằm xây dựng hàm số tuyến tính với hệ số tương quan R.
Thiết lập các chỉ số hình thái theo các công thức:
Chỉ số cơ thể (Body Index)= Chiều dài cơ thể x 100/Vòng ngực
(BI = BL x 100/ChC)
Chỉ số cân đối (Proportionality Index) = Chiều cao vai x 100/Chiều dài cơ thể (PI = HW x 100/BL)
d) Các chỉ tiêu theo dõi và cách tính: các công thức tương quan giữa các kích thước được tính thông qua mô hình tính toán theo công thức và thống kê hồi quy với hệ số R.
2.3.3. Nội dung 03: Nghiên cứu sự liên quan giữa kiểu gen và kiểu hình xoáy lưng trên chó Phú Quốc
a) Địa điểm thực hiện và số mẫu nghiên cứu: mẫu máu được thu nhận từ tổng cộng 18 cá thể chó tại TP. Hồ Chí Minh và Phú Quốc. Các cá thể thu nhận DNA bao gồm: 3 cá thể chó cỏ (chó nhà) đồng nhất về kiểu hình và dinh dưỡng (được thu thập và ghi nhận thông tin bởi chủ nuôi), 15 cá thể chó Phú Quốc có xoáy và không có xoáy (được thu nhận từ các trại nhân giống và bảo tồn kết hợp thông tin từ người nuôi trực tiếp). Mẫu được đánh số từ 1 đến 3 cho cá thể chó nhà (ký hiệu: control dog - CD), 4 đến 18 cho cá thể chó Phú Quốc (cả xoáy và không xoáy) (ký hiệu: Phu Quoc dog - PQ ). Do tính trạng xoáy lưng là đột biến trội trên NST thường nên không phân biệt giới tính cá thể chó được làm mẫu nghiên cứu đánh giá.
b) Phương pháp bố trí thí nghiệm, phương pháp điều tra thu thập số liệu:
Phương pháp thu nhận và bảo quản mẫu máu được thực hiện như sau:
- Sát trùng vùng lấy máu bằng bông có thấm cồn 70o.
- Dùng kim tiêm vô trùng rút 2ml máu từ tĩnh mạch chân trước của chó, chuyển nhanh vào ống EDTA vacutainer, lắc đều để máu hòa tan hoàn toàn trong ống EDTA để tránh tình trạng máu bị đông.
- Ghi thông tin của mẫu lên thành ống EDTA vacutainer và chụp ảnh các con chó vừa lấy mẫu.
- Cho mẫu vào thùng xốp giữ nhiệt có túi đá khô để giữ lạnh mẫu trong quá trình vận chuyển, cần nhanh chóng chuyển mẫu vào tủ lạnh – 20 oC để mẫu được bảo quản tốt nhất
c) Các kỹ thuật sử dụng:
Quy trình tách DNA từ máu
Nguyên tắc chung: màng tế bào được phá vỡ bằng chất tẩy mạnh, DNA trong và ngoài nhân được giải phóng cùng với các protein. Sau đó protein được tinh sạch bằng proteinase K và phenol trong hỗn hợp phenol: chloroform:
isoamyl alcohol. Cuối cùng DNA được kết tủa bằng cồn 100% và thu lại bằng phương pháp ly tâm.
DNA của mẫu máu chó được tách chiết theo quy trình Bruce A. Roe và cộng sự [54] có độ tinh sạch cao và có thể sử dụng cho các thí nghiệm về sinh học phân tử như PCR, enzyme cắt hạn chế,…
Quy trình tách chiết DNA tổng số được thực hiện như sau:
Bước 1: Làm tan các mẫu đông lạnh và mỗi 1 ml mẫu thêm vào 0,8 ml dung dịch đệm SSC 1X, trộn đều, ly tâm ở 12.000 rpm trong 20 phút.
Bước 2: Loại bỏ 1 ml phần nổi và thêm vào dung dịch chất khử trùng.
Bước 3: Thêm vào 1 ml dung dịch đệm SSC 1X, vortex, ly tâm ở 12.000 rpm trong 20 phút và loại bỏ hoàn toàn phẩn nổi.
Bước 4: Thêm 375 µl NaOAc 0,2M vào mỗi kết tủa và vortex trong thời gian ngắn. Thêm 25 µl dung dịch SDS 10% và 5 µl proteinase K (20 mg/ml H2O), vortex trong thời gian ngắn, ủ ở 55 oC trong 1 giờ.
Bước 5: Thêm 120 µl dung dịch hỗn hợp Phenol:Chloroform:Isoamylalcohol (25:24:1) và vortex trong 30 giây. Ly tâm
12.000 rpm trong 20 phút.
Bước 6: Chuyển lớp nước bên trên sang ống Eppendorf 1,5 ml mới một cách cẩn thận. Thêm 1 ml dung dịch EtOH tuyệt đối lạnh (ethanol 100% lạnh), trộn đều và ủ ở -20 oC trong 15 phút.
Bước 7: Ly tâm 12.000 rpm trong 20 phút, gạn bỏ phần nổi trên mặt và để
ráo.
Bước 8: Thêm 180 µl dung dịch TE buffer 10:1, vortex, ủ ở 55oC trong
10 phút
Bước 9: Thêm 20 µl dung dịch NaOAc 2M và trộn đều, thêm 500 µl dung dịch EtOH tuyệt đối lạnh, trộn đều và ly tâm 12.000 rpm trong 1 phút.
Bước 10: Gạn bỏ phần nổi và rửa phần tủa với 1ml dung dịch EtOH 80%, ly tâm 12.000 rpm trong 1 phút.
Bước 11: Gạn bỏ phần nổi và làm khô phần tủa.
Bước 12: Huyền phù phần tủa bằng cách thêm vào 200 µl dung dịch TE buffer 10:1. Ủ qua đêm ở 55 oC, vortexing định kỳ để làm tan toàn bộ DNA bộ gen. Trữ mẫu ở -20 oC
Kiểm tra độ tinh sạch DNA bằng quang phổ kế
Đo chỉ số OD của DNA ở bước sóng 230 nm (A230), 260 nm (A260), 280 nm (A280) và 320 nm (A320).
Độ tinh sạch của mẫu DNA thu được dựa trên tỷ số OD260nm/OD280nm và OD260nm/OD230nm. Dung dịch nucleic acid được xem là sạch, không tạp nhiễm khi tỷ số OD260nm/OD280nm trong khoảng 1,8 – 2,0 và tỷ số OD260nm/OD230nm trong khoảng 2,0 – 2,2.
Kiểm tra sản phẩm tách chiết DNA bằng điện di trên gel agarose 1% và đọc kết quả dưới đèn UV ở bước sóng 254 nm.
DNA tinh sạch được bảo quản ở -20 ºC đến khi dùng.
d) Các chỉ tiêu theo dõi và cách tính:
Phương pháp xác định kiểu gen dồng hợp hoặc dị hợp của kiểu hình xoáy lưng trên chó xoáy châu Phi bằng thông qua phương pháp real-time PCR. Vùng nhân lên được tô đậm. Vị trí số 1 là nucleiotid bắt đầu của vùng nhân lên. Set mồi số 1,2 nằm trong vùng được nhân lên hay lặp lai, set số 3 và 4 nằm ngoài vùng nhân lên hay lặp lai của gen R. [108]
Các primer hay set được thiết kế theo nghiên cứu cuả Waldo và cộng sự, mồi β-actin được sử dụng như một kết quả xác định DNA của động vật có vú nhằm tránh sự nhiễm các DNA của cá thể khác trong quá trình tách chiết và thực hiện các kỹ thuật real-time PCR.
Số biến thể bản sao ước lượng ( relative copy number - RCN) của vùng CNV được tính toán bởi phương pháp Livak [71] có cải tiến bởi Pfaffl [78] dùng để xác định chu kỳ ngưỡng (Ct) bằng phương pháp real-time PCR sử dụng SYBR Green Master Mix làm chất phát huỳnh quang với nhiệt độ nóng chảy quan sát phù hợp [78]


Hình 2.3 (a) Vị trí vùng lặp hay nhân lên khoảng 133kb trên NST 18 của chó xoáy Châu Phi. (b) Các set mồi sử dụng xác định trên NST số 18
Với real-time PCR sử dụng SYBR I làm chất phát huỳnh quang; thiết bị real-time sẽ ghi nhận được sự phát huỳnh quang tối đa từ ống phản ứng, khi nhận ánh sáng kích thích, là ở cuối giai đoạn nhiệt độ kéo dài của chu kỳ PCR.
Quá trình khuếch đại được thực hiện thông qua máy Bio Rad CFX96 bao gồm các giai đoạn:
Giai đoạn ủ:
- Ủ 2 phút ở 95 ° C
Giai đoạn bắt cặp : lặp lại 40 chu kỳ bao gồm
- 95oC trong 5 giây: biến tính
- 60oC trong 10 giây: bắt cặp
- 72oC 15 giây: ổn định
Sau khi lặp lại 40 chu kì bắt cặp và ổn định, phản ứng được đưa xuống 60oC rồi tăng dần lên 95oC mỗi bước tăng 0,5oC và giữ trong 10 giây. Quá trình này nhằm đo nhiệt nóng chảy phân biệt các dimer tạo thành và các sản phẩm PCR trong quá trình bắt cặp.
Bảng 2.1 Các primer được sử dụng nhằm định lượng cho Ct của các gen quan tâm thông qua phương pháp RT-PCR
Mồi xuôi | Mồi ngược | |
Set 1 | TGCCGCTCAGATGATCAAC | TCTGCTTTTCTCTGCTCCC3 |
Set 2 | ATTGGCAGTGTCCGTGTGAG | AAGCCCCGCAGACAATGAAC |
Set 3 | GCATCCACCTAAGCAATCTG | CCCTATTCTCTTCCACCCATC |
Set 4 | GCTTCTGCTTTGATACCCTTC | GTTCTGCAACAGCATCTCC |
β-actin | CATGGATGCCGCAGGATT | GTTCCGCTGCCCAGAGG |
Có thể bạn quan tâm!
-
![Xác Suất Xuất Hiện Kiểu Hình Xoáy Lưng Và Nguy Cơ Của Dị Tật Ống Thần Kinh Ds Trong Quần Thể Cho Xoáy Trong Quá Trình Lai Giống [33]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Xác Suất Xuất Hiện Kiểu Hình Xoáy Lưng Và Nguy Cơ Của Dị Tật Ống Thần Kinh Ds Trong Quần Thể Cho Xoáy Trong Quá Trình Lai Giống [33]
Xác Suất Xuất Hiện Kiểu Hình Xoáy Lưng Và Nguy Cơ Của Dị Tật Ống Thần Kinh Ds Trong Quần Thể Cho Xoáy Trong Quá Trình Lai Giống [33] -
 Sự Cần Thiết Của Nghiên Cứu Về Hình Thái Và Kiểu Gen Của Tính Trạng Xoáy Lưng Trên Chó Phú Quốc Việt Nam
Sự Cần Thiết Của Nghiên Cứu Về Hình Thái Và Kiểu Gen Của Tính Trạng Xoáy Lưng Trên Chó Phú Quốc Việt Nam -
 Nội Dung 1: Nghiên Cứu Đánh Giá Các Chỉ Số Cơ Thể Đặc Trưng Của Chó Phú Quốc
Nội Dung 1: Nghiên Cứu Đánh Giá Các Chỉ Số Cơ Thể Đặc Trưng Của Chó Phú Quốc -
 Kết Quả Kiểm Định T-Test Về Sự Khác Biệt Của Kích Thước Hình Thái Cơ Bản Giữa Chó Phú Quốc Đực Và Cái
Kết Quả Kiểm Định T-Test Về Sự Khác Biệt Của Kích Thước Hình Thái Cơ Bản Giữa Chó Phú Quốc Đực Và Cái -
 Số Lượng Cá Thể Có Hình Dạng Xoáy Lưng Ở Chó Xoáy Phú Quốc
Số Lượng Cá Thể Có Hình Dạng Xoáy Lưng Ở Chó Xoáy Phú Quốc -
 Một Số Loài Có Tai Nhọn Đứng Điển Hình, Từ Trái Qua Phải: Chó Sói, Malamute, Basenji Và Chó Phú Quốc.
Một Số Loài Có Tai Nhọn Đứng Điển Hình, Từ Trái Qua Phải: Chó Sói, Malamute, Basenji Và Chó Phú Quốc.
Xem toàn bộ 152 trang tài liệu này.
2.3.4. Nội dung 04: Nghiên cứu cải thiện mô hình bảo tồn (insitu-in vivo và
exsitu-in vivo) chó Phú Quốc dựa trên bộ tiêu chuẩn hình thái
a) Địa điểm thực hiện và số mẫu nghiên cứu:
Cải tiến mô hình nuôi 3 trại bán bảo tồn chó Phú Quốc tại Phú Quốc – Kiên Giang và TP. Hồ Chí Minh, Vũng Tàu.
b) Phương pháp bố trí thí nghiệm, phương pháp điều tra thu thập số liệu:
Xây dựng bộ quy ước thông tin về chó Phú Quốc, tư vấn mô hình nuôi bán bảo tồn. Chó Phú Quốc được thu nhận vào trại dựa trên bộ tiêu chuẩn kiểu hình được tư vấn cho chủ trại.
Xây dựng và hướng dẫn về cách nhận diện kiểu gen đồng hợp và dị hợp của tính trạng xoáy lưng thông qua quan hệ di truyền quần thể, lưu giữ những cá thể có nguồn gen thích hợp nhằm bảo tồn nguồn gen giống chó Phú Quốc và định hướng lai tạo để tăng tỷ lệ chó có xoáy lưng ở đời sau.
c) Các kỹ thuật sử dụng:
Điều tra thông tin trại chó: số lượng chó, tỷ lệ đực cái, thức ăn, môi trường nuôi, quy trình nhân giống và lai tạo tại Phú Quốc, Tp. HCM và các khu vực lân cận
Chọn vị trí môi trường thích hợp cho xây dựng mô hình bán bảo tồn.
Cấy chip vào dưới da các cá thể chó nhằm theo dõi về thông tin và ghi nhớ đặc tính di truyền
d) Các chỉ tiêu theo dõi và cách tính:
Vị trí xây dựng mô hình bảo tồn: Bao gồm 4 trang trại tại Phú Quốc (bảo tồn in situ-in vivo), 1 trang trại tại Củ Chi (TP. Hồ Chí Minh) và 1 trang trại tại Vũng Tàu (bảo tồn ex situ-in vivo). Thông tin đánh giá bổ sung là kích thước và diện tích trại nuôi, chuồng trại và dinh dưỡng cung cấp cũng được tham khảo và ghi nhận. Các hoạt động huấn luyện và lai tạo chó nhằm tránh cận huyết và giữ lại các đặc điểm tự nhiên
e) Gắn chip điện tử:
Vị trí gắn chip vào dưới da các cá thể chó theo dõi và giữ giống nhằm lai tạo và bảo tồn quần thể.
2.4. Xử lý số liệu
Kết quả thống kê mô tả và các tiêu chuẩn về kích thước cơ thể được trình bày dưới dạng giá trị trung bình cùng sai số chuẩn. Phân tích ANOVA và kiểm định t được dùng để đánh giá sự khác biệt của kích thước cơ thể giữa các giới tính và các quần thể khảo sát ở khoảng tin cậy 95% (mức ý nghĩa 0,05). Kiểm định t được dùng để phân tích hai tập hợp mẫu có phương sai không giống nhau.
2.4.1. XLSTAT
Nghiên cứu này sử dụng chương trình XLSTAT phát triển bởi Addinsoft từ năm 1993. Các mô hình đánh giá thông số thống kê, trung bình, phương sai, khoảng tin cậy của kích thước kiểu hình, hồi quy tuyến tính các yếu tố kích thước liên quan.
2.4.2. Dữ liệu đối chiếu và tham khảo
Dữ liệu về hình thái và kích thước của chó lưng xoáy Thái Lan và Nam Phi được ghi nhận và khảo sát từ Liên đoàn Giống chó Quốc tế (Fédération Cynologique Internationale – FCI).
Dữ liệu từ các giống chó khác được tham khảo theo các công bố trước đây trên các dòng chó nhà thế giới.
Chương 3 - KẾT QUẢ NGHIÊN CỨU VÀ THẢO LUẬN
3.1. Nghiên cứu đánh giá các chỉ số cơ thể đặc trưng của chó Phú Quốc

Hình 3.1 Một số cá thể chó Phú Quốc tại huyện đảo Phú Quốc
Thông tin từ chủ nuôi chó là công việc rất quan trọng trong quá trình thu mẫu. Nếu các cá thể chó không có thông tin rõ ràng về gia phả hay nguồn gốc sẽ không tiến hành thu mẫu. Các cá thể được thu thập tại huyện đảo Phú Quốc trước tiên phải là những cá thể không có nguồn gốc từ đất liền, có cha và mẹ là các cá thể chó bản địa và không có sự lai tạp với các giống chó ngoại khác. Các cá thể chó thu thập từ các trại chó tại TP. Hồ Chí Minh và vùng lân cận phải có nguồn gốc bố và mẹ từ đảo Phú Quốc (Hình 3.1).

![Xác Suất Xuất Hiện Kiểu Hình Xoáy Lưng Và Nguy Cơ Của Dị Tật Ống Thần Kinh Ds Trong Quần Thể Cho Xoáy Trong Quá Trình Lai Giống [33]](https://tailieuthamkhao.com/uploads/2023/06/26/nghien-cuu-moi-lien-quan-giua-kieu-gen-va-kieu-hinh-dac-trung-trong-bao-ton-6-1-120x90.jpg)