Bảng 3.19 Ảnh hưởng của tiền xử lý cơ chất tới hiệu suất đường hóa
Rơm đã xử lý | Rơm chưa xử lý | |||
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
6 | 3,11± 0,26 | 41,10 | 1,59±0,33 | 21,98 |
18 | 3,56±0,25 | 47,04 | 2,07±0,27 | 28,61 |
24 | 4,20±0,32 | 55,50 | 2,19±0,37 | 30,27 |
Có thể bạn quan tâm!
-
 Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm
Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm -
 Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym
Ảnh Hưởng Của Môi Trường Nuôi Cấy Tới Khả Năng Sinh Enzym -
 Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1
Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1 -
 Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 14
Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 14 -
 Đặc Điểm Các Chủng Vi Khuẩn Phân Lập Được Trên Đĩa Thạch Từ Các Mẫu Mối 01- 04
Đặc Điểm Các Chủng Vi Khuẩn Phân Lập Được Trên Đĩa Thạch Từ Các Mẫu Mối 01- 04 -
 Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 16
Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 16
Xem toàn bộ 138 trang tài liệu này.
Kết quả bảng 3.19 cho thấy hiệu suất đường hóa của rơm đã qua tiền xử bằng kiềm cao hơn so với nguyên liệu rơm chưa qua tiền xử lý, cụ thể sau 24 giờ thủy phân hiệu suất đường hóa với rơm chưa tiền xử lý đạt 30,27% trong khi hiệu suất đường hóa của rơm đã qua tiền xử lý cao gấp 1,8 lần đạt 55,5%.
3.6.3. Ảnh hưởng các yếu tố tới hiệu suất thủy phân bởi enzym
Đối với phản ứng enzym thông thường khi kéo dài thời gian thủy phân thì hiệu suất đường hóa tăng, tuy nhiên đến một thời điểm nhất định nếu tiếp tục kéo dài thời gian thì lượng sản phẩm tạo thành không tăng nữa, thậm chí bị giảm do ảnh hưởng của các yếu tố gây tổn thất sản phẩm. Thí nghiệm xác định thời điểm kết thúc phản ứng đươc khảo sát từ 0 giờ đến 72 giờ, kết quả cho thấy sau 24 giờ lượng đường khử tạo thành tăng chậm và đạt hàm lượng cao nhất sau 48 đến 72 giờ thủy phân. Từ 48 đến 72 giờ lượng đường tăng lên không đáng kể vì vậy lựa chọn 48 giờ là thời gian thủy phân thích hợp nhất, hiệu suất đường hóa đạt được sau 48 giờ đạt 66,87%.
Bảng 3.20 Ảnh hưởng của thời gian tới hiệu suất đường hóa
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
0 | 0,09±0,02 | 1,19 |
6 | 3,13±0,33 | 41,36 |
18 | 3,56±0,25 | 47,05 |
24 | 4,20±0,32 | 55,50 |
48 | 5,06±0,31 | 66,87 |
72 | 5,09±0,38 | 67,26 |
Kết quả tương tự cũng được công bố bởi Chiranjeevi và cộng sự, trong đó lượng đường khử tạo thành cao nhất sau 48 giờ thủy phân và sau 48 giờ lượng khử tăng lên không đáng kể [62].
Quá trình thủy phân cơ chất đã qua tiền xử lý và cơ chất chưa tiền xử lý được tiến hành ở các nhiệt độ khác nhau từ 40°C đến 70°C với nồng độ cơ chất là 1% và thời gian thủy phân 48 giờ. Kết quả thể hiện ở bảng 3.21
Bảng 3.21 Ảnh hưởng của nhiệt độ tới hiệu suất đường hóa
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
40 | 3,31±0,35 | 43,74 |
50 | 5,06±0,4 | 66,87 |
60 | 4,05±0,35 | 53,52 |
70 | 2,54±0,35 | 33,56 |
Kết quả bảng 3.21 cho thấy hiệu suất đường hóa đạt cao nhất đạt 66,87% khi điều chỉnh nhiệt độ thủy phân ở 50°C. Do đó 50°C là nhiệt độ tối ưu của quá trình thủy phân bởi enzym thu nhận từ Cellulosimicrobium sp. MP1
Nồng độ cơ chất quyết định mức độ tiếp xúc enzym cơ chất từ đó ảnh hưởng tới hiệu suất quá trình đường hóa. Nghiên cứu được tiến hành bằng cách thay đổi tỷ lệ chất rắn và chất lỏng trong phản ứng. Kết quả thể hiện ở bảng 3.22
Bảng 3.22 Ảnh hưởng của tỷ lệ chất rắn/lỏng tới hiệu suất đường hóa
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
1:100 | 5,06±0,23 | 66,87 |
2:100 | 10,1±0,35 | 66,74 |
3:100 | 11,34±0,24 | 49,95 |
Khi tăng tỷ lệ cơ chất trong dung dịch thì lượng đường khử tăng lên và đạt cao nhất khi tỷ lệ cơ chất/dung dịch 3/100. Tuy nhiên hiệu suất đường hoá lại đạt cao hơn ở tỷ lệ 1/100 và 2/100 và do ở 2 tỷ lệ này hiệu suất đường hóa gần như nhau vì vậy tỷ lệ 2/100 là tỷ lệ cơ chất/dung dịch đem lại hiệu quả nhất cho quá trình đường hóa. Tương tự như báo cáo Chiranjeevi và cộng sự [62], điều này có thể giải thích rằng tỷ lệ cơ chất cao cũng kìm hãm sự hoạt động của enzym.
Bảng 3.23 Ảnh hưởng của nồng độ enzym tới hiệu suất đường hóa
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
7,5 | 2,96±0,23 | 19,56 |
15 | 5,67±0,35 | 37,46 |
30 | 8,87±0,30 | 58,61 |
37,5 | 10,10±0,24 | 66,74 |
75 | 10,12±0,25 | 66,87 |
Trong phản ứng enzym, vận tốc phản ứng thường tỷ lệ thuận với nồng độ enzym do đó nếu tăng nồng độ enzym trong phản ứng vận tốc phản ứng tăng lên đương nhiên hiệu suất đường hóa tăng. Tuy nhiên khi nồng độ enzym đủ lớn nếu ta tiếp tục tăng nồng độ enzym thì hiệu suất đường hóa không còn tăng nữa. Kết quả nghiên cứu nồng độ enym phù hợp cho quá trình thủy phân được tiến hành bằng cách thay đổi nồng độ enzym trong dung dịch từ 7,5 U/ml đến 75U/ml kết quả thu được ở bảng sau
pH không những ảnh hưởng tới hoạt độ enzym mà còn ảnh hưởng tới cấu trúc của cơ chất. Nghiên cứu về enzym từ Cellulosimicrobium chỉ ra mặc dù điều kiện pH kiềm yếu không phải là pH tối ưu của cellulase và xylanase (pH tối ưu hai enzym này trong nghiên cứu là khoảng 5,2-6,0), nhưng hơn 50% hoạt tính cellulase và 70% hoạt tính xylanase so với hoạt tính cao nhất vẫn được duy trì trong điều kiện kiềm đến hơn 120 giờ [12]. Do đó nhiều trường hợp pH thích hợp nhất chưa hẳn là pH tối ưu của enzym
Bảng 3.24 Ảnh hưởng của pH tới hiệu suất đường hóa
Hàm lượng đường khử (mg/mL) | Hiệu suất đường hóa (%) | |
4.0 | 2,56±0,35 | 16,91 |
4.5 | 8,85±0,45 | 58,48 |
5.0 | 10,35±0,25 | 68,39 |
5.5 | 10,58±0,37 | 69,91 |
6.0 | 10,55±0,37 | 69,71. |
6.5 | 10,15±0,39 | 67,07 |
7.0 | 10,1±0,25 | 66,74 |
Kết quả cho thấy hàm lượng đường khử tăng trong khoảng pH từ 5,0 đến 7,0 và đạt giá trị cao nhất tại giá trị pH 5,5 đến 6,0. Hàm lượng đường khử tạo thành
giảm nhẹ khi tăng pH đến 6,5 và 7,0 cho thấy khoảng pH hoạt động của cellulase thu nhận từ Cellulosimicrobum sp MP1 là tương đối rộng từ pH 5,0 đên 7,0
Các nghiên cứu về các yếu tố ảnh hưởng tới quá trình đường hóa cho thấy hiệu suất đường hóa cao nhất đạt 69,91 % tại nhiệt độ đường hóa 55°C, thời gian đường hóa 48 giờ, nồng độ cơ chất trong dung dịch 2g/100ml, nồng độ enzym 37,5 U/g và pH 5,5.
Kết quả này được so sánh với công bố của Iram và cộng sự, các tác giả đã phân lập được chủng thuộc chi Cellulomonas từ ruột mối và đã sử dụng enzym từ chủng này cho quá trình thủy phân các vật liệu cellulose như thân cây ngô và rơm, kết quả cho thấy khi thủy phân thân cây ngô hàm lượng đường khử thu được cao hơn so với thủy phân rơm và đạt 18,9 mM/l tương đương với 3,4 g/l [58]. Hàm lượng đường thu được này thấp hơn so với kết quả nghiên cứu trên tuy nhiên nghiên cứu của Iram và cộng sự sử dụng nguyên liệu chưa qua tiền xử lý và chưa tối ưu hóa các điều kiện tối ưu.
Để biết được các sản phẩm cụ thể của quá trình thủy phân chúng tôi tiến hành phân tích hàm lượng đường glucose, xylose, cellobiose trong dịch thủy phân bằng HPLC.
Kết quả phân tích sản phẩm thủy phân bằng HPLC như Hình 3.26.
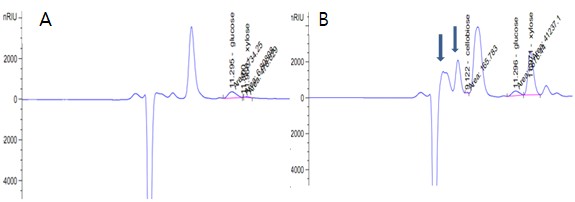
A: Mẫu đối chứng (Dịch thủy phân bởi enzym đã bị bất hoạt tương ứng) B: Hàm lượng đường trong dịch thủy phân rơm đã tiền xử lý
Hình 3.26. Sản phẩm thủy phân rơm sử dụng cellulase từ MP1 bằng HPLC
Kết quả xác định hàm lượng đường khử cũng như kết quả kiểm tra dải sản phẩm thủy phân bằng HPLC cho thấy trong các thành phần tạo thành của quá trình thủy phân có xuất hiện các pick của các đường đơn glucose, xylose và đường đôi cellobiose, điều này cho thấy hệ enzym chủng vi khuẩn MP1 có khả năng phân giải
cellulose và hemicellulose đến sản phẩm cuối cùng. Kết quả này cũng được chứng minh khi phân tích hệ gen vi khuẩn MP1 cho thấy chủng này có đến 30 gen mã hóa cho các enzym phân giải hemicellulose gần như có đầy đủ các enzym thuộc họ GH cho thấy MP1 là chủng có tiềm năng trong việc phân giải lignocellulose.
KẾT LUẬN
Qua quá trình nghiên cứu chúng tôi thu được các kết quả như sau:
- Đã phân lập 108 chủng vi khuẩn từ các mẫu mối lấy từ các địa điểm khác nhau, chọn ra được 11 chủng vi khuẩn có hoạt tính cellulase cao từ kết quả định tính và định lượng. Định tên được 9 chủng vi khuẩn, trong đó có tới 7/11 chủng thuộc chi Bacillus chiếm 63%.
- Tối ưu quá trình sinh tổng hợp CMCase từ Bacillus subtilis G4 trên môi trường có nồng độ casein 19,92 g/l, nồng độ bột đậu tương 15,9 g/l, nồng độ tinh bột 19,52 g/l, nuôi cấy ở nhiệt độ 37°C, pH 7,0, thời gian 72 giờ, tỷ lệ nhân giống 1% và tốc độ lắc 150 vòng/phút đạt hoạt độ endoglucanase cao nhất 5,63 U/ml. Chế phẩm cellulase kết tủa bởi 80% Acetone có nhiệt độ tối ưu 60ºC, pH tối ưu 7,0; bền ở pH từ 4,0-7,0 và bền nhiệt từ 40ºC - 50ºC.
- Thu nhận được cellulase từ MP1 có hoạt độ endoglucanase cao nhất đạt 3,25 U/ml trên môi trường có nồng độ tinh bột 1%, casein 1%, bột đậu tương 1,5 % , thời gian nuôi cấy 72 giờ, tỷ lệ giống 5%, tốc độ lắc 100 vòng/phút, pH môi trường 7.5 và nhiệt độ 37ºC. Chế phẩm cellulase thu nhận từ MP1 kết tủa bằng ethanol có nhiệt độ và pH tối ưu tương ứng là 60ºC và pH 6.0, cellulase từ MP1 bền ở nhiệt độ 40ºC-50ºC và bền pH từ 5-10.
+ Đã giải trình tự toàn bộ hệ gen, lắp ráp, chú giải và phân tích các gen vi khuẩn Cellulosimicrobium. cellulans MP1 cho kết quả: hệ gen có kích thước
4.580.230 bp gồm 23 contig, chứa 3.964 trình tự mã hóa protein (CDC), tìm ra được 30 gen có liên quan đến cellulase và 21 gen liên quan đến hemicelluase trong hệ gen để chứng minh cho khả năng phân giải lignocellulose của chủng.
+ Khảo sát khả năng thủy phân cellulose của rơm sử dụng cellulase thu nhận từ MP1 thu được hiệu suất đường hóa cao nhất đạt 69,91 % tại nhiệt độ đường hóa 55°C, thời gian đường hóa 48 giờ, nồng độ cơ chất trong dung dịch 2g/100ml, nồng độ enzym 37,5 U/g và pH 5,5
TÀI LIỆU THAM KHẢO
[1] M. K. Bhat (2000), “Cellulases and related enzymes in biotechnology”
Biotechnol. Adv, Vol. 18, No. 5, pp. 355–38.
[2] S. E. Hobdey, B. S. Donohoe, R. Brunecky, M. E. Himmel, and Y. J. Bomble (2015), “New Insights into Microbial Strategies for Biomass Conversion,”
Direct Microb. Convers. Biomass to Adv. Biofuels, pp. 111–127
[3] Y. Lee, H. Kim, M. J. Cho, K. Shin, Y. Kim, and Y. Kim (2010), “Cellulose Hydrolysis by Digestive Enzymes of Reticulitermes speratus, a Native Termite from Korea ” Vol. 38, No. 2, pp. 140–148.
[4] G. M. Mathew, R. K. Sukumaran, R. R. Singhania, and A. Pandey (2008), “Progress in research on fungal cellulases for lignocellulose degradation,” J. Sci. Ind. Res. (India), Vol. 67, No. 11, pp. 898–907.
[5] J. Duan, J. Liu, X. Ma, Y. Zhang, X. Wang, and K. Zhao (2017), “Isolation, identification, and expression of microbial cellulases from the gut of Odontotermes formosanus,” J. Microbiol. Biotechnol., Vol. 27, No. 1, pp. 122–129.
[6] M.-J. Cho, Y.-H. Kim, K. Shin, Y.-K. Kim, Y.-S. Kim, and T.-J. Kim (2010) , “Symbiotic adaptation of bacteria in the gut of Reticulitermes speratus: low endo-beta-1,4-glucanase activity.,” Biochem. Biophys. Res. Commun., Vol. 395, No. 3, pp. 432–435.
[7] M. Morrison, P. B. Pope, S. E. Denman, and C. S. McSweeney (2009), “Plant biomass degradation by gut microbiomes: more of the same or something new?,” Curr. Opin. Biotechnol., Vol. 20, No. 3, pp. 358–363.
[8] A. Bakalidou, P. Kämpfer, M. Berchtold, T. Kuhnigk, M. Wenzel, and H. König (2002), “Cellulosimicrobium variabile sp. nov., a cellulolytic bacterium from the hindgut of the termite Mastotermes darwiniensis,” Int. J. Syst. Evol. Microbiol., Vol. 52, No. 4, pp. 1185–1192.
[9] M. Wenzel, I. Schönig, M. Berchtold, P. Kämpfer, and H. König (2002), “Aerobic and facultatively anaerobic cellulolytic bacteria from the gut of the termite Zootermopsis angusticollis.,” J. Appl. Microbiol., Vol. 92, No. 1, pp. 32–40.
[10] J.-H. Chou, W.-M. Chen, A. B. Arun, and C.-C. Young (2007), “Trabulsiella odontotermitis sp. nov., isolated from the gut of the termite Odontotermes formosanus Shiraki.,” Int. J. Syst. Evol. Microbiol., vol. 57, No. Pt 4, pp. 696– 700.
[11] R. H. Doi (2015), “Cellulases of mesophilic microorganisms (2008): cellulosome and noncellulosome producers.,” Ann. N. Y. Acad. Sci., vol. 1125, pp. 267–279.
[12] W. Liu et al (2015), “Bioflocculant production from untreated corn stover using Cellulosimicrobium cellulans L804 isolate and its application to harvesting microalgae,” Biotechnol. Biofuels, Vol. 8, No. 1, pp. 1–12.
[13] M. Irfan, A. Safdar, Q. Syed, and M. Nadeem (2012), "Isolation and Screening of cellulotic Bacteria from soil and optimization of cellulase production and activity" Turkish J. Biochem., vol. 37, no. 3, pp. 287–293.
[14] D. Submitted et al. (2013), “Production of lignocellulosic ethanol from
Lantana camara by bacterial cellulase of termite symbionts Departerment of Life Science,”.
[15] B. A.D, G. Apurv, G. Malarvili, S. Rameez, and K. Bhushan (2014), “Exploration of cellulolytic potential of Termite gut flora for sustainable development,” IOSR J. Environ. Sci. Toxicol. Food Technol., Vol. 8, No. 2, pp. 71–76.
[16] P. Nisha (2015), “Cellulase Production Optimization Using Cellulolytic Bacteria,” Int. J. Pharm. Chem. Biol. Sci., vol. 5, no. 1, pp. 262–266
[17] N. M. Giang, D. T. Huyen, and T. N. Hai (2016), “In Silico mining for Alkaline enzyme from Metagenomic DNA data of Gut Microbes of the Lower Termite Coptotermes gestroi in Viet Nam”, Acadermia Journal of Biology, 38 (3), pp. 374-383.
[18] J.-M. Song and D.-Z. Wei (2010), “Production and characterization of cellulases and xylanases of Cellulosimicrobium cellulans grown in pretreated and extracted bagasse and minimal nutrient medium M9,” Biomass and Bioenergy, vol. 34, no. 12, pp. 1930–1934..
[19] S. Sreedevi, S. Sajith, and S. Benjamin (2013), “Cellulase Producing Bacteria from the Wood-Yards on Kallai River Bank,” Adv. Microbiol., vol. 03, no. 04, pp. 326–332.
[20] Z. Jaradat, A. Dawagreh, Q. Ababneh, and I. Saadoun (2008), “Influence of Culture Conditions on Cellulase Production by Streptomyces Sp. (Strain J2),” Jordan J. Biol. Sci., vol. 1, no. 4, pp. 141–146.
[21] A. Vyas, C. Putatunda, J. Singh, and D. Vyas (2016), “Cellulase production by Bacillus subtilis M1 using pretreated groundnut shell based liquid state fermentation,” Biotropia (Bogor)., vol. 23, no. 1, pp. 28–34.
[22] A. P. Nandimath, K. R. Kharat, S. G. Gupta, and A. S. Kharat (2016), “Optimization of cellulase production for Bacillus sp . and Pseudomonas sp . soil isolates,” vol. 10, no. 13, pp. 410–419.
[23] A. Das, S. Bhattacharya, and L. Murali (2010), “Production of cellulase from a thermophilic Bacillus sp. isolated from cow dung,” Am. J. Agric. Environ. Sci, vol. 9, no. 6, pp. 685–691.
[24] J. Luis Sanchez, D. B. Hodge, M. F. Davis, G. Paës, and A. Zoghlami (2019), “Lignocellulosic Biomass: Understanding Recalcitrance and Predicting Hydrolysis,” Front. Chem. | www.frontiersin.org, vol. 7, p. 874.
[25] C. Sreena, N. Resna, and D. Sebastian (2015), “Isolation and Characterization of Cellulase Producing Bacteria from the Gut of Termites (Odontotermes and Heterotermes Species),” Br. Biotechnol. J., vol. 9, no. 1, pp. 1–10.
[26] D. B. Wilson and D. C. Irwin (1999), “Genetics and Properties of Cellulases,” no. May, pp. 1–21.
[27] E. E. Hafez, C. Of, and T. Applications (2017), “Partial Purification and Characterization of Two Endo- β -1 , 4-glucanase from Trichoderma sp .
( Shmosa tri ),” no. October 2010.
[28] T. M. Wood and V. Garcia-Campayo (1990), “Enzymology of cellulose degradation,” Biodegradation, vol. 1, no. 2, pp. 147–161.
[29] P. Eggleton (2000), “Chapter 1 Taxonomy and Phylogeny of Termites ,” no. Table 1, pp. 1–2.