Bảng 3.11 Ảnh hưởng của môi trường nuôi cấy tới khả năng sinh enzym
Hoạt tính CMCase(U/ml) | |
LB | 0,65± 0,11 |
M1 | 0,42± 0,17 |
M2 | 0,36± 0,21 |
M6 | 1,32± 0,15 |
Có thể bạn quan tâm!
-
 Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography)
Phương Pháp Xác Định Lượng Đường Trong Mẫu Thủy Phân Bằng Sắc Ký Lỏng Cao Áp (Hplc- High Performance Liquid Chromatography) -
 Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn
Đặc Điểm Hình Thái, Sinh Lý Của 11 Chủng Vi Khuẩn Tuyển Chọn -
 Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm
Bề Mặt Đáp Ứng Của Quá Trình Sinh Tổng Hợp Cmcase Từ Bacillus G4 Cho Thấy Sự Tương Tác Giữa (A) Hàm Lượng Bột Đậu Tương Và Tinh Bột . (B) Hàm -
 Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1
Xác Định Đặc Tính Di Truyền Và Các Gen Mã Hóa Enzym Thủy Phân Cellulose Của Chủng C. Cellulans Mp1 -
 Ảnh Hưởng Của Tiền Xử Lý Cơ Chất Tới Hiệu Suất Đường Hóa
Ảnh Hưởng Của Tiền Xử Lý Cơ Chất Tới Hiệu Suất Đường Hóa -
 Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 14
Nghiên cứu cellulase từ vi khuẩn ruột mối phân lập ở Việt Nam - 14
Xem toàn bộ 138 trang tài liệu này.
Kết quả Bảng 3.13 cho thấy, cũng giống như vi khuẩn ruột mối G4, M6 cũng là môi trường tốt nhất trong các môi trường đã khảo sát đối với quá trình sinh enzym của chủng Cellulosimicrobium MP1. Trên môi trường M6 các yếu tố ảnh hưởng tới quá trình sinh tổng hợp enzym như nhiệt độ, pH, tỷ lệ giống, tốc độ lắc cũng đã được nghiên cứu
3.4.1.2. Ảnh hưởng của các thông số kỹ thuật nuôi cấy tới sinh tổng hợp CMCase từ vi khuẩn MP1
Nhiệt độ là một yếu tố rất quan trong trong quá trình sinh trưởng và tổng hợp enzyme của vi sinh vật. Trong các bài báo, nghiên cứu trước đây, các chủng thuộc chi Cellulosimicrobium được xác định là những chủng ưa ấm với khả năng sinh sống trong khoảng nhiệt độ từ 20-40oC [114].
Với pH môi trường các chủng thuộc chi Cellulosimicrobium có thể sống, sinh trưởng và tổng hợp enzym trong một khoảng pH khá rộng (từ 6.0 đến 10.5) nhưng thường sinh các enzym cellulase, xylanase tốt hơn ở môi trường kiềm yếu từ 7,5 đến 9. Vì vậy, khoảng pH được lựa chọn là từ 7 đến 11, nhiệt độ được chọn trong khoảng 25ºC đến 45ºC cho quá trình nghiên cứu
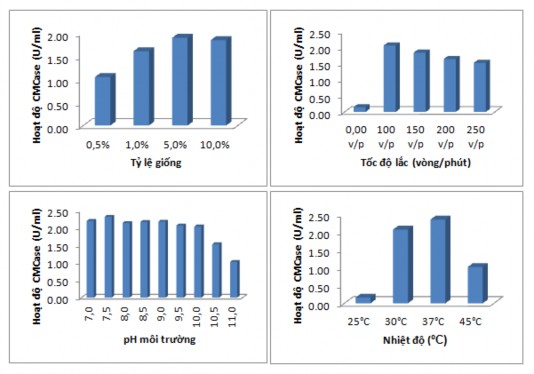
Hình 3.15 Ảnh hưởng các thông số kỹ thuật tới sinh tổng hợp enzym từ MP1
Kết quả nghiên cứu các điều kiện thích hợp cho quá trình sinh tổng hợp cellulase của vi khuẩn MP1 cho thấy, vi khuẩn MP1 sinh CMCase tốt nhất trên môi trường M6 ở 37ºC, pH 7,5, tỷ lệ giống 5% và tốc độ lắc 100 vòng/phút, các điều kiện này cũng giống với điều kiện sinh enzym của chủng vi khuẩn Cellulosimicrobium cellulans được phân lập từ mẫu tảo đỏ [115]. Với kết quả nghiên cứu ảnh hưởng của nhiệt độ tới sinh tổng hợp enzym cho thấy MP1 sinh
CMCase tốt nhất ở 37 oC. Kết quả thu được có sự tương đồng với kết quả được
công bố bởi Naami và cs, khi Cellulosimicrobium sinh trưởng tốt nhất ở nhiệt độ 29oC nhưng lại sinh enzym amylase tốt nhất ở 35oC [116]. Một số nghiên cứu khác cũng đã sử dụng nhiệt độ 37oC để nuôi cấy các chủng Cellulosimicrobium phục vụ mục đích thu một số loại enzym xylanase và mannanase [102][12].
Kết quả khảo sát ảnh hưởng của pH của môi trường nuôi cấy cho thấy pH trong khoảng 7,0-10 là pH phù hợp cho quá trình sinh enzym đối với chủng MP1. Kết quả này cho thấy rằng chủng Cellulosimicrobium sp.MP1 là một chủng chịu kiềm, khi pH môi trường ban đầu tăng trong khoảng từ pH 7 đến pH 10 thì hoạt độ CMCase giảm không đáng kể. Kết quả này cũng giống với công bố của Liu và cộng sự khi nghiên cứu chủng C.cellulans L804 phân lập từ đất sinh trưởng tốt nhất ở pH 7,0 và chỉ giảm mạnh ở pH 10,5 [12].
2.50
2.00
1.50
1.00
0.50
0.00
24h
48h
72h
96h
Thời gian nuôi cấy (giờ)
Hoạt độ CMCase (U/ml)
Thời gian là một trong các yếu tố quan trọng cho quá trình sinh enzym của vi khuẩn. Nghiên cứu yếu tố thời gian để xác định được thời điểm thu nhận enzym từ vi khuẩn.
Hình 3.16 Ảnh hưởng của thời gian nuôi cấy đến hoạt độ CMCase của Cellulosimicrobium sp MP1
Cũng tương tự như chủng vi khuẩn Bacillus G4 chủng MP1 cũng có thời gian thích hợp nhất cho quá trình thu nhận enzym là 72 giờ.
3.4.2. Ảnh hưởng các nguồn dinh dưỡng tới quá trình sinh tổng hợp CMCase
3.4.2.1. Ảnh hưởng nguồn dinh dưỡng nitơ
Thay thế nguồn nitơ bởi cao nấm men, casein và NaNO3 bởi nguồn nitơ vô cơ NH4Cl, NH4NO3. Kết quả xác định hoạt độ được thể hiện trên Bảng 3.12, hoạt độ của các môi trường chứa nguồn nitơ khác nhau được xác định khi nuôi cấy chủng Cellulosimicrobium sp. MP1. Kết quả thu được như bảng sau
Bảng 3.12 Ảnh hưởng của nguồn dinh dưỡng N tới khả năng sinh enzym của chủng MP1
Hoạt tính CMCase(U/ml) | |
Peptone 1% | 0,84± 0,1 |
Casein 1% | 2,89± 0,18 |
Casein 0,5% | 1,05 ± 0,15 |
NH4NO3 1% | 0,15± 0,11 |
Cao nấm men 1% | 0,99± 0,17 |
Không có nitơ | 0,08± 0,13 |
Kết quả Bảng 3.12 cho thấy chủng Cellulosimicrobium sp. MP1 cho hoạt độ CMCase cao nhất khi sử dụng casein. Kết quả này phù hợp với nghiên cứu của Liu và cộng sự khi nuôi cấy C.cellulans L804 cho trên các nguồn N khác nhau. Cao
nấm men cho chủng phát triển tốt trong khi NaNO3 làm cho chủng phát triển chậm và hoạt chất sinh học thu được thấp.
3.4.2.2. Ảnh hưởng nguồn dinh dưỡng cacbon
Các nguồn cacbon khác nhau được sử dụng lần lượt trong môi trường M6. Kết quả xác định hoạt độ enzym trên các môi trường có nguồn cacbon tương ứng thu được số liệu như bảng sau:
Bảng 3.13 Ảnh hưởng của nguồn dinh dưỡng cacbon tới khả năng sinh enzym chủng MP1
Hoạt tính CMCase(U/ml) | |
Glucose1% | 0,84± 0,1 |
Cám gạo 1% | 1,89± 0,18 |
Cám gạo 2% | 1,05 ± 0,15 |
Tinh bột 1% | 3,15± 0,11 |
Tinh bột 2% | 0,99± 0,17 |
Tinh bột 2,5% | 0,08± 0,13 |
Kết quả trên cho thấy tinh bột 1% là nguồn cacbon tốt nhất cho quá trình sinh tổng hợp cellulase của chủng vi khuẩn MP1. Như vậy, cũng giống với chủng G4, với nguồn cacbon tinh bột hoạt tính CMCase tăng cao nhất so với các nguồn cacbon khác.
3.4.2.3. Ảnh hưởng của hàm lượng bột đậu tương tới quá trình sinh cellusae
Ảnh hưởng của bột đậu tương đã được khảo sát với kết quả thu được như sau:
Bảng 3.14 Ảnh hưởng của nồng độ bột đậu tương tới khả năng sinh enzym của chủng MP1
Hoạt tính CMCase(U/ml) | |
0 | 0,84± 0,1 |
0,5 | 1,89± 0,18 |
1,0 | 1,05 ± 0,15 |
1,5 | 3,25± 0,11 |
2.0 | 0,92 ± 0,15 |
Kết quả trên cho thấy với nồng độ 1.5% bột đậu tương trong môi trường thu được CMCase có hoạt tính cao nhất.
Quá trình nghiên cứu ảnh hưởng của các điều kiện lên men và ảnh hưởng của các nguồn dinh dưỡng trong môi trường nuôi cấy đã tìm được điều kiện phù hợp cho quá trình sinh cellulase từ chủng vi khuẩn MP1.
Vi khuẩn MP1 được nuôi trên môi trường có nồng độ tinh bột 1%, casein 1%, bột đậu tương 1,5 % với các điều kiện nhiệt độ 37ºC, thời gian nuôi cấy 72h, tỷ lệ giống 5%, tốc độ lắc 100 vòng/phút, pH môi trường 7,5 là môi trường phù hợp cho quá trình sinh cellulase. Hoạt độ CMCase đạt cao nhất là 3,25 U/ml. Đây là môi trường được lựa chọn để thu nhận enzym cho các nghiên cứu khảo sát khả năng thủy phân của enzym từ MP1.
3.4.2. Xác định đặc tính cellulase tạo thành bởi Cellulosimicrobium sp. MP1
3.4.2.1. Thu nhận chế phẩm cellulase bằng kết tủa bởi ethanol
Dịch enzym thô thu sau ly tâm được kết tủa sử dụng cồn tuyệt đối với các nồng độ cuối khác nhau 20%, 40%, 60% và 80%.
Bảng 3.15 Thông số enzym từ MP1 sau kết tủa bằng ethanol
V dich (mL) | CMCase (U/mL) | Protein (mg/mL) | Hoạt độ riêng (U/mg) | Hiệu suất thu hồi (%) | Độ tinh sạch | |
E thô | 100 | 3,12 | 0,023 | 1,36 | 100 | 1 |
20% | 10 | 1,60 | 0,03 | 5,25 | 5,13 | 3,85 |
40% | 10 | 2,03 | 0,05 | 3,88 | 6,50 | 2,85 |
60% | 10 | 9,71 | 0,13 | 7,58 | 31,14 | 5,56 |
80% | 10 | 9,80 | 0,18 | 5,46 | 31,43 | 4,00 |
Kết quả Bảng 3.15 cho thấy khi nồng độ ethanol càng cao, lượng protein kết tủa thu được càng nhiều và đạt cao nhất ở nồng độ cồn 80% với hiệu suất thu hồi theo protein đạt 31,43%. Tuy hiệu suất thu hồi enzym đạt cao nhất tại nồng độ cồn 80% nhưng độ tinh sạch chỉ đạt 4,00%. Độ tinh sạch enzym cao nhất tại 60% cồn đạt 5,56. Do đó, chế phẩm enzym ở nồng độ cồn 60% v/v được lựa chọn cho nghiên cứu đặc tính chế phẩm.
3.4.2.2. Xác định đặc tính chế phẩm cellulase thu từ Cellulosimicrobium sp. MP1
Nhiệt độ và pH tối ưu
Protein enzym sau khi kết tủa tại nồng độ cồn 60% v/v được hòa tan trong các dung dịch đệm có pH khác nhau.
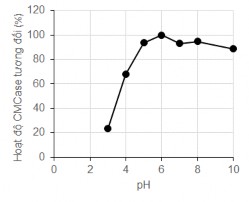
Hình 3.17. Ảnh hưởng của pH đến hoạt độ của enzyme CMCase từ MP1
Kết quả cho thấy khoảng pH hoạt động hiệu quả của enzym kết tủa từ dịch lên men của chủng Cellulosimicrobium sp. MP1 là tương đối rộng từ 5-10. Trong đó ở pH 6 hoạt độ CMCase đo được là lớn nhất, đạt 0,23 ± 0,003 U/ml. Kết quả này phù hợp với một số báo cáo kết luận pH hoạt động tối ưu của cellulase từ Cellulosimicrobium là 5-6 [117][118].
So với nghiên cứu tách cellulases kiềm tính từ Bacillus subtilis của Deepmoni Deka (trong đó, hoạt độ CMCase đạt tối ưu ở pH 9, nhưng hoạt tính chỉ đạt 70% ở các pH 8 và 10), enzym cellulase từ Cellulosimicrobium sp. MP1 có khoảng pH hoạt động tối ưu rộng hơn, tại pH 10 hoạt độ vẫn đạt gần 90% so với pH tối ưu. Đây là một đặc điểm đáng chú ý có tiềm năng ứng dụng của enzym CMCase thu từ chủng Cellulosimicrobium sp. MP1.
Protein enzym sau khi kết tủa được hòa tan trong đệm Na-phosphate pH 6,0 pha loãng thích hợp và thực hiện phản ứng với cơ chất CMC (hòa tan trong đệm tương ứng) ở các nhiệt độ khác nhau.
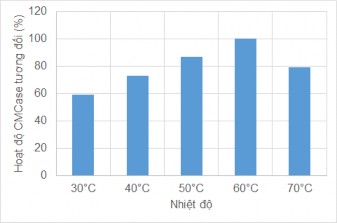
Hình 3.18. Ảnh hưởng của nhiệt độ đến hoạt tính CMCase từ MP1
Kết quả cho thấy hoạt độ CMCase cao nhất ở 600C, cao hơn nhiệt độ 500C trong công bố của Jian-Min Song và công sự khi nghiên cứu cellulases từ C.cellulans [118]. Ở nhiệt độ 700C, hoạt độ enzym CMCase giảm 20% so với hoạt độ xác định ở nhiệt độ tối ưu.
Xác định độ bền nhiệt và bền pH
Kết quả Hình 3.19 cho thấy ở pH axit bằng 4, hoạt tính enzym giảm mạnh còn 20% sau 20h. Tuy nhiên, từ khoảng pH 5, độ bền hoạt độ enzyme duy trì tương đối ổn định từ 70-80%.
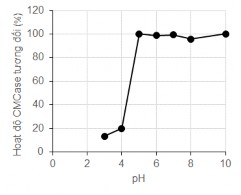
Hình 3.19. Độ bền pH của chế phẩm cellulase từ MP1
Trong nghiên cứu của Jian-Min Song và cộng sự, hoạt tính CMCase thu từ C.cellulans giảm mạnh còn 18% sau 6 giờ ở pH axit 3 và 4. Kết luận này tương đối phù hợp với kết quả thí nghiệm thể hiện trong Hình 3.19. Tuy nhiên, ở các giá trị pH khác, hoạt tính cellulase của chủng MP1 duy trì ổn định tốt hơn so với nghiên cứu của Jian-Min Song. Cụ thể, hoạt tính tương đối của CMCase từ C. cellulans còn lại lần lượt là 34,39% và 26,26% sau 6giờ ở pH 5 và pH 7, trong khi enzym CMCase từ MP1 duy trì hoạt tính đến 70% sau 20 giờ ở khoảng pH khá rộng từ 5- 10.
Kết quả Hình 3.20 cho thấy ở nhiệt độ càng cao, sự suy giảm hoạt tính diễn ra càng nhanh và càng sớm ngay ở những giờ đầu tiên. Sau 2 giờ, hoạt tính CMCase ở nhiệt độ 40°C và 50°C giảm không đáng kể còn hơn 90%. Hoạt tính CMCase tương đối còn 70% ở nhiệt độ 60°C và giảm mạnh còn 30% ở nhiệt độ 70°C sau 2 giờ. Khi kéo dài đến 4giờ, hoạt độ của enzym ủ ở các nhiệt độ 40, 50, 60°C giảm còn 40-43% trong khi hoạt độ chỉ còn 10% ở 70°C. Trong nghiên cứu về độ bền
nhiệt của cellulases thu từ C.cellulans của Jian-Min Song và cộng sự, ở nhiệt độ 45°C, cellulase còn giữ được 55,68% hoạt tính sau 6h còn ở nhiệt độ 600C hoạt độ enzym giảm mạnh đến 75-90% . Đối với chủng MP1, hoạt độ CMCase cũng giảm tương tự đến 60% sau 4h ở 600C.
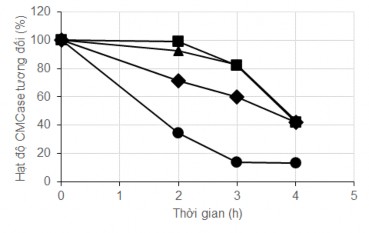
Hình 3.20. Độ bền nhiệt chế phẩm cellulase từ MP1
3.5. So sánh giữa B. subtilis G4 và Cellulosimicrobium sp. MP1
Bảng 3.16. So sánh giữa enzyme từ B. subtilis G4 và Cellulosimicrobium sp. MP1
B. subtilis G4 | Cellulosimicrobium sp. MP1 | |
Enzym thô | ||
Hoạt độ CMCase tối ưu | 5,59± 0,11 | 3,25± 0,13 |
Hoạt độ FPU | 0,113 ± 0,005 | 0,325± 0,10 |
Hoạt độ xylanase | 0,170± 0,006 | 1,14±0,06 |
Chê phẩm cellulase | ||
pH tối ưu | 7.0 | 6.0 |
Bền pH | 5-8 | 5-10 |
Nhiệt độ tối ưu (°C) | 60 | 60 |
Bền nhiệt (°C) | 40-50 | 40-50 |
Mặc dù enzym thô từ B. subtilis G4 có hoạt độ CMCase cao hơn từ
Cellulosimicrobium sp. MP1. Tuy nhiên, hoạt tính FPU và xylanase đều thấp hơn






