
30
Ph©n bè (%)
20
10
0
Có thể bạn quan tâm!
-
 Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance
Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance -
 Tổng Trở Của Quá Trình Điện Cực Nhiều Giai Đoạn
Tổng Trở Của Quá Trình Điện Cực Nhiều Giai Đoạn -
 Phân Tích Thành Phần Pha Và Cấu Trúc Tinh Thể Của Hợp Kim
Phân Tích Thành Phần Pha Và Cấu Trúc Tinh Thể Của Hợp Kim -
 Giản Đồ Nhiễu Xạ Tia X Của Bột Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Kích Thước Hạt 800 Nm Sau Khi Ngâm 48 Giờ Trong Koh 6M
Giản Đồ Nhiễu Xạ Tia X Của Bột Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Kích Thước Hạt 800 Nm Sau Khi Ngâm 48 Giờ Trong Koh 6M -
 Ảnh Hưởng Của Kích Thước Hạt Hợp Kim Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Đến Dung Lượng Bề Mặt Q S
Ảnh Hưởng Của Kích Thước Hạt Hợp Kim Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Đến Dung Lượng Bề Mặt Q S -
 Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 11
Chế tạo hợp kim gốc lani5 làm vật liệu điện cực âm độ bền cao để sử dụng trong ăcquy ni-mh - 11
Xem toàn bộ 104 trang tài liệu này.
0 1 2 3 4 5
KÝch thíc h¹t (m)
Hình 3.18. Ảnh SEM và đường phân bố kích thước hạt của hợp kim LaNi3,9Co0,4Mn0,4Al0,3 sau 3 giờ nghiền trên máy Spex 8000D

40
Ph©n bè (%)
30
20
10
0
0 1 2 3
KÝch thíc h¹t (m)

Hình 3.19. Ảnh SEM và đường phân bố kích thước hạt của hợp kim LaNi3,9Co0,4Mn0,4Al0,3 sau 5 giờ nghiền trên máy Spex 8000D
40
Ph©n bè (%)
30
20
10
0
0.0 0.2 0.4 0.6 0.8 1.0 1.2
KÝch thíc h¹t (m)
Hình 3.20. Ảnh SEM và đường phân bố kích thước hạt của hợp kim LaNi3,9Co0,4Mn0,4Al0,3 sau 20 giờ nghiền trên máy Spex 8000D
Ảnh SEM, phân bố kích thước hạt sau 20 giờ nghiền được thể hiện trên hình 3.20. Hợp kim thu được có kích thước hạt phân bố trong khoảng từ 0,3
µm đến 1 µm, kích thước hạt trung bình đạt khoảng 0,6 µm.

60
Ph©n bè (%)
50
40
30
20
10
0
0.0 0.2 0.4 0.6 0.8 1.0
KÝch thíc h¹t (m)
Hình 3.21. Ảnh SEM và đường phân bố kích thước hạt của hợp kim LaNi3,9Co0,4Mn0,4Al0,3 sau 30 giờ nghiền trên máy Spex 8000D
Sau 30h nghiền (hình 3.21), hợp kim thu được có kích thước hạt phân bố tập trung trong khoảng từ 0,1 µm đến 0,5 µm, trong đó kích thước hạt trung bình đạt được khoảng 0,3 µm.
Kết quả theo dõi biến đổi hình thái của hạt hợp kim trong quá trình nghiền trên thiết bị Spex 8000D cho thấy giai đoạn hình thành hạt dạng phiến đã không xảy ra, điều này là do năng lượng nghiền của máy Spex 8000D lớn hơn máy Frisch P6 [92].
Tổng hợp kết quả biến đổi của kích thước hạt trung bình theo thời gian nghiền trên máy nghiền năng lượng cao Spex 8000D được thể hiện trên hình
3.22. Kết quả cho thấy trong 5 giờ đầu tiên, kích thước hạt giảm gần như tuyến tính theo thời gian với độ dốc lớn, kích thước hạt trung bình đạt 1,2 µm. Tăng thời gian nghiền mẫu, kích thước tiếp tục giảm nhưng tốc độ chậm, sau 30 giờ nghiền, kích thước hạt trung bình đạt được vào khoảng 0,3 µm.
KÝch thíc h¹t (m)
3.0
2.5
2.0
1.5
1.0
0.5
0.0
0 5 10 15 20 25 30
Thêi gian nghiÒn (giê)
Hình 3.22. Ảnh hưởng của thời gian nghiền đến kích thước hạt trung bình của hợp kim LaNi3,9Co0,4Mn0,4Al0,3 nghiền trên thiết bị Spex 8000D
3.2.3. Biến đổi cấu trúc tinh thể của hợp kim trong quá trình nghiền
nghiÒn 20 giê
nghiÒn 5 giê
hîp kim ban ®Çu
d = 2,958
d = 2,516
d = 2,117
d = 2,029
Hợp kim trước khi nghiền và sau những khoảng thời gian nghiền được theo dõi biến đổi thành phần pha và cấu trúc tinh thể bằng phương pháp nhiễu xạ tia X trên máy D8 – ADVANCE. Giản đồ nhiễu xạ tia X của hợp kim theo thời gian nghiền được thể
hiện trên các hình 3.23 và 3.24.Trong quá trình nghiền, giản đồ nhiễu xạ tia X vẫn thể hiện đầy đủ bốn vạch nhiễu xạ đặc trưng của tinh thể LaNi5. Bề ngang của các vạch nhiễu
xạ có xu hướng nở rộng ra theo thời gian nghiền. Điều
100
Cêng ®é (®.v.t.®)
80
60
40
20
0
20 30 40 50 60 70
Gãc 2 (®é)
này cho thấy kích thước
tinh thể của hợp kim đã nhỏ đi theo thời gian nghiền.
Hình 3.23. Biến đổi của giản đồ nhiễu xạ tia
X của hợp kim LaNi3,8Co0,5Mn0,4Al0,3 theo thời gian nghiền trên máy Fritsch P6
d = 2,939
Hợp kim chưa bị biến đổi cấu trúc mạng tinh thể khi thời gian nghiền lên tới 30 giờ, trên máy Spex 8000D. Mặt khác, trên giản đồ không thấy xuất hiện pha mới, điều này cho thấy hợp kim đã được bảo vệ không
160
Cêng ®é (®.v.t.®)
140
120
100
80
60
40
20
0
nghiÒn 30 giê
nghiÒn 20 giê hîp kim ban ®Çu
d = 2,507
d = 2,183
d = 2,131
d = 1,996
20 30 40 50 60 70
Gãc 2 (®é)
bị ô xy hóa và phân hủy
trong quá trình nghiền.
Hình 3.24. Biến đổi của giản đồ nhiễu xạ tia X của hợp kim LaNi Co Mn Al theo thời
3,8 0,5 0,4 0,3
gian nghiền trên máy Spex 8000D
3.3. Kết luận chương 3
Từ các kết quả nghiên cứu chế tạo hợp kim LaNi4,3-xCoxMn0,4Al0,3 chúng tôi rút ra những kết luận như sau:
1. Xác định được quy trình chế tạo LaNi4,3-xCoxMn0,4Al0,3 bằng phương pháp nấu luyện hồ quang để thu được hợp kim có thành phần hóa học tốt nhất với các điều kiện là:
- Cân dư 1% lantan, từ 5% đến 7% mangan so với công thức hóa học.
- Quá trình nấu hợp kim chia thành hai giai đoạn, giai đoạn thứ nhất nấu hợp kim chứa các nguyên tố Ni, Co, Mn và Al, giai đoạn thứ hai cho thêm lantan để nấu thành hợp kim LaNi4,3-xCoxMn0,4Al0,3.
2. Xác định được thời gian, tốc độ và thiết bị nghiền hợp kim LaNi4,3- xCoxMn0,4Al0,3 để có kích thước hạt trung bình định sẵn và đảm bảo hợp kim không bị ô xy hóa, cụ thể là:
- Thời gian nghiền từ 5 giờ đến 14 giờ, bảo vệ bằng axeton, tốc độ 500
vòng/phút trên thiết bị Frisch P6 thu được hợp kim có kích thước hạt trung
bình từ 2 µm đến 0,8 µm.
- Thời gian nghiền từ 3 giờ đến 30 giờ, bảo vệ bằng axeton, tốc độ 1200 vòng/phút trên máy Spex 8000D thu được hợp kim có kích thước hạt trung bình từ 2 µm đến 0,3 µm.
- Với cùng yêu cầu về kích thước hạt thì thời gian nghiền trên thiết bị Spex 8000D ngắn hơn trên thiết bị Frisch P6, đặc biệt là với hợp kim có yêu cầu kích thước hạt từ 1 µm trở lên.
3. Đã chế tạo được hợp kim bột LaNi4,3-xCoxMn0,4Al0,3 có kích thước hạt từ 200 nm đến 1,5 µm bằng phương pháp nấu luyện hồ quang và nghiền cơ. Hợp kim chế tạo được có thành phần hợp thức, có cấu trúc tinh thể.
CHƯƠNG 4
NGHIÊN CỨU ĂN MÒN HỢP KIM LaNi4,3-xCoxMn0,4Al0,3 TRONG DUNG DỊCH KOH
Ở trạng thái nạp đầy, do tạo thành hyđrua nên hợp kim được bảo vệ,
giảm tối thiểu ăn mòn điện hoá. Tuy nhiên, khi chưa nạp điện hoặc ở trạng thái không tích điện, hợp kim sẽ bị ăn mòn do tác động của môi trường KOH [15]. Chương này trình bày nghiên cứu ăn mòn điện cực khối hợp kim gốc LaNi5 và ăn mòn hợp kim bột khi chưa có tác động hoạt hóa và phóng nạp trong môi trường KOH 6M bằng các phương pháp điện hóa và phân tích sản phẩm ăn mòn.
4.1. Nghiên cứu ăn mòn điện cực khối LaNi4,3-xCoxMn0,4Al0,3
Ăn mòn của hợp kim LaNi4,3-xCoxMn0,4Al0,3 trong dung dịch KOH 6M được nghiên cứu bằng phương pháp điện hóa trên điện cực khối, cách chế tạo điện cực như đã trình bày trong mục 2.1.3. Sử dụng hai phương pháp không phá hủy: phương pháp phân cực tuyến tính và phương pháp phổ tổng trở điện hoá EIS. Các phép đo điện hoá được thực hiện tại nhiệt độ phòng, trên thiết bị Autolab PGSTAT 30 kèm phần mềm điều khiển, thu nhận và xử lý số liệu.
Bình điện hoá 3 điện cực, điện cực làm việc được chế tạo từ hợp kim LaNi4,3-xCoxMn0,4Al0,3, được mài phẳng bằng các loại giấy nhám số 800, 1200 và 1500. Điện cực đối Pt dạng lưới có diện tích lớn gấp nhiều lần so với điện cực làm việc, điện cực so sánh calomel bão hoà (SCE). Điện cực làm việc và điện cực đối được nhúng trong dung dịch KOH 6M. Điện cực so sánh được nối với bình điện hoá bằng hệ cầu KOH, bình trung gian và cầu muối KCl.
Phương pháp phân cực tuyến tính được sử dụng trong nghiên cứu ăn mòn do có ưu điểm là không gây ảnh hưởng nhiều đến tính chất của vật liệu nghiên cứu, là phương pháp không gây phá huỷ mẫu. Để tránh tác động của phân cực đến trạng thái bề mặt của điện cực trong nghiên cứu này chúng tôi
quét thế trong khoảng hẹp, ± 5 mV so với điện thế ăn mòn Ecorr, tốc độ 0,1
mV/s. Đường cong phân cực dạng Tafel của các mẫu với thời gian ngâm khác nhau được giới thiệu trong hình 4.1.
1 giê
1,00
0,25
0,75
3 giê
1,00
0,75
0,25
10µ 10µ
i (A/cm2)
i (A/cm2)
1µ
1µ
100n
-0.50 -0.45 -0.40 -0.35 -0.30
E(V/SCE)
100n
10n
-0.50 -0.45 -0.40
E (V/SCE)
1 giê
0,25
1,00
0,75
i (A/cm2)
10µ
1µ
100n
-0.55 -0.50 -0.45 -0.40
E (V/SCE)
Hình 4.1. Đường cong Tafel của điện cực LaNi4,3-xCoxMn0,4Al0,3 theo thời gian ngâm trong dung dịch KOH 6M, giá trị x ghi trên hình
Từ các đường cong như đã giới thiệu trong hình 4.1, dùng phần mềm
GPES 4.9 chúng tôi đã xác định điện thế ăn mòn Ecorr, mật độ dòng ăn mòn icorr, điện trở phân cực Rp, kết quả được giới thiệu trong các hình 4.2, 4.3 và 4.4.
Đối với các mẫu điện cực có tỷ lệ x = 0,25 và x = 0,75, Ecorr có xu hướng dịch về phía âm theo thời gian ngâm, tức là về mặt nhiệt động khả năng xảy ra ăn mòn của hai mẫu này tăng theo thời gian ngâm, có thể do sự hòa tan các sản phẩm ăn mòn đã tạo thành trước đó trên bề mặt điện cực [72, 79]. Đối với mẫu có tỷ lệ x = 1 không thấy có quá trình giảm điện thế trong khoảng thời gian đầu, ngược lại sau 3 giờ ngâm điện thế ăn mòn dịch chuyển về phía dương, cho thấy điện cực đang có xu hướng bền ăn mòn
x = 0,75
x = 1,00
x = 0,25
hơn, điều này có thể được giải thích bằng sự hình thành màng thụ động trên
bề mặt khi hàm lượng Co trong hợp kim đủ cao.
Biến thiên dòng ăn mòn của các mẫu theo thời gian ngâm được trình bày trên hình 4.3. Trong khoảng 3 giờ đầu, các mẫu đều bị ăn mòn, tốc độ ăn
-0.30
(V/SCE)
-0.35
-0.40
corr
-0.45
E
-0.50
-0.55
1 2 3 4 5
thêi gian (giê)
mòn i0 tăng theo thời gian. Mẫu có tỷ lệ x = 0,25 bị ăn
Hình 4.2. Biến thiên thế ăn mòn của điện cực LaNi Co Mn Al theo thời gian ngâm
4,3-x x 0,4 0,3
mòn mạnh nhất, i0 tăng
mạnh trong khoảng 5 giờ
trong dung dịch KOH 6M
đầu, sau đó giảm. Sau 2 giờ tốc độ ăn mòn của mẫu có tỷ lệ x = 0,75 đã đạt trạng thái ổn định với i0 = 3 μA/cm2. Với mẫu có tỷ lệ x = 1 tốc độ ăn mòn đạt giá trị cực đại sau 3 giờ với i0 = 3,5 μA/cm2 sau đó giảm xuống xấp xỉ 2,0
x = 0,25
x = 0,75
x = 1,00
μA/cm2 sau 4 giờ.
Sự biến thiên của điện trở phân cực theo thời gian được giới thiệu trên hình 4.4. Rp của mẫu với x
= 0,25 giảm theo thời gian ngâm mẫu, sau 5 giờ đạt giá trị thấp nhất so với các mẫu còn lại. Các mẫu với x
= 0,75 và x = 1 cho giá trị
8µ
i (A/cm2)
6µ
corr
4µ
2µ
1 2 3 4 5
Thêi gian ng©m (giê)
Hình 4.3. Biến thiên dòng ăn mòn của điện cực LaNi Co Mn Al theo thời gian ngâm
4,3-x x 0,4 0,3
Rp ít biến đổi theo thời gian.
trong dung dịch KOH 6M
Sau 5 giờ, mẫu với tỉ lệ co ban x = 1 cho giá trị RP cao nhất. Kết quả này cho thấy vai trò hạn chế sự ăn mòn của thành phần Co trong hợp kim.
Phép đo tổng trở được thực hiện tại điện thế
1000
R (.cm2)
800
p
600
400
x = 1,00
x = 0,75
x = 0,25
1 2 3 4 5
Thêi gian ng©m (giê)
ăn mòn, với tín hiệu điện
xoay chiều có biên độ 10 mV, khoảng tần số quét
Hình 4.4. Biến thiên điện trở phân cực của điện cực LaNi4,3-xCoxMn0,4Al0,3 theo thời gian ngâm trong dung dịch KOH 6M
10000 0.01 Hz. Phổ tổng trở Nyquist của mẫu có tỉ lệ Co khác nhau được giới thiệu trong hình 4.5. Có thể nhận thấy trên phổ tổng trở hình 4.5 quá trình ăn mòn có ảnh hưởng của khuếch tán. Điều này có thể giải thích là trong quá trình ăn mòn trên bề mặt điện cực hình thành lớp sản phẩm khó tan, đó là lớp hyđrôxit của các kim loại cấu thành hợp kim, sự có mặt của lớp sản phẩm này sẽ cản trở quá trình ăn mòn tiếp theo.
1 giê
5 giê
6 giê
3 giê
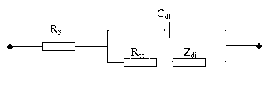
350
300
-Z'' (.cm2)
250
200
150
100
50
0
0 200 400 600 800 1000 1200
Z' (.cm2)
Hình 4.5. Biến đổi phổ tổng trở tại Ecorr của điện cực LaNi4,05Co0,25Mn0,4Al0,3 theo thời gian ngâm trong dung dịch KOH 6M
Hình 4.6. Sơ đồ mạch điện tương đương của điện cực LaNi4,3-
xCoxMn0,4Al0,3
RS : Điện trở dung dịch,
Rct : Điện trở chuyển điện tích, Cdl: Điện dung lớp điện tích kép, Zdi: tổng trở khuếch tán.
Sử dụng công cụ làm khớp
trong phần mềm FRA 4.9 áp dụng sơ đồ mạch điện tương đương như trên hình 4.6, các thông số điện hoá như điện trở chuyển điện tích Rct và điện dung lớp điện tích kép Cdl được xác định theo thời gian ngâm
4000
R (.cm2)
3000
ct
2000
1000
0
x =1
x =0,75
x =0,25
1 2 3 4 5
Thêi gian ng©m (giê)
mẫu trình bày trên các hình
4.7 và hình 4.8.
Giá trị điện trở trao đổi điện tích tăng theo tỷ lệ Co trong mẫu và đạt cực đại với mẫu có x = 1.
Ảnh hưởng của Co đến điện dung lớp điện tích kép thể hiện trên hình 4.8, điện dung Cdl đạt giá trị cao nhất tại mẫu có tỷ lệ x = 1. Trong một hệ ăn mòn thông thường, giá trị Rct và Cdl thường biến thiên ngược
Hình 4.7. Biến thiên điện trở chuyển điện tích của điện cực LaNi4,3-xCoxMn0,4Al0,3 theo thời gian ngâm trong dung dịch KOH 6M
x=1
x=0,75
x=0,25
1000
C (F/cm2)
800
600
dl
400
200
0
1 2 3 4 5
Thêi gian ng©m (giê)
Hình 4.8. Biến thiên điện dung lớp điện tích kép của điện cực LaNi4,3-xCoxMn0,4Al0,3 theo thời gian trong dung dịch KOH 6M
chiều nhau, tích của hai giá trị này là một hằng số. Đối với hệ đang xét, ngoài
quá trình ăn mòn điện hóa của hợp kim, trên điện cực còn có quá trình hấp thụ và nhả hấp thụ hyđrô, có thể đây là nguyên nhân dẫn đến tăng Cdl.
Ăn mòn hợp kim LaNi4,3-xCoxMn0,4Al0,3 trong môi trường KOH 6M đã
được nghiên cứu bằng các phương pháp điện hoá. Các kết quả cho thấy coban
có tác dung kìm hãm sự ăn mòn của hợp kim. Mẫu có tỷ lệ x = 0,25 có tốc độ ăn mòn cao nhất, sau 5 giờ ngâm mật độ dòng ăn mòn đạt đến khoảng 7 μA/cm2, cao gấp hơn 2 lần so với các mẫu còn lại, giá trị điện trở trao đổi điện tích thấp nhât, khoảng 600 Ω.cm2, nhỏ hơn 3 lần so với mẫu với x = 0,75 và 6 lần so với mẫu với x = 1. Mẫu hợp kim với x = 1 có tốc độ ăn mòn nhỏ nhất, giá trị điện trở phân cực và điện trở trao đổi điện tích lớn nhất.
4.2. Nghiên cứu ăn mòn hợp kim bột LaNi4,3-xCoxMn0,4Al0,3
Hợp kim LaNi5 có kích thước hạt nhỏ có bề mặt riêng lớn, quãng đường khuếch tán nhỏ sẽ cho tốc độ phóng nạp cao, dung lượng riêng lớn, tăng hiệu quả sử dụng của vật liệu. Tuy nhiên khi giảm kích thước hạt hợp kim, bề mặt tiếp xúc với dung dịch điện ly lớn, do vậy sự ăn mòn cũng tăng.
Trong các thử nghiệm về ăn mòn hợp kim bột, mỗi mẫu thử nghiệm có khối lượng 1 gam, kích thước hạt 800 nm, được ngâm trong 10ml dung dịch KOH 6M tại nhiệt độ phòng. Sau thử nghiệm, mẫu bột được gạn lọc, rửa bằng cồn đến pH 10, sấy khô và phân tích nhiễu xạ tia X, dung dịch được phân tích thành phần kim loại hòa tan bằng phương pháp khối phổ plasma cảm ứng (ICP – MS).
Mn
Co Ni La
Al
Hµm lîng (mg/l)
Hµm lîng (mg/l)
1.5 20
15
1.0
10
0.5
5
0.0
0 1 2 3 4 5
Thêi gian ng©m (giê)
0
0 1 2 3 4 5
Thêi gian ng©m (giê)
Hình 4.9. Biến thiên hàm lượng các kim loại hòa tan theo thời gian ngâm bột LaNi3,8Co0,5Mn0,4Al0,3 kích thước hạt 800 nm trong dung dịch KOH 6M
Hàm lượng kim loại hòa tan thay đổi theo thời gian ngâm mẫu, cụ thể hàm lượng các nguyên tố La, Ni, Mn, Co, Al tăng trong khoảng 2 giờ đầu sau đó gần như ổn định. Hàm lượng nhôm tan trong dung dịch là lớn nhất so với các nguyên tố còn lại, điều này có thể giải thích vì nhôm là một nguyên tố lưỡng tính, tan được trong kiềm. Nồng độ các kim loại hòa tan đều nhỏ, cỡ vài mg/l cho đến khoảng 15 mg/l. Kết quả này tương đương với các nghiên cứu ăn mòn bột hợp kim gốc LaNi5 kích thước lớn hơn [3].
bét ng©m 24 giê
bét ban ®Çu
d = 2,943
d = 2,500
d = 2,120
200
Cêng ®é (®.v.t.®)
d = 2,041
150
100
d = 1,787
50
0
20 30 40 50 60 70
Gãc 2 (®é)
Hình 4.10. Giản đồ nhiễu xạ tia X của bột LaNi3,8Co0,5Mn0,4Al0,3 kích thước hạt 800 nm ban đầu và sau khi ngâm 24 giờ trong KOH 6M
Phổ nhiễu xạ tia X của hợp kim bột sau khi thử nghiệm ăn mòn với thời gian ngâm khác nhau được giới thiệu trên các hình 4.10, 4.11 và 4.12. Sau 24 giờ ngâm mẫu đã bắt đầu có sự biến đổi nhất định. Trên phổ nhiễu xạ tia X có một số vạch nhiễu xạ mất đi, một số vạch bị biến dạng (hình 4.10).






