Xác định dung lượng bề mặt bằng phương pháp CV [36].
Xét dung lượng phóng điện Q(v), gồm các dung lượng thành phần: Q(v) = Qht(v) + QA(v) + QS (2.9)
trong đó : Qht: Dung lượng do giải phóng hyđrô hấp thụ trong hợp kim QA: Dung lượng phản ứng phân cực hoạt hoá
QS: Dung lượng do giải phóng hyđrô bề mặt
Qht và QA đều phụ thuộc rất mạnh vào vận tốc quét, và tiến dần đến 0 khi vận tốc quét tăng dần đến vô cùng.
QS không phụ thuộc vào vận tốc quét và được tính theo công thức: QS = nFA (2.10)
Trong đó: A là diện tích bề mặt phản ứng điện hoá hiệu dụng, là độ phủ bề mặt của hyđrô.
Sự phụ thuộc của dung lượng Q vào vận tốc được thể hiện bằng công thức gần đúng sau:
Q(v) i(E)dt (E) 1
v
(2.11)
Vì vậy khi tốc độ quét càng lớn thì Qht và QA càng nhỏ và Qv càng gần với Qs. Từ số liệu thực nghiệm, xây dựng đồ thị Q(v) - 1/v, ngoại suy tốc độ quét v tiến đến vô cùng để xác định Qs
2.3.3. Phương pháp tổng trở điện hoá
2.3.3.1. Nguyên lý chung [5]
Nội dung của phương pháp là áp đặt một dao động nhỏ của điện thế hoặc của dòng điện lên hệ thống được nghiên cứu. Tín hiệu đáp ứng thường có tín hiệu hình sin và lệch pha với dao động áp đặt. Đo sự lệch pha và tổng trở của hệ thống điều hòa cho phép phân tích đóng góp sự khuyếch tán, động học, lớp kép, phản ứng hóa học... vào quá trình điện cực.
Một bình điện phân có thể coi như một mạch điện bao gồm những
thành phần chủ yếu sau (Hình 2.17): Điện dung của lớp kép, coi như một tụ điện Cđ. Tổng trở của quá trình Faraday Zf. Điện trở chưa được bù RΩ, đó là điện trở dung dịch giữa điện cực so sánh và điện cực nghiên cứu.
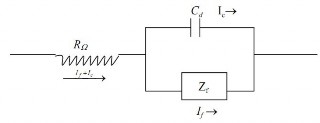
Hình 2.17. Mạch điện tương đương của bình điện phân
Tổng trở Faraday Zf. thường được phân thành điện trở chuyển điện tích
Rct nối tiếp với tổng trở khuyếch tán ZW (tổng trở Warbug)
Nếu phản ứng chuyển điện tích dễ dàng Rct → 0 và ZW sẽ khống chế. Còn khi phản ứng chuyển điện tích khó khăn thì Rct → ∞ và lúc đó Rct khống chế. Để tính toán Rct, ZW, ZR ta sử dụng phương pháp biên độ phức.
Điện trở chuyển điện tích: Rct = 6y = RT
(2.12)
6i nFi0
Tổng trở khuếch tán Warbug Zw: Rw = σω-1/2 (2.13)
0
trong đó o = RT (nF)2C∗ƒ2D0
hằng số Warbug
Cw =
và ta có điện dung của tụ điện Warbug1
om1/2
Biểu diễn tổng trở trên mặt phẳng phức (đồ thị Nyquist):
Tổng trở bình điện phân thể viết như sau:
(2.14)
bdp N
Z = R +1
jmCd+[Rct+(1–j)om—½]—1
= Zr − jZrr(2.15)
Zr và Zrr là phần thực và phần ảo của tổng trở.
d
Phân li phần thực và phần ảo ta được:
Zr = RN
+ Rct+om—½ (om½Cd+1)2+m2C2[Rct+om—½]2
(2.16)
(2.17)
Khi ω → 0 (2.18)
(2.19)
Đường biểu diễn Z’ theo Z” sẽ là đường thẳng với độ dốc bằng 1 và sẽ được ngoại suy đế cắt trục thực Z’ tại ( . Đường thẳng này tương ứng với khống chế khuyếch tán và tổng trở Warbug, góc π/4 (Hình 2.18)
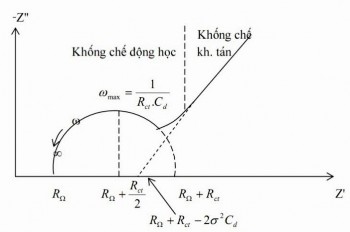
Hình 2.18. Tổng trở trên mặt phẳng phức
Khi ω → ∞ thì ở tần số cao phản ứng chỉ bị khống chế động học và Rct >> Z Suy ra: (2.20)
(2.21)
Cuối cùng ta có: (2.22)
Phương trình (2.22) chính là biểu thức của vòng tròn bán kính là và cắt trục Z’ tại RΩ khi ω → ∞. Khi quá trình điện cực gồm nhiều giai đoạn thì ta có thể thấy các nửa vòng tròn liên tiếp xuất hiện (hình 2.19)
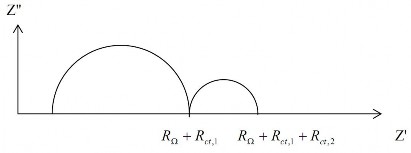
Hình 2.19. Tổng trở của quá trình điện cực nhiều giai đoạn
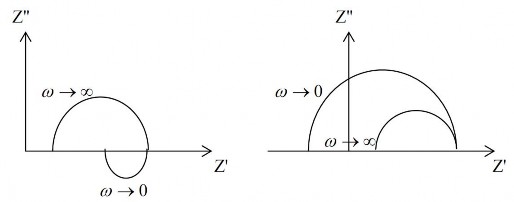
Khi có sự hấp phụ còn thấy nửa vòng tròn ở phía dưới Z’ khi ω → ∞, và khi có sự thụ động còn thấy giá trị điện trở âm hình 2.20.
a b
Hình 2.20. Tổng trở khi có sự hấp phụ đặc biệt (a) và khi có sự thụ động (b)
2.3.3.2. Phương pháp EIS trong nghiên cứu điện cực LaNi5
Theo mô hình tổng trở điện cực MH của Chunsheng Wang [105], phản ứng hydrid hoá bao gồm bước chuyển điện tích, tiếp theo là quá trình vận chuyển hyđrô hấp phụ tới vị trí hấp thụ ở vùng sát bề mặt, sau đó khuếch tán hyđrô hấp thụ từ sát bề mặt vào trong khối vật liệu. Khi nồng độ Habs trong khối vật liệu vượt quá độ tan của H trong kim loại sẽ xảy ra sự chuyển pha.
(2.23) | |
MHad MHab(surface) | (2.24) |
MHab(surface) MHab(bulk,) | (2.25) |
MHab(bulk,) MHab(bulk,) | (2.26) |
Có thể bạn quan tâm!
-
![Biến Thiên Nhiệt Độ Theo Điện Lượng Và Tốc Độ Nạp Điện [68]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Biến Thiên Nhiệt Độ Theo Điện Lượng Và Tốc Độ Nạp Điện [68]
Biến Thiên Nhiệt Độ Theo Điện Lượng Và Tốc Độ Nạp Điện [68] -
![Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2075%2075%22%3E%3C/svg%3E) Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]
Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15] -
 Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance
Nguyên Lý Máy Nhiễu Xạ Tia X 4 Vòng Tròn Và Thiết Bị D8 – Advance -
 Phân Tích Thành Phần Pha Và Cấu Trúc Tinh Thể Của Hợp Kim
Phân Tích Thành Phần Pha Và Cấu Trúc Tinh Thể Của Hợp Kim -
 Ảnh Sem Và Đường Phân Bố Kích Thước Hạt Của Hợp Kim Lani 3,9 Co 0,4 Mn 0,4 Al 0,3 Sau 3 Giờ Nghiền Trên Máy Spex 8000D
Ảnh Sem Và Đường Phân Bố Kích Thước Hạt Của Hợp Kim Lani 3,9 Co 0,4 Mn 0,4 Al 0,3 Sau 3 Giờ Nghiền Trên Máy Spex 8000D -
 Giản Đồ Nhiễu Xạ Tia X Của Bột Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Kích Thước Hạt 800 Nm Sau Khi Ngâm 48 Giờ Trong Koh 6M
Giản Đồ Nhiễu Xạ Tia X Của Bột Lani 3,8 Co 0,5 Mn 0,4 Al 0,3 Kích Thước Hạt 800 Nm Sau Khi Ngâm 48 Giờ Trong Koh 6M
Xem toàn bộ 104 trang tài liệu này.
Trên mô hình này, tác giả đã đưa ra tổng trở của điện cực MH như sau [118]:
(2.27)
Trong đó:
Rs: Điện trở của dung dịch, Cdl: Điện dung của lớp điện tích kép, Rct: Điện trở chuyển điện tích, Cad: Điện dung của lớp hấp phụ,
Rab: Điện trở của quá trình hấp thụ, σ: Hệ số trở kháng khuếch tán hyđrô, D: Hệ số khuếch tán của H, i: Mật độ dòng điện.
Sơ đồ mạch điện tương đương được biểu diễn trên hình 2.21.
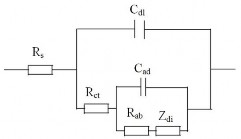
Hình 2.21. Sơ đồ mạch điện tương đương của điện cực MHx với Zdi là tổng trở khuếch tán [105]
W. L. Zhang et al [114] đưa ra sơ đồ mạch điện tương đương cho điện
cực MHx như hình 2.22.
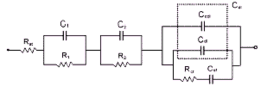
Hình 2.22. Sơ đồ mạch điện tương đương của điện cực MHx [114]
Phổ tổng trở có thể được biểu diễn theo hai dạng: phổ Nyquist hoặc phổ Bode. Hai dạng phổ tổng trở của điện cưc âm LaNi5 được thể hiện trên các hình 2.23 và 2.24.
12
10
-Z''()
8
6
4
2
0
0 5 10 15 20 25 30 35 40
Z'()
Hình 2.23. Phổ tổng trở Nyquist của điện cực LaNi3,8Co0,5Mn0,4Al0,3 tại E = -1,2V/SCE [103]
50
- lÖch pha (®é)
1.5
40
log(Z)
1.0 30
0.5 20
10
0.0
0
-1 0 1 2 3 4 5
log(f)
Hình 2.24. Phổ tổng trở Bode của điện cực LaNi3,8Co0,5Mn0,4Al0,3 tại E=-1.2V/SCE [103]
Qua đó cho thấy phổ Nyquist chỉ có hình nửa vòng cung. Vì vậy sơ đồ mạch tương đương của điện cực gốc LaNi5 được biểu diễn như trên hình 2.25.
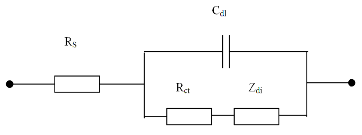
Hình 2.25. Sơ đồ mạch tương đương của điện cực gốc LaNi5
Ở đây: RS: Điện trở dung dịch, Rct: Điện trở chuyển điện tích, Cdl: Điện dung lớp điện kép, Zdi: Tổng trở khuếch tán,
Từ sơ đồ tương đương, theo công thức: = 1
Rct.Cd
có thể tính được: điện
dung của lớp điện tích kép ở mỗi thế điện cực, điện trở chuyển điện tích, sự phụ thuộc của điện trở Z’ vào nồng độ của các chất phụ gia đưa vào điện cực và tần số quét. Từ đó có thể nghiên cứu về hấp thụ trên điện cực làm cơ sở quan trọng để nghiên cứu cơ chế quá trình điện cực.
2.3.4. Phương pháp dòng tĩnh galvanostatic
Phương pháp phóng nạp bằng dòng tĩnh thường được sử dụng để xác định dung lượng làm việc cũng như độ bền của nguồn điện hóa. Đây là phương pháp phóng nạp áp đặt dòng điện cố định và đo sự thay đổi điện thế theo thời gian, hoặc theo dung lượng Q (Q = I.t ). Trong các nghiên cứu của luận án, chúng tôi đã thực hiện phóng nạp với mật độ dòng i = 20 mA/cm2, điện thế ngưỡng của quá trình nạp là E = -1,25V, giá trị điện thế ngưỡng với quá trình phóng là E = -0,8V.
2.3.5. Phương pháp thế tĩnh potentiostatic
Điện thế phóng, nạp được giữ không đổi. Khi đó dòng đo được sẽ là một hàm số phụ thuộc vào thời gian và tính chất của điện cực. Phương pháp này có thể dùng để nghiên cứu khuếch tán hyđrô trong hạt vật liệu.
Giả sử các hạt hợp kim gốc LaNi5 có dạng hình cầu với kích thước đồng nhất, phương trình khuếch tán hyđrô trong hợp kim có thể được viết như sau [112, 119]:
6C(r,t) = D 62C(r,t) + D 2 6C(r,t)
(2.28)
6t 6r2 r 6r
trong đó D là hệ số khuếch tán của hyđrô (cm2s-1), r là khoảng cách từ tâm hình
cầu (cm), t là thời gian (s), và C(r,t) là nồng độ hyđrô tại vị trí r, thời điểm t.
Phương trình khuếch tán (2.28) có thể giải với các điều kiện ban đầu và điều kiện biên phù hợp, cho công thức cuối cùng để tính hệ số khuếch tán.
Khi bề mặt điện cực được áp một điện thế không đổi, nồng độ hyđrô trên bề mặt (Cs) cũng không đổi. Giả sử nồng độ hyđrô ban đầu (C0) trong khối hợp kim là đồng nhất, giải phương trình khuếch tán (2.28), kết quả được viết như sau [112, 119]:
i
6FD
d 2
(C0 - CS )exp(-
n1
n2 2Dt
d 2 )
(2.29)
Khi t đủ lớn, phương trình (2.29) được rút gọn lại thành:
logi = log (± 6FD (C − C )) − n2
D t (2.30)
Đd2 0 s
2,303 d2
Trong đó i là dòng khuếch tán khi áp thế không đổi, d là bán kính cầu của hạt hợp kim, δ là chiều dầy lớp khuếch tán, dấu (–) đối với quá trình nạp, (+) đối với quá trình phóng.
Đây là dạng đường thẳng với công thức rút gọn như sau:
logi = a + b.t (2.31)
Với: b = − n2 D
(2.32)
2,303 d2
2
Suy ra: D = − b.2,303.d2
n
(2.33)
Từ số liệu thực nghiệm ta xây dựng đường logi – t, xác định hệ số b
dựa trên độ dốc của phần tuyến tính trên đường cong, áp dụng công thức (2.33), nếu biết bán kính d, ta có thể xác định được hệ số khuếch tán D.
CHƯƠNG 3
CHẾ TẠO HỢP KIM LaNi4,3-xCoxMn0,4Al0,3
Hợp kim bột gốc LaNi5 đã được nghiên cứu chế tạo theo các phương pháp sau đây:
- Phương pháp khử khuếch tán (với tác nhân khử là Ca): nguyên liệu ban đầu là các ô xít được phối liệu với tỷ lệ thích hợp, hỗn hợp ô xít được khử bằng Ca tại nhiệt độ cao, thời gian phản ứng dài [1, 8, 9, 95].
- Phương pháp hợp kim hóa cơ học: hỗn hợp kim loại, với tỷ lệ hợp thức, được nghiền lẫn với nhau tạo thành hợp kim. Hợp kim tạo thành ban đầu thường là vô định hình, tiếp theo cần ủ để kết tinh lại. Phương pháp này đòi hỏi thiết bị nghiền có năng lượng cao, thời gian nghiền lớn, quá trình nghiền ủ cần được thực hiện trong môi trường khí trơ [56, 91].
- Phương pháp nấu luyện và nghiền cơ [13, 16, 29, 34]: phối liệu là các kim loại thành phần theo tỷ lệ xác định, hợp kim được nấu chảy bằng hồ quang. Sau đó chuyển qua công đoạn nghiền cơ, môi trường bảo vệ là cồn tuyệt đối hoặc axêtôn. Phương pháp này có thể khống chế được cả hai yếu tố thành phần hợp kim và kích thước hạt.
Trong các phương pháp trên, phương pháp nấu luyện và nghiền cơ phù hợp với điều kiện thực tế và cho giá thành thấp, vì vậy trong luận án này chúng tôi sử dụng phương pháp nấu luyện hồ quang và nghiền cơ để chế tạo hợp kim bột LaNi4,3-xCoxMn0,4Al0,3.
3.1. Chế tạo hợp kim khối LaNi4,3-xCoxMn0,4Al0,3
3.1.1. Các điều kiện và quy trình chế tạo
Hợp kim LaNi4,3-xCoxMn0,4Al0,3 được nấu luyện từ 5 kim loại có tính chất vật lý và hóa học rất khác nhau [39, 82] do vậy để đảm bảo sự hợp thức
về thành phần hóa học và độ đồng
đều trong khối hợp kim cần có những nghiên cứu thực nghiệm về ảnh hưởng của thành phần phối liệu và quy trình nấu luyện nhằm tìm ra những điều kiện chế tạo hợp kim tốt nhất. Nguyên liệu sử dụng để chế tạo hợp kim là La, Ni, Co, Mn, Al với độ tinh khiết trên 99%.
Bảng 3.1. Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại trong hợp kim
Tnc (K) | Ts (K) | |
La | 1193 | 3737 |
Ni | 1728 | 3186 |
Co | 1768 | 3200 |
Mn | 1519 | 2334 |
Al | 933,47 | 2793 |
Bảng 3.2. Khối lượng phối liệu các mẫu LaNi4,3-xCoxMn0,4Al0,3
Kí hiệu mẫu | Lượng thêm %La - %Mn | La | Ni | Co | Mn | Al | |
0,4 | M1.1 | 1 – 7 | 3,3288 | 5,4313 | 0,5593 | 0,5579 | 0,1920 |
M1.2 | 1 – 9 | 3,3288 | 5,4313 | 0,5593 | 0,5683 | 0,1920 | |
M1.3 | 2 – 9 | 3,3618 | 5,4313 | 0,5593 | 0,5683 | 0,1920 | |
0,5 | M2.1 | 3 – 3 | 3,3946 | 5,2917 | 0,6991 | 0,5370 | 0,1921 |
M2.2 | 3 – 5 | 3,3946 | 5,2917 | 0,6991 | 0,5475 | 0,1921 | |
M2.3 | 5 – 5 | 3,4605 | 5,2917 | 0,6991 | 0,5475 | 0,1921 | |
0,6 | M3.1 | 1 – 7 | 3,3285 | 5,1522 | 0,8389 | 0,5579 | 0,1920 |
M3.2 | 1 – 9 | 3,3285 | 5,1522 | 0,8389 | 0,5683 | 0,1920 | |
M3.3 | 2 – 9 | 3,3614 | 5,1522 | 0,8389 | 0,5683 | 0,1920 |
Khối lượng các nguyên tố Ni, Co, Al được tính toán theo công thức và được định lượng trên cân phân tích có độ chính xác 10-4 g. Mn là nguyên tố có nhiệt độ sôi thấp, 2334oC (bảng 3.1), trong quá trình nấu luyện nhiệt độ cục bộ tại vị trí tia hồ quang có thể vượt quá nhiệt độ sôi của Mn, làm bay hơi một phần hoặc toàn bộ lượng Mn trong mẫu. Trong các quá trình nấu mẫu chúng
tôi đã chủ động cho thêm Mn để bù vào phần bay hơi này. Để xác định khối
lượng Mn phù hợp chúng tôi đã thử nghiệm nấu mẫu với lượng Mn dư từ 3% đến 9% khối lượng. Nguyên tố dễ bị hao hụt khác là lantan, rất dễ bị ô xy hóa ngoài không khí [39], cũng được tính dư từ 1 % đến 5 % khối lượng. Mỗi mẫu phối liệu có khối lượng
tổng bằng 10 gam, khối lượng phối liệu của các mẫu được thể hiện trong bảng
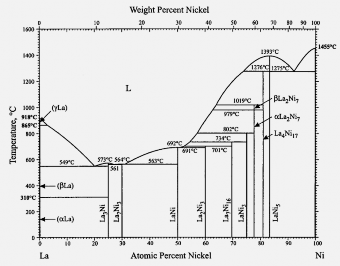
3.2. Từ giản đồ pha của hệ La-Ni thể hiện trên hình
3.2 có thể xác định nhiệt độ nấu chảy không cao quá 1500oC, nhiệt độ luyện lại
vào khoảng 1400oC. Hình 3.1. Giản đồ pha của hệ La-Ni [80]
Các kim loại được làm sạch, định lượng bằng cân phân tích rồi đưa vào nồi nấu. Mn là kim loại dễ bay hơi nên được đặt ở đáy nồi. Không khí được hút ra bằng bơm chân không. Khi độ chân không trong buồng nấu đạt tới 10-5 torr thì khí ac-gông được đưa vào cho tới khi áp suất cân bằng với môi trường. Quá trình này được lặp lại 3 lần, sau cùng khí ac-gông được đưa vào để tạo môi trường bảo vệ cho quá trình nấu, áp suất khí bảo vệ cân bằng với khí quyển. Lượng ôxy còn lại trong lò được khử bằng titan nóng chảy.
Hợp kim LaNi4,3-xCoxMn0,4Al0,3 được chế tạo với thành phần là các kim loại có nhiệt độ nóng chảy và nhiệt độ sôi rất khác nhau (bảng 3.1), vì vậy để hợp kim có thành phần đồng đều, ít hao hụt, chúng tôi đã tiến hành nhiều thí nghiệm và chọn ra quy trình nấu luyện gồm 2 giai đoạn như biểu diễn trên sơ đồ khối hình 3.2.
Ngọn lửa hồ quang được khơi mào và đưa vào vị trí khay mẫu. Kim
![]()
Hợp kim
CoNiMnAl
Nấu chảy hồ quang
lần 2
LaNi5
Co, Ni, Mn, Al
Nấu chảy hồ quang lần 1
Phân tích thành phần, cấu trúc
La
![]()
![]()
![]()
La, Ni, Co, Mn, Al với độ tinh khiết trên 99%
Định lượng bằng cân phân tích (=10-4g)
loại khó bay hơi được làm nóng chảy trước, quá trình truyền nhiệt từ từ sang các kim loại tiếp theo làm nóng chảy và hòa tan vào nhau thành khối dung dịch nóng chảy đồng nhất. Ở giai đoạn 1, các kim loại Ni, Co, Al và Mn được nấu chung với nhau tạo thành hợp kim. Sau đó lantan được đưa vào nấu cùng với hợp kim trên. Ngọn lửa hồ quang được điều chỉnh không chiếu trực tiếp vào La, nhiệt truyền từ khối hợp kim NiCoMnAl làm nóng chảy La tạo thành hợp kim LaNi4,3-xCoxMn0,4Al0,3. Sau khi tất cả các thành
phần phối liệu hòa tan vào nhau dòng điện nuôi hồ
Hình 3.2. Sơ đồ khối quy trình chế tạo
hợp kim LaNi4,3-xCoxMn0,4Al0,3
quang được duy trì khoảng 70A trong 5 phút. Sau đó khối hợp kim được nấu chảy lại thêm 3 lần nữa để đảm bảo độ đồng đều về thành phần.

![Biến Thiên Nhiệt Độ Theo Điện Lượng Và Tốc Độ Nạp Điện [68]](https://tailieuthamkhao.com/uploads/2022/04/24/che-tao-hop-kim-goc-lani5-lam-vat-lieu-dien-cuc-am-do-ben-cao-de-su-3-1-120x90.jpg)
![Ảnh Sem Bề Mặt Mẫu Lani 2,49 Al 1,98 Mn 0,49 Co 0,08 Chưa Phóng Nạp (A), Và Phóng Nạp 200 Chu Kỳ Cv (B) [15]](https://tailieuthamkhao.com/uploads/2022/04/24/che-tao-hop-kim-goc-lani5-lam-vat-lieu-dien-cuc-am-do-ben-cao-de-su-4-1-120x90.jpg)



