- Mục 45 của Luật sáng chế Canada không nêu điều khoản bảo hộ đối với các sáng chế kết thúc trước 20 năm kể từ ngày được cấp theo điều 33 của Hiệp định TRIPS và do vậy bác bỏ lập luận của Canada rằng thời hạn bảo hộ 17 năm nêu trong Luật sáng chế tương ứng với thời hạn 20 năm của Hiệp định TRIPS do tồn đọng, trì hoãn theo luật hoặc tạm dừng không chính thức…
Ngày 19/06/2000, Canada thông báo kháng án. Ngày 18/09/2000, Cơ quan Phúc thẩm công bố báo cáo, trong đó tán đồng tất cả các kết luận của Ban Hội thẩm. Ngày 12/10/2000, DSB thông qua báo cáo của Cơ quan Phúc thẩm và báo cáo của Ban Hội thẩm được Cơ quan Phúc thẩm tán thành. Cơ quan phúc thẩm kết luận rằng: thời hạn bảo hộ sáng chế là 17 năm (tính từ ngày cấp văn bằng bảo hộ) cho những đơn đăng ký sáng chế được nộp trước ngày 01 tháng 10 năm 1989 và thường kết thúc trước 20 năm tính từ ngày nộp đơn theo quy định tại Phần 45 Đạo luật Sáng chế Canada không phù hợp với quy định tại Điều 33 Hiệp định TRIPS [67].
2.2.7 Quy định về bảo vệ quyền đối với sáng chế dược phẩm
Liên quan đến thực thi quyền sở hữu trí tuệ, ngoài việc quy định những biện pháp đầy đủ và thỏa đáng mà các thành viên phải có để bảo vệ quyền đối với sáng chế, Hiệp định TRIPS cũng có những giới hạn nhất định nhằm bảo đảm cân bằng với lợi ích của xã hội. Cụ thể trong các thủ tục thực thi quyền, Hiệp định TRIPS thể hiện rất rõ ràng quan điểm coi quyền đối với sáng chế, bao gồm sáng chế dược phẩm là một quyền dân sự và có thể nói các thủ tục dân sự sẽ được áp dụng đối với các hành vi xâm phạm quyền sáng chế. Hơn nữa, quy định về việc kiểm soát biên giới cũng không bắt buộc phải áp dụng đối với đối tượng này. Luật pháp của hầu hết các nước trên thế giới cũng quy định việc thực thi quyền đối với sáng chế được áp dụng theo thủ tục dân sự. Rất ít nước có hệ thống thực thi quyền đối với sáng chế bằng biện pháp hành chính như Trung Quốc, Việt Nam, theo đó các cơ quan hành chính Nhà nước chủ động thực hiện các biện pháp bảo về quyền cho chủ sở hữu sáng chế bất kể chủ sở hữu sáng chế có yêu cầu hay không.
2.2.8. Quy định về việc thực thi sáng chế dược phẩm
2.2.8.1. Những quy định chung:
Hiệp định TRIPS là điều ước quốc tế đa phương đầu tiên điều chỉnh cơ chế pháp lý và hành chính nội bộ của các quốc gia về thực thi quyền sở hữu trí tuệ, theo
đó Phần III Hiệp định TRIPS yêu cầu các nước thành viên thiết lập cơ chế hành chính và tư pháp để người nắm quyền sở hữu trí tuệ nói chung và chủ sở hữu sáng chế dược phẩm nói riêng có thể tìm kiếm sự bảo vệ lợi ích của họ một cách hiệu quả. Nghĩa vụ chung của các thành viên là thiết lập các thủ tục thực thi được ghi nhận trong pháp luật quốc gia để ngăn chặn và xử lý bất kỳ hành vi xâm phạm sở hữu trí tuệ quyền nào bao gồm cả hành vi xâm phạm sở hữu sáng chế dược. Các thủ tục này phải "công bằng và hợp lý", và "không quá phức tạp hoặc tốn kém, đòi hỏi thời gian không hợp lý hoặc giới hạn hoặc chậm trễ không chính đáng" (Điều 41 Hiệp định TRIPS). Bên cạnh đó, khoản 5 Điều 41 Hiệp định TRIPS thiết lập hai nguyên tắc quan trọng là: các thành viên không cần phải thiết lập hệ thống tư pháp riêng biệt cho việc thực thi nói trên, và không có "nghĩa vụ đối với việc phân phối các nguồn lực giữa thực thi quyền sở hữu trí tuệ với thực thi pháp luật nói chung".
2.2.8.2. Các thủ tục và biện pháp dân sự và hành chính
Điều 42 đến 49 của Hiệp định TRIPS thiết lập các nguyên tắc cơ bản để tiến hành các thủ tục tố tụng dân sự để thực thi quyền sở hữu trí tuệ trong đó có quyền sở hữu sáng chế dược phẩm. Các quy định này là giống nhau giữa các hệ thống pháp lý, bao gồm các quyền lợi của bị đơn và nguyên đơn, các bên có cơ hội để đưa ra chứng cứ, các biện pháp phòng ngừa...Có sự linh hoạt trong các quy định này ví dụ như trong việc tính toán thiệt hại đối với hành vi vi phạm không theo cách thức thông thường trong các lĩnh vực khác.
Có thể bạn quan tâm!
-
 Các Thành Viên Cũng Có Thể Loại Trừ Không Cấp Bằng Sáng Chế Cho:
Các Thành Viên Cũng Có Thể Loại Trừ Không Cấp Bằng Sáng Chế Cho: -
 Ngoại Lệ Của Cấp Bằng Độc Quyền Sáng Chế Dược Phẩm
Ngoại Lệ Của Cấp Bằng Độc Quyền Sáng Chế Dược Phẩm -
 Thời Hạn Bảo Hộ Sáng Chế Dược Phẩm
Thời Hạn Bảo Hộ Sáng Chế Dược Phẩm -
 Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới:
Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới: -
 Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam:
Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam: -
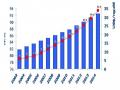
 Số Lượng Đơn Sáng Chế Dược Phẩm Nộp Tại Việt Nam
Số Lượng Đơn Sáng Chế Dược Phẩm Nộp Tại Việt Nam
Xem toàn bộ 128 trang tài liệu này.
Một quy định đáng lưu ý là Điều 44.2 của Hiệp định TRIPS cho phép thành viên loại trừ việc ra lệnh cấm trong những trường hợp liên quan đến giấy phép bắt buộc chuyển giao quyền sử dụng sáng chế dược và các trường hợp sử dụng sáng chế dược khác của chính phủ.
2.2.8.3. Biện pháp tạm thời

Điều 50: 1 của Hiệp định TRIPS bắt buộc các Thành viên phải thiết lập các biện pháp khẩn cấp tạm thời để ngăn chặn việc đưa hàng hoá xâm phạm sáng chế dược vào các kênh thương mại và để bảo vệ chứng cứ. Điều 50.2 yêu cầu các cơ quan tư pháp có quyền áp dụng biện pháp tạm thời đơn phương bên ngoài phiên điều trần của bên kia nếu sự chậm trễ có thể gây ra thiệt hại không thể khắc phục được. Điều này có nghĩa là chủ sở hữu sáng chế dược có quyền xin áp dụng biện
pháp này bất kể bị đơn có được thông báo trước và có cơ hội được bào chữa hay không.
2.2.8.4. Các biện pháp kiểm soát tại biên giới
Điều 51 đến Điều 60 Hiệp định TRIPS ghi nhận các biện pháp mà một Thành viên phải áp dụng để ngăn chặn việc đưa hàng hoá xâm phạm sáng chế dược vào lưu thông. Theo Điều 51.1 của Hiệp định TRIPS các thủ tục này chỉ cần được áp dụng đối với hàng hóa bị nghi ngờ "giả mạo nhãn hiệu hoặc vi phạm bản quyền", và đặc biệt không bao gồm hàng hóa nhập khẩu song song.
Như vậy, chủ sở hữu sáng chế dược phẩm có thể nộp đơn đến các cơ quan chức năng trình bày đầy đủ về việc hàng hóa vi phạm sáng chế cùng với các thông tin liên quan. Nguyên đơn có thể phải thực hiện biện pháp bảo đảm bồi thời thiệt hại có thể xảy ra cho nhà nhập khẩu trong trườn hợp không có hành vi vi phạm sáng chế dược. Ngoài ra, Hiệp định còn bao gồm các điều khoản thông báo cho nhà nhập khẩu về việc tạm giữ hoặc trả lại hàng hóa bị tạm giữ của các cơ quan có thẩm quyền; chủ sở hữu sáng chế dược có quyền kiểm tra hàng hóa vi phạm mặc dù cơ quan có thẩm quyền vẫn có thể đảm bảo bí mật thông tin; cơ quan chức năng có quyền tiêu hủy, tịch thu hoặc cấm tái xuất hàng hóa vi phạm.
Ngoài ra, Hiệp định TRIPS còn bao gồm một phần riêng biệt liên quan đến việc "cấp và duy trì quyền sở hữu trí tuệ và các thủ tục liên quan giữa các thành viên". Phần này chỉ bao gồm Điều 62 quy định các Thành viên có thể áp dụng quy trình và thủ tục hợp lý liên quan đến việc cấp hoặc duy trì quyền sở hữu trí tuệ bao gồm quyền sở hữu sáng chế dược phẩm. Điều này cũng quy định thủ tục tố tụng hành chính và giữa các bên liên quan đến việc cấp hoặc thu hồi quyền sẽ phụ thuộc vào các biện pháp bảo vệ tương tự như đối với thủ tục thực thi. Cuối cùng, thủ tục rà soát tư pháp hoặc "bán tư pháp" đối với việc cấp và thu hồi sáng chế dược phẩm cũng được quy định.
2.2.8.5 Hệ thống giải quyết tranh chấp của Hiệp định TRIPS:
- Minh bạch hóa:
Điều 63 của Hiệp định TRIPS thiết lập các yêu cầu minh bạch hóa, trong đó bao gồm nghĩa vụ công bố các văn bản quy phạm pháp luật như các luật và quyết định tư pháp trong lĩnh vực sở hữu trí tuệ nói chung và sáng chế dược phẩm nói
riêng. Điều này thiết lập một nghĩa vụ thông báo các luật và quy định cho Hội đồng TRIPS hoặc WIPO. Thành viên có nghĩa vụ cung cấp tóm tắt hoặc chi tiết hóa đầy đủ các quy định hoặc quyết định được áp dụng theo yêu cầu của các Thành viên có lí do tin rằng các quyền của họ có thể bị ảnh hưởng. Các thông tin mật sẽ được bảo vệ.
- Giải quyết tranh chấp:
Điều 64.1 của Hiệp định TRIPS quy định rằng các quy định của Điều XXII và XIII của GATT 1994, được chi tiết trong Diễn giải về giải quyết tranh chấp (DSU) sẽ được áp dụng cho việc tham vấn và giải quyết tranh chấp theo Hiệp định TRIPS, trừ trường hợp được quy định rõ trong Hiệp định. Đáng chú ý là Điều 64.2 và 64.3 Hiệp định TRIPS ghi nhận các khiếu kiện không vi phạm và khiếu kiện tình huống. Khiếu kiện không vi phạm là loại khiếu kiện chống lại một nước Thành viên áp dụng biện pháp tuy không vi phạm nghĩa vụ của nước đó theo WTO nhưng lại gây thiệt hại cho nước Thành viên khác. Khiếu nại tình huống thực tế chưa từng được đưa ra cơ chế giải quyết tranh chấp tại WTO cho đến nay. Điều 64.2 của Hiệp định TRIPS quy định khiếu kiện không vi phạm và khiếu kiện tình huống không được đưa ra trong vòng năm năm sau khi Hiệp định có hiệu lực. Điều 64: 3 quy định Hội đồng TRIPS xem xét các khiếu kiện này và đưa ra khuyến nghị cho Hội nghị Bộ trưởng.
Về thủ tục giải quyết tranh chấp, Hiệp định TRIPS kết hợp cơ chế tham vấn và giải quyết tranh chấp chung tại các Điều XXII và XIIII của GATT 1994 và DSU để từ đó áp dụng các thủ tục tương tự như trong GATT và GATS. Các thủ tục này bao gồm yêu cầu tham vấn, tham vấn, yêu cầu thành lập Ban Hội thẩm, sự tham gia của bên thứ ba, thành lập Ban Hội thẩm, xây dựng các điều khoản tham chiếu, nộp các bản bào chữa và chứng cứ, thủ tục xét xử của Ban Hội thẩm, tư vấn của chuyên gia .v.v.
Bên cạnh đó, cơ chế giải quyết tranh chấp theo Hiệp định TRIPS có một số khác biệt đáng kể về thủ tục so với các hiệp định khác của WTO. Chẳng hạn như việc tham vấn các chuyên gia trong quá trình giải quyết tranh chấp, WIPO thường được các bên trong tranh chấp hoặc ban hội thẩm xin ý kiến tư vấn về lịch sử đàm phán và các nội dung của các công ước của WIPO chứa đựng trong Hiệp định
TRIPS. Ngoài ra, các hướng dẫn thực thi các công ước của WIPO và các tài liệu liên quan cũng được ban hội thẩm và Cơ quan Phúc thẩm tham khảo trong quá trình giải quyết tranh chấp về sở hữu trí tuệ, bao gồm tranh chấp về sáng chế dược phẩm. Ví dụ thực tế cho thấy lịch sử đàm phán đóng vai trò quan trọng trong các quyết định của các ban hội thẩm trong các vụ tranh chấp Canada - Bằng sáng chế dược phẩm (do EU khởi kiện Canada, số hiệu WT/DS114), và Canada – Thời hạn bảo hộ sáng chế (do Hoa Kỳ khởi kiện Canada, số hiệu WT/DS170).
Như vậy có thể thấy rằng so với các điều ước quốc tế khác trong lĩnh vực sở hữu trí tuệ, tầm quan trọng của Hiệp định TRIPS được thể hiện ở chỗ đây là điều ước quốc tế đầu tiên về sở hữu trí tuệ có những quy định cụ thể về trách nhiệm dân sự, hình sự và bảo vệ biên giới và cũng là điều ước quốc tế đầu tiên về sở hữu trí tuệ được áp dụng để giải quyết tranh chấp. Trên thực tế, TRIPS đặt nền tảng cho một hạ tầng cơ sở vững chắc và hiện đại trong lĩnh vực quyền sở hữu trí tuệ nói chung và sáng chế dược phẩm nói riêng cho cộng đồng quốc tế.
2.2.9 Thời gian chuyển tiếp:
Hiệp định TRIPS quan tâm đáng kể sự cần thiết phải tìm một sự cân bằng giữa lợi ích của người có quyền sở hữu và người sử dụng, không chỉ được phản ánh trong yêu cầu về công khai mà còn những giới hạn và ngoại lệ đối với quyền sáng chế và các quy định về chuyển tiếp.
Tính đến sự khác biệt về trình độ phát triển kinh tế của các nước thành viên, Hiệp định TRIPS quy định giai đoạn chuyển đổi để các nước đang phát triển và các nước kém phát triển nhằm cho họ đủ thời gian để áp dụng các tiêu chuẩn khác nhau của TRIPS về quyền sở hữu trí tuệ ở cấp quốc gia. Theo Hiệp định TRIPS, tất cả các nước phải cung cấp bảo hộ sáng chế sản phẩm từ ngày 01 tháng 1 năm 1995, nhưng đối với các nước đang phát triển hiện không bảo hộ bằng sáng chế sản phẩm, giai đoạn chuyển đổi cho phép các nước này thêm thời gian để điều chỉnh pháp luật và thực tiễn của mình phù hợp với các điều khoản của TRIPS đến năm 2005. Giai đoạn chuyển đổi có thể được kéo dài thêm bởi Hội đồng TRIPS trên cơ sở yêu cầu của các nước kém phát triển đến năm 2016 đối với các sáng chế về dược phẩm và các độc quyền về tiếp thị trong Tuyên bố Doha về Hiệp định TRIPS và Y tế công cộng. Giai đoạn chuyển tiếp có nghĩa rằng dược phẩm hoặc thuốc cấp bằng sáng
chế trước khi nước đang phát triển thực hiện nghĩa vụ của TRIPS sẽ không được bảo hộ bằng sáng chế.
2.3 Tuyên bố Doha năm 2001 về Hiệp định TRIPS và Y tế công cộng (Tuyên bố Doha)
Năm 2001, các thành viên WTO đã thông qua một Tuyên bố Bộ trưởng đặc biệt - "Tuyên bố Doha về Hiệp định TRIPS và Y tế công cộng", tại Hội nghị Bộ trưởng WTO tại Doha để làm rõ sự thiếu rõ ràng giữa nhu cầu chính phủ áp dụng các nguyên tắc của y tế công cộng và các điều khoản của Hiệp định TRIPS, với mối quan tâm đặc biệt về các quy tắc bằng sáng chế có thể hạn chế việc tiếp cận thuốc giá cả phải chăng cho các nước đang phát triển [59].
Đoạn 3-4 của Tuyên bố Doha ghi nhận:
"Chúng tôi thừa nhận rằng bảo vệ sở hữu trí tuệ là quan trọng đối với sự phát triển của các loại thuốc mới. Chúng tôi cũng công nhận những lo ngại về ảnh hưởng của nó đối với giá thuốc” [32].
"Chúng tôi đồng ý rằng Hiệp định TRIPS không và không nên ngăn chặn các thành viên áp dụng các biện pháp để bảo vệ sức khỏe cộng đồng. Theo đó, trong khi nhắc lại cam kết của chúng tôi đối với Hiệp định TRIPS, chúng tôi khẳng định rằng Hiệp định có thể và nên được hiểu và thực hiện một cách hỗ trợ quyền thành viên WTO để bảo vệ sức khỏe cộng đồng và đặc biệt, để thúc đẩy tiếp cận thuốc cho tất cả mọi người " [32].
Tuyên bố Doha thừa nhận rằng các loại thuốc và các quyền sở hữu trí tuệ đóng vai trò quan trọng trong các cuộc thảo luận về các vấn đề công cộng, nhưng bảo vệ IP cũng gây ra tác động tiêu cực, đặc biệt là về giá thuốc.
Một mặt, các thành viên nhắc lại cam kết của họ thực hiện Hiệp định TRIPS để hỗ trợ y tế công cộng, và mặt khác, Tuyên bố Doha khẳng định quyền của các thành viên được sử dụng các linh hoạt trong Hiệp định TRIPS để đạt được các mục tiêu thúc đẩy tiếp cận thuốc , cũng như nhấn mạnh tầm quan trọng của những diễn giải về nội dung của các vấn đề sau:
Thứ nhất, quyền của từng quốc gia cấp giấy phép bắt buộc của trường hợp khẩn cấp được làm rõ và nhấn mạnh trong Tuyên bố Doha năm 2001 về việc Hiệp định TRIPS. Tuyên bố Doha nói rằng mỗi thành viên có quyền tự do để xác định
căn cứ cấp giấy phép bắt buộc và xác định thế nào là một trường hợp khẩn cấp quốc gia hoặc các tình huống khác cực kỳ khẩn cấp. Nó đề cập đến những vấn đề các nước phải đối mặt khi muốn thông báo HIV/AIDS là trường hợp khẩn cấp quốc gia.
Thứ hai, Tuyên bố khẳng định rằng "các điều khoản trong Hiệp định TRIPS có liên quan đến việc sử dụng hết quyền sở hữu trí tuệ cho phép mỗi thành viên tự do thiết lập cơ chế riêng của mình cho vấn đề hết quyền mà không bị kiện" [29].
Thứ ba, đối với giai đoạn chuyển tiếp dành cho các nước kém phát triển, Tuyên bố Doha đã gia hạn thời gian cho những nước này không phải thực hiện nghĩa vụ liên quan đến các sản phẩm dược phẩm như thực thi hoặc cấp các bằng sáng chế hoặc công bố thông tin theo Hiệp định TRIPS cho đến Tháng 1 năm 2016 [32].
Thứ tư, Tuyên bố năm 2001 không đề xuất một cách rõ ràng các loại sản phẩm thuốc cần được thúc đẩy, tức là thuốc cấp bằng sáng chế, hoặc các thành phần hoạt động hoặc sản phẩm trung gian và quy trình sản xuất được cấp bằng sáng chế. Nhìn chung, các nước đang phát triển muốn quy định một phạm vi rộng các sản phẩm y tế liên quan đến công chúng, nhưng hầu hết các nước công nghiệp muốn giới hạn phạm vi sản phẩm dược phẩm và quy trình cấp bằng sáng chế. Vì vậy một giải pháp dung hòa đã được đề xuất trong quyết định ngày 01 tháng 9 năm 2003 "thực thi đoạn 6 của Tuyên bố Doha về Hiệp định TRIPS và sức khỏe cộng đồng" trong đó định nghĩa "sản phẩm dược phẩm" như sau [59]:
"Dược phẩm" là bất kỳ sản phẩm cấp bằng sáng chế, hoặc sản phẩm được sản xuất thông qua quá trình cấp bằng sáng chế, trong lĩnh vực dược phẩm cần thiết để giải quyết các vấn đề y tế công cộng như công nhận tại khoản 1 của Tuyên bố. Điều này được hiểu rằng các thành phần hoạt động cần thiết để sản xuất và bộ dụng cụ chẩn đoán cần thiết cho việc sử dụng nó sẽ được bao gồm.
Thứ năm, trong Hiệp định TRIPS, Điều 31 (f) quy định rằng việc sử dụng các giấy phép bắt buộc "phải chủ yếu nhằm cung cấp cho thị trường trong nước của Thành viên cho phép việc sử dụng đó. Tuyên bố Doha ghi nhận vấn đề này trong đoạn 6 rằng đối với những nước không có khả năng công nghệ để thay đổi hoàn toàn kỹ sư và việc sản xuất thuốc tại địa phương, rất khó để sử dụng hiệu quả giấy phép bắt buộc, mà đó là một thách thức để thúc đẩy tiếp cận thuốc [32].
Chúng tôi nhận ra rằng các thành viên WTO với năng lực sản xuất không đầy đủ hoặc không có trong lĩnh vực dược phẩm có thể phải đối mặt với khó khăn trong việc sử dụng hiệu quả cấp phép bắt buộc theo Hiệp định TRIPS. Chúng tôi hướng dẫn các Hội đồng TRIPS để tìm một giải pháp nhanh chóng cho vấn đề này và báo cáo cho Đại Hội đồng trước khi kết thúc năm 2002.
Vào năm 2003, Hội đồng TRIPS trả lời thông qua quyết định cho phép các nước thành viên với năng lực sản xuất dược phẩm không đủ từ bỏ tạm thời tại Điều 31 (f) theo TRIPS [32]. Các quốc gia có năng lực sản xuất có thể xuất thuốc thiết yếu sang các nước không có hoặc không đủ năng lực sản xuất.
Tuy nhiên quyết định này tạo thêm rào cản cho vấn đề tại khoản 6. Một nước đang phát triển có nhu cầu nhập khẩu các loại thuốc và các thành viên xuất khẩu phải thông báo cho Hội đồng TRIPS về việc cấp các li-xăng [59]. Yêu cầu thông báo sẽ gây ra một số chậm trễ trong trường hợp có nhu cầu cấp thiết về các loại thuốc. Một hạn chế cũng được đặt ra về số lượng thuốc có thể được sản xuất để xuất khẩu theo một li-xăng bắt buộc [59]. Một vấn đề quan trọng khác là đối với những quốc gia kém phát triển nhất mà không đủ năng lực thì dịch vụ y tế của họ sẽ dựa vào ngành công nghiệp y tế và dược phẩm của các nước phát triển và đang phát triển đã có hệ thống bằng sáng chế đối với một số lĩnh vực. Trong điều kiện như vậy những ngoại lệ của Tuyên bố Doha không thể giúp nước kém phát triển tạo ra khả năng tiếp cận thuốc cho người nghèo. Do đó, nhiệm vụ quan trọng hơn là phải nghiên cứu về việc thực hiện hiệu quả Tuyên bố Doha đối với các nước kém phát triển.
Như vậy, Tuyên bố Doha nhấn mạnh sự cần thiết của Hiệp định TRIPS là một phần của giải pháp trong việc giải quyết những thách thức về y tế công cộng, và khẳng định rằng các biện pháp bảo vệ có trong TRIPS nên được sử dụng để vượt qua rào cản sở hữu trí tuệ tạo ra cho việc tiếp cận thuốc. Tuyên bố Doha đề cập đến một số khía cạnh, trong đó có quyền cấp giấy phép bắt buộc và tự do để xác định căn cứ cấp giấy phép, quyền quyết định thế nào là một trường hợp khẩn cấp quốc gia và hoàn cảnh cực kỳ khẩn cấp, và sự tự do để thiết lập các quy định về hết quyền sở hữu trí tuệ mà không bị kiện theo bất kỳ Hiệp định nào của WTO.