cúm xảy ra. Trong trường hợp đó, khoảng 10% dân số mắc bệnh, trương đương với 8,2 triệu người. Mỗi bệnh nhân cần 10 viên Tamiflu thì số thuốc cần có cho điều trị ở Việt Nam là 82 triệu viên, chưa kể thuốc dự phòng cho nhân viên y tế trực tiếp chăm sóc bệnh nhân và cho những người dân có nguy cơ mắc bệnh. Trong khi đó, tại Việt Nam vào thời điểm đó “chỉ có 599.000 viên Tamiflu do Đài Loan viện trợ và con số này mới chỉ đủ cho khoảng 60.000 người bệnh. Kho dự trữ thuốc này của WHO lúc đó cũng chỉ có 30 triệu viên. Nếu dịch bệnh xảy tại Việt Nam, chắc chắn số thuốc này không thể được viên trợ hết cho Việt Nam. Vì thế, Việt Nam cần chủ động tìm các nguồn cung cấp thuốc Tamiflu khác ngoài số thuốc có thể nhận được viện trợ từ WHO.
Thứ hai, người nắm độc quyền sử dụng sáng chế (La Roche) không thể đáp ứng nhu cầu cấp bách của Việt Nam. La Roche đã có văn bản gửi WHO khẳng định không thể đáp ứng nổi nhu cầu thuốc trước những đơn đặc hàng khổng lồ không chỉ của Việt Nam mà còn các quốc gia khác trên thế giới.
Thứ ba, quá trình thương lượng để hãng La Roche tự nguyện chuyển giao quyền sử dụng sáng chế nhằm sản xuất Tamiflu tại Việt Nam đã không thành công.
Thứ tư, Pháp luật Việt Nam, có quy định về việc BBCGQSDSC trong trường hợp: “việc sử dụng đối tượng SHCN nhằm đáp ứng nhu cầu quốc phòng, an ninh quốc gia, phòng bệnh, chữa bệnh cho nhân dân và các nhu cầu cần thiết khác của xã hội” và “Người có nhu cầu sử dụng đã cố gắng dùng nhiều hình thức để thỏa thuận với chủ sở hữu mặc dù đã đưa ra mức giá hợp lý, nhưng chủ sở hữu vẫn từ chối ký kết hợp đồng chuyển giao sử dụng đối tượng SHCN”.
Dựa trên cơ sở pháp luật Việt Nam, căn cứ trên tình hình thực tiễn tại Việt Nam, Chính phủ Việt Nam hoàn toàn có quyền BBCGQSDSC mà không cần thương lượng với người nắm độc quyền sáng chế. Tuy nhiên, cơ quan chức năng Việt Nam đã chủ động đàm phán với Luận án Roche để có thể đạt được một số thỏa thuận hợp lý trước khi quyết định BBCGQSD. Ngày 7/11/2005, Việt Nam tiếp tục đàm phán với La Roche. Mặc dù cả hai bên đều có thiện chí nhưng một số vấn đề liên quan vẫn chưa được thống nhất. Tuy nhiên Laroche cũng đồng ý khi Việt Nam công bố tình trạng khẩn cấp mức quốc gia thì Việt Nam có thể áp dụng quyền tự sản xuất thuốc mà không cần sự đồng ý của Roche. Ngày 8/11/2005, La Roche chính
thức đồng ý với Bộ tế Việt Nam về nhượng quyền sản xuất thuốc Tamiflu và cam kết chuyển giao công nghệ cần thiết để việc sản xuất thuốc này sẽ được tiến hành sau hai tháng. Kết quả, một hợp đồng chuyển giao quyền sử dụng tự nguyện đã được ký kết. Tamiflu là trường hợp đầu tiên mà chính phủ Việt Nam vận dụng các quy định của pháp luật về BBCGQSDSC. Mặc dù đây chưa phải là trường hợp cấp quyết định BBCGQSDSC, nhưng thông qua việc dự định áp dụng BBCGQSDSC đã mang lại những kết quả khả quan. Không chỉ tại Việt Nam, Chính phủ các quốc gia đang phát triển cũng thường có một quá trình thương lượng với người nắm độc quyền sáng chế trong những trường hợp tương tự như Việt Nam. Mặc dù Hiệp định TRIPS cho phép các thành viên được bỏ qua gia đoạn thương lượng với người nắm độc quyền sáng chế trong trường hợp sử dụng sáng chế vì “mục đích công cộng, phi thương mại” và “trường hợp khẩn cấp quốc gia hoặc đặc biệt khẩn cấp” nhưng trên thực tiễn, các quốc gia đang phát triển vì nhiều lý do khác nhau vẫn tiến hành đàm phán với người nắm độc quyền sử dụng sáng chế.
Tại Việt Nam, không có sự giải thích chính thức tại sao Việt Nam cần thương lượng với La Roche mà không quyết định BBCGQSDSC như Đài Loan. Trong trường hợp tương tự như Việt Nam, ngày 25/11/2005 cơ quan sáng chế Đài Looan đã cấp quyết định BBCGQSDSC để sản xuất thuốc Tamiflu nhằm đối phó với dịch cúm gia cầm. Theo tác giả, có thể giải thích vấn đề trên qua các lý do cơ bản sau: Thứ nhất, vào thời điểm này Việt Nam đang tiến hành đàm phán gia nhập WTO, Việt Nam cần sự ủng hộ của các quốc gia, đặc biệt các quốc gia đang phát triển như Hoa Kỳ, EU, Thụy Sỹ. BBCGQSDSC là vấn đề thường có sự phản ứng không chỉ các chủ sở hữu sáng chế mà còn chính phủ các quốc gia, nếu BBCGQSDSC có thể bất lợi cho Việt Nam trong quá trình đàm phán này. Thứ 2, việc sử dụng hiệu quả các quy định về BBCGQSDSC đòi hỏi phải đáp ứng một số điều kiện như điều kiện về công nghệ, pháp luật, về nguồn nhân lực…Để có thể sử dụng hiệu quả BBCGQSDSC trên thực tế không phải là vấn đề đơn giản. Tại thời điểm này, ngành công nghiệp dược phẩm của Việt Nam vẫn còn non trẻ, trình độ công nghệ chưa cao, còn phụ thuộc vào nguồn nhiên liệu nhâp khẩu. Ngay cả trong trường hợp này, để sản xuất thuốc Tamiflu, các công ty sản xuất dược phẩm của Việt Nam vẫn phải nhập khẩu nguồn nguyên liệu từ nước ngoài. Nếu thông qua
thương lượng mà có một hợp đồng chuyển giao tự ngyện thì sẽ tốt hơn việc BBCGQSDSC, ít nhất là từ việc chuyển giao công nghệ. Thứ 3, mặc dù đã có quy định pháp luật về BBCGQSDSC nhưng pháp luật Việt Nam vào thời điểm này vẫn còn thiếu một số quy định để cỏ thể áp dụng trên thực tế như quy định về mức đền bù, về cách tính mức đền bù, thủ tục BBCGQSDSC cũng chưa được quy định chặt chẽ. Hơn nữa, BBCGQSDSC là vấn đề rất mới với Việt Nam nên việc thận trọng của cơ quan có thẩm quyền trong việc ra quyết định BBCGQSDSC là điều dễ hiểu. Thứ tư, trong thời gian này, dưới tác động của việc cấp quyết định BBCGQSDSC bởi cơ quan sáng chế Đài Loan đối với Tamiflu, La Roche cũng đã tự nguyện chuyển giao quyền sử dụng sáng chế Đài Loan cho một số nhà sản xuất tại Trung Quốc, Ấn Độ và Nam Phi. Thực tiễn này cho tác giả cũng tác động đến tình huống tại Việt Nam.
Một số nhận xét có thể rút ra từ vụ Tamiflu: (i) nhu cầu sử dụng BBCGQSDSC nhằm mục đích công cộng, phi thương mại là nhu cầu thực tiễn tại Việt Nam do đó việc quy định BBCGQSDSC trong pháp luật Việt Nam là cần thiết;
(ii) vai trò của BBCGQSDSC không chỉ thể hiện trong thực tiễn sử dụng mà còn thể hiện như một biện pháp mang tính “ngăn ngừa”, nghĩa là việc đe dọa sử dụng BBCGQSDSC có thể thúc đẩy việc chuyển giao tự nguyện quyền sử dụng sáng chế. Do đó trong điều kiện của các nước đang phát triển như Việt Nam, với trình độ phát triển công nghệ còn chưa cao, với mục đích thu hút đầu tư nước ngoài, với kinh nghiệm sử dụng BBCGQSDSC còn hạn chế, việc thương lượng với người nắm độc quyền sử dụng sáng chế trước khi cấp quyết định BBCGQSDSC là việc làm cần thiết [17, tr.148-152].
Có thể bạn quan tâm!
-
 Cơ Sở Pháp Lý Quốc Tế Bảo Hộ Sáng Chế Dược Phẩm:
Cơ Sở Pháp Lý Quốc Tế Bảo Hộ Sáng Chế Dược Phẩm: -
 Các Thành Viên Cũng Có Thể Loại Trừ Không Cấp Bằng Sáng Chế Cho:
Các Thành Viên Cũng Có Thể Loại Trừ Không Cấp Bằng Sáng Chế Cho: -
 Ngoại Lệ Của Cấp Bằng Độc Quyền Sáng Chế Dược Phẩm
Ngoại Lệ Của Cấp Bằng Độc Quyền Sáng Chế Dược Phẩm -
 Quy Định Về Bảo Vệ Quyền Đối Với Sáng Chế Dược Phẩm
Quy Định Về Bảo Vệ Quyền Đối Với Sáng Chế Dược Phẩm -
 Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới:
Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới: -
 Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam:
Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam:
Xem toàn bộ 128 trang tài liệu này.
2.2.5 Nhập khẩu song song:
Nhập khẩu song song (Parallel Import – PI), còn gọi là thị trường „nhập khẩu xám‟ (gray market import), là hiện tượng những hàng hoá được sản xuất dưới sự bảo hộ đầy đủ của các luật thương hiệu, bằng sáng chế, hoặc bản quyền, chúng được đưa vào lưu thông trong một thị trường, và sau đó được nhập khẩu vào một thị trường thứ hai mà không được phép của các chủ sở hữu tài sản trí tuệ trong địa bàn đó. Các chủ sở hữu này thường là một đại lý địa phương được các nhà sản xuất cấp phép phân phối cho sản phẩm của mình.
Ví dụ, nó là hợp lệ khi một công ty kinh doanh mua một lượng thuốc kê toa ở Tây Ban Nha, sau đó nhập khẩu vào Thụy Điển hay Đức mà không có sự chấp thuận của nhà phân phối địa phương sở hữu quyền sáng chế tại 2 nước đó. Trong thực tế, các quy tắc của thị trường nội bộ trong Liên minh châu Âu cho phép thương mại song song giữa những quốc gia thành viên trong hầu hết tất cả các hàng hoá.
Lưu ý rằng các hàng hóa nhập khẩu song song là hàng hóa hợp pháp tại thị trường ban đầu, chúng không phải là hàng giả mạo, hàng lậu hay hàng hóa ăn cắp.
Như vậy, hàng hóa nhập khẩu song song hoàn toàn giống với các sản phẩm chính thức của nước sở tại, ngoại trừ rằng chúng có thể được đóng gói khác nhau và có thể không có bảo hành của nhà sản xuất gốc.
Nguyên nhân của nhập khẩu song song thường là các công ty, hoặc là nhà sản xuất hoặc nhà phân phối, do nhiều nguyên nhân đã thiết lập mức giá khác nhau cho cùng một sản phẩm của mình tại các thị trường khác nhau. Vì thế, các nhà nhập khẩu song song thường mua sản phẩm tại một quốc gia có mức giá (P1) rẻ hơn giá mà chúng được bán chính thức ở một nước thứ hai (P2), sau đó họ nhập khẩu các sản phẩm này vào nước thứ hai, và bán các sản phẩm ở nước này tại một mức giá mà thường nằm giữa P1 và P2.
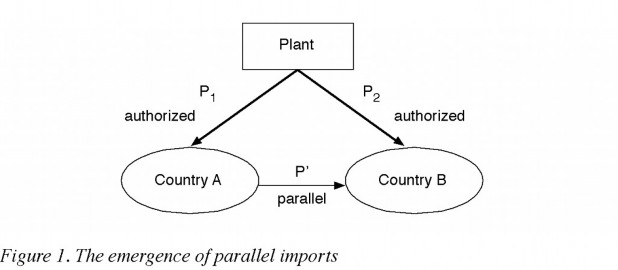
Về vấn đề này, thực sự đã có nhiều tranh cãi giữa những người ủng hộ và phản đối xung quanh tính hợp pháp của việc nhập khẩu song song, nó liên quan đến một học thuyết gọi là “Học thuyết hết quyền – Exhaustion doctrine” hay còn gọi là học thuyết “bán lần đầu – first sale doctrine”. Theo học thuyết đó, lợi nhuận có được từ việc các công ty bán sản phẩm của mình lần đầu tiên ra thị trường là đã đủ
để đền đáp cho công ty đó trong việc nghiên cứu ra sản phẩm. Kể từ đấy họ sẽ không còn quyền hạn gì về sở hữu trí tuệ với sản phẩm đó nữa, nói cách khác họ không thể can thiệp vào những gì xảy đến tiếp theo đối với các sản phẩm đã bán ra trên thị trường. Tuy nhiên, quan niệm về tính đúng đắn của học thuyết đó là khác nhau giữa các quốc gia. Những nước phản đối sẽ ban hành các luật lệ cấm việc nhập khẩu song song, trong khi các nước ủng hộ thì sẽ xem việc nhập khẩu như thế là hợp pháp.
Trong thị trường dược phẩm, quy định về nhập khẩu song song đã trở thành một vấn đề quan trọng trong hệ thống thương mại toàn cầu. Những người ủng hộ một hệ thống quốc tế để bảo vệ chặt chẽ quyền sở hữu trí tuệ thì mong muốn một lệnh cấm nhập khẩu song song được ban hành trên phạm vi toàn thế giới. Họ lý luận rằng nếu như loại hình này được cho phép rộng rãi, nó sẽ làm giảm đáng kể lợi nhuận trong lĩnh vực nghiên cứu những dược phẩm đặc trị, và hậu quả là sẽ không thể khuyến khích và làm suy tàn công việc R&D để sáng tạo ra những loại thuốc tiên tiến. Hơn nữa, nhập khẩu song song sẽ làm các cơ quan y tế khó khăn hơn trong việc kiểm soát giá thuốc và ban hành các chính sách về thuốc của mình. Thế nhưng, cơ quan quản lý y tế ở các nước nghèo thì lại cho rằng khả năng tiếp cận được những nguồn cung ứng rẻ là rất quan trọng, vì vậy họ ủng hộ việc nhập khẩu song song. Cho dù không ủng hộ, họ cũng muốn dùng việc nhập khẩu song song để đe dọa và tạo sức ép để các nhà phân phối chính phải giảm giá thành sản phẩm của mình. Rõ ràng là những người hoạch định chính sách ở các nước đang phát triển đặc biệt xem trọng việc tiếp cận những nguồn thuốc giá rẻ cho quốc gia mình hơn là việc ủng hộ việc đầu tư nghiên cứu R&D ở nước ngoài.
Nhập khẩu song song được cho phép trong Hiệp định TRIPS, nhưng Hiệp định TRIPS không quy định vấn đề này một cách rõ ràng. Mặc dù Điều 28 của Hiệp định TRIPS cấp độc quyền nhập khẩu cho chủ bằng sáng chế, Điều 6 của Hiệp định TRIPS cho phép thành viên hạn chế quyền của chủ sở hữu sáng chế của theo nguyên tắc của học thuyết hết quyền, và quy định rằng vấn đề hết quyền không bị áp dụng cơ chế giải quyết tranh chấp; do đó cho phép các quốc gia tự do để xác định chính sách riêng của họ để hợp pháp hóa nhập khẩu song song về mặt này.
Trong quá trình đàm phán và ký kết Hiệp định TRIPS, các nước đã không thể thống nhất được với nhau về vấn đề khai thác hết quyền sở hữu trí tuệ. Có quá nhiều cách tiếp cận và quan điểm về vấn này và pháp luật của các nước cũng rất khác nhau, quyền lợi của các nước phát triển và đang phát triển cũng khác nhau làm cho các nước không thể đi đến thỏa thuận được với nhau. Đây là vấn đề có ý nghĩa đặc biệt quan trọng trong mối tương quan về quan hệ lợi ích giữa các nước phát triển và các nước đang phát triển cũng như tương quan lợi ích giữa chủ sở hữu trí tuệ với lợi ích của xã hội. Vấn đề mấu chốt đặt ra là phạm vi quyền của chủ sở hữu sẽ được mở rộng đến mức nào hay nói cách khác là chủ sở hữu trí tuệ được kiểm soát sản phẩm mang đối tượng sở hữu trí tuệ được bảo hộ của mình đến giai đoạn nào của quá trình lưu thông sản phẩm. Chính vì vậy, Điều 6 của Hiệp định đã quy định theo hướng các thành viên có quyền tự quyết định về việc xác định quyền sở hữu trí tuệ chấm dứt ở phạm vi quốc gia, khu vực hay quốc tế. Tuyên bố Doha về Hiệp định TRIPS và sức khỏe cộng đồng một lần nữa khẳng định việc quy định hiệu lực của các quy định trong hiệp định TRIPS liên quan tới trạng thái đã khai thác hết quyền sở hữu trí tuệ thuộc quyền của mỗi thành viên. Các thành viên được quyền đặt ra quy định của mình về trạng thái đã khai thác hết quyền sở hữu trí tuệ mà không làm ảnh hưởng đến quy định về chế độ đối xử quốc gia và đối xử tối huệ quốc quy định tại Điều 3 và Điều 4 của Hiệp định TRIPS. Trên thực tế, liên quan đến quyền ngăn cấm của chủ sở hữu sáng chế, hầu hết các quốc gia hiện nay áp dụng học thuyết chấm dứt quyền sau lần bán đầu tiên trên phạm vi quốc tế.
Vào tháng 12 năm 1997, chính phủ Nam Phi đã thông qua một điều luật cho phép thực thi hai chính sách gây nhiều tranh cãi. Một là, việc nhập khẩu song song cho phép những nhà nhập khẩu Nam Phi được mua các loại thuốc từ nguồn rẻ nhất sẵn có, bất kể những người giữ bản quyền có cho phép hay không. Nam Phi đã khẳng định quyền nhập khẩu “những phiên bản giá rẻ” của các loại thuốc có bản quyền. Chính phủ làm điều này bởi họ không đủ khả năng để chi trả cho các loại thuốc có bản quyền giá cao. Hai là, việc cấp phép bắt buộc, cho phép chính phủ Nam Phi cấp phép cho các công ty nội địa sản xuất những phiên bản giá rẻ của các loại thuốc mà các công ty nước ngoài đang giữ bản quyền, bất kể họ có đồng ý hay không. Các nhà sản xuất thuốc nước ngoài nhận thấy điều luật này đã vi phạm
quyền sở hữu trí tuệ của họ, và 39 công ty nước ngoài nhanh chóng đâm đơn kiện nhằm ngăn chặn việc thực thi điều luật này. Trong khi pháp luật quốc tế đứng về phía các công ty dược thì họ vấp phải sự phản ứng gay gắt từ phía công chúng. Một số nhà sản xuất thuốc trị bệnh AIDS hàng đầu, trong khi vẫn phản đối điều luật của Nam Phi, đã bắt đầu thay đổi chính sách của họ. Vào tháng 5/2000, năm nhà sản xuất thuốc trị bệnh AIDS lớn - Merck, Bristol-Myers Squibb, Roche, Glaxo, và Boehringer Ingelhiem - tuyên bố rằng họ sẽ thương lượng bán thuốc trị bệnh AIDS với giá thấp hơn tại những nước đang phát triển, đầu tiên tại vùng Saharan châu Phi. Tuy nhiên làn sóng phản đối vẫn tiếp diễn. Vào tháng 2/2001, một công ty dược Ấn Độ, Cipla, chào bán một hỗn hợp 3 loại thuốc trị bệnh AIDS cho các nước nghèo ở châu Phi với mức giá 600 USD/ năm cho một bệnh nhân, và 350 USD cho Tổ chức các Bác sĩ không Biên giới (thông thường bệnh AIDS được điều trị với một hỗn hợp kết hợp 10 loại thuốc kháng virút khác nhau). Bản quyền của các loại thuốc này được sở hữu bởi những công ty phương Tây, nhưng luật Ấn Độ cho phép các công ty nội địa sản xuất những phiên bản giá rẻ của các loại thuốc có bản quyền. Tuyên bố của Cipla dường như đã tác động mạnh đến những công ty dược phương Tây. Vào tháng 3 năm 2001, Merck thông báo họ sẽ giảm giá hai loại thuốc trị bệnh AIDS, Crixivan và Stocrin. Crixivan, được bán với giá 6.016 USD/năm tại Mỹ, sẽ được bán chỉ 600 USD/năm cho các nước đang phát triển. Stocrin, được bán với già 4.730 USD/năm tại Mỹ, sẽ được bán chỉ 500 USD/năm. Vài ngày sau đó, Bristol- Myers Squibb đưa ra giá thấp hơn, tuyên bố sẽ bán thuốc trị bệnh AIDS Zerit đến các nước nghèo khổ tại châu Phi với giá chỉ 0,15 USD/ngày hoặc 54 USD/năm cho một bệnh nhân, thấp hơn chi phí sản xuất Zerit. Tại Mỹ và châu Âu, Zerit đang được bán cho bệnh nhân với giá 3.589 USD/năm. Bước đi này tiếp theo sau một tuyên bố từ phòng thí nghiệm Abbott sẽ bán hai trong số các loại thuốc trị bệnh AIDS với mức giá “không lợi nhuận” tại vùng Saharan châu Phi. Tuy nhiên, không có bước đi ở trên nào đủ sức xoa dịu làn sóng chỉ trích. Vào tháng 4/2001, các công ty dược dường như đầu hàng trong cuộc chiến với công chúng và họ đồng ý ngừng vụ kiện chống lại chính phủ Nam Phi. Điều này mở ra hướng đi cho Nam Phi trong việc bắt đầu nhập khẩu những phiên bản giá rẻ của các loại thuốc có bản quyền từ các nhà sản xuất như Cipla của Ấn Độ. Cùng lúc đó, các công ty dược cũng có được
sự đảm bảo của Nam Phi rằng những phiên bản giá rẻ của các loại thuốc có bản quyền sẽ chỉ được bán tại vùng Saharan châu Phi và không được xuất khẩu sang các khu vực khác trên thế giới.
2.2.6 Thời hạn bảo hộ sáng chế dược phẩm
Thời hạn của bằng sáng chế là khoảng thời gian tối đa mà bằng sáng chế có hiệu lực. Thời gian này thường được bắt đầu tính từ ngày nộp đơn xin cấp bằng hoặc từ ngày bằng bảo hộ được cấp. Thời hạn bảo hộ sáng chế nói chung và sáng chế dược phẩm nói riêng không được ngắn hơn 20 năm tính từ ngày nộp đơn theo quy định tại Điều 33 Hiệp định TRIPS. Kết quả là hầu hết các hệ thống pháp luật sáng chế hiện nay quy định thời hạn bảo hộ sáng chế là 20 năm kể từ ngày nộp đơn. Tuy nhiên, quy định này của WTO không cấm các nước Thành viên ghi nhận trong pháp luật nội địa quyền khác tương tự quyền sáng chế với thời hạn ngắn hơn. Một ví dụ cho loại quyền này là quyền đối với giải pháp hữu ích (utility models) với thời hạn bảo hộ thường là 6 hoặc 10 năm.
Trong khuôn khổ WTO đã từng có một số tranh chấp giữa các nước Thành viên về quy định trong pháp luật quốc gia liên quan đến thời hạn bảo hộ sáng chế. Một trong số đó là vụ kiện nổi tiếng Canada-Term of Patent Protection [64], theo đó ngày 06/05/1999, Hoa Kỳ yêu cầu tham vấn với Canada về điều khoản bảo hộ đối với các sáng chế được cấp trước ngày 01/10/1989. Hoa Kỳ cho rằng Hiệp định TRIPS quy định các thành viên phải bảo hộ các sáng chế trong vòng ít nhất 20 năm kể từ ngày cấp bằng sáng chế và yêu cầu các thành viên áp dụng điều khoản tối thiểu này cho tất cả các sáng chế kể từ ngày thực thi hiệp định của các thành viên. Hoa Kỳ cáo buộc, theo Bộ luật sáng chế Canada, điều khoản quy định về bảo hộ sáng chế với các sáng chế cấp trước ngày 01/0/1989 là 17 năm kể từ ngày cấp bằng sáng chế. Hoa Kỳ cáo buộc Canada vi phạm Điều 33,65 và 70 của Hiệp định TRIPS. Ngày 15/07/1999, Hoa Kỳ yêu cầu thành lập Ban Hội thẩm. Ngày 22/10/1999, Ban Hội thẩm chính thức được thành lập. Ngày 05/05/2000, Ban Hội thẩm công bố báo cáo. Báo cáo nêu rõ:
- Theo Điều 70.2 của Hiệp định TRIPS, Canada cấp bằng bảo hộ sáng chế cho các sáng chế có hiệu lực ngày 01/01/1996, ngày hiệu lực Canada thực thi Hiệp định TRIPS.