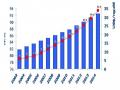
Biểu đồ 5. Số lượng đơn sáng chế dược phẩm nộp tại Việt Nam
(từ 2005 tới 2010)
700
600
500
Tổng số đơn nộ lĩnh vực dược p
400
Có thể bạn quan tâm!
-
 Quy Định Về Bảo Vệ Quyền Đối Với Sáng Chế Dược Phẩm
Quy Định Về Bảo Vệ Quyền Đối Với Sáng Chế Dược Phẩm -
 Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới:
Thực Trạng Bảo Hộ Sáng Chế Cho Dược Phẩm Trên Thế Giới: -
 Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam:
Thực Trạng Bảo Hộ Sáng Chế Dược Phẩm Tại Việt Nam: -
 Kiến Nghị Cần Có Quy Định Thống Nhất Trong Luật Shtt Năm 2005 (Sửa Đổi Năm 2009), Luật Khám Chữa Bệnh Năm 2009 Và Luật Dược Năm 2005.
Kiến Nghị Cần Có Quy Định Thống Nhất Trong Luật Shtt Năm 2005 (Sửa Đổi Năm 2009), Luật Khám Chữa Bệnh Năm 2009 Và Luật Dược Năm 2005. -
 Bảo hộ sáng chế cho dược phẩm theo quy định của Hiệp định TRIPS - 15
Bảo hộ sáng chế cho dược phẩm theo quy định của Hiệp định TRIPS - 15 -
 Bảo hộ sáng chế cho dược phẩm theo quy định của Hiệp định TRIPS - 16
Bảo hộ sáng chế cho dược phẩm theo quy định của Hiệp định TRIPS - 16
Xem toàn bộ 128 trang tài liệu này.
300
200
Tổng số đơn củ đơn Việt Nam t dược phẩm
100
800
Với biểu đồ số 4 lại cho thấy rõ hơn trình độ sáng tạo của các doanh nghiệp Việt Nam trong lĩnh vực dược phẩm đang ở một mức rất thấp, thể hiện qua số lượng đơn sáng chế người Việt Nam nộp vô cùng hạn chế. Số lượng đơn sáng chế nộp bởi người Việt Nam cũng giao động nhẹ và không rõ chiều hướng tăng, trái lại còn có xu hướng giảm từ 2007 tới 2010.
Biểu đồ 6. Số lượng Bằng độc quyền sáng chế dược phẩm được cấp tại Việt Nam (từ 2005 tới 2010)
1000
900
800
700
Tổng số bằng được cấp
600
500
Tổng số bằng thuộc lĩnh vực dược phẩm
400
300
200
Tổng số bằng của người nộp đơn Việt Nam thuộc lĩnh vực dược phẩm
100
0
2005
2006
2007
2008
2009
2010
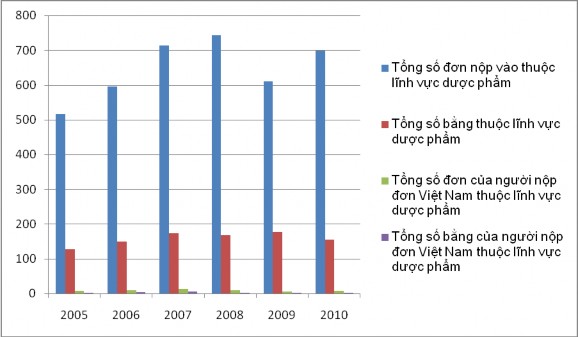
Tổng số bằng của người nộp đơn Việt Nam gần như chúng ta khó nhận thấy trên biểu đồ này vì nó chiếm một tỷ lệ quá nhỏ. Thông thường phải mất khoảng 36 tháng kể từ ngày nộp đơn tới lúc cấp văn bằng bảo hộ. Trong khoảng 5 năm đủ để chúng ta so sánh tỷ lệ đơn nộp so với số bằng cấp ra trong lĩnh vực sáng chế. Và ở đây, rõ ràng là tỷ lệ số bằng cấp ra/số đơn nộp vào thấp. Tỷ lệ này đối với đơn do người nộp đơn Việt Nam nộp chỉ khoảng ¼. Điều này chứng tỏ số lượng đơn nộp thành công (tức là đươc cấp văn bằng bảo hộ) của người nộp đơn Việt Nam thấp. Đối với các đơn do người nộp đơn nước ngoài nộp thì tỷ lệ này cao hơn, bởi lẽ, hầu hết đều là đơn PCT.
Ta có thể thấy rõ hơn mối tương quan này qua biểu đồ 6 sau đây:
Biểu đồ 7. Số đơn nộp và số bằng cấp ra trong lĩnh vực dược phẩm tại Việt Nam (Từ 2005 tới 2010)
3.3. Nguyên tắc và một số giải pháp hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm:
3.3.1. Nguyên tắc hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm:
Theo báo Thanh niên ngày 06/7/2010, một số loại thuốc tại Việt Nam hiện nay có giá cao hón giá bán tại các nước trên thế giới khoảng 40% trong khi thu nhập bình quân của người dân Việt Nam rất thấp, tiền chi cho y tế hàng năm tại Việt
Nam không cao (năm 2009, chi phí trung bình cho y tế (không chỉ cho riêng dược phẩm) là 16.45 USD/đầu người. Giá thuốc cao vượt quá khả năng chi trả của người dân Việt Nam có thể được giải thích bởi nhiều lý do, Báo cáo tác động của cơ chế về quyền SHTT đối với giá thuốc tại Việt Nam do Viện khoa học xã hội Việt Nam nghiên cứu năm 2006 chỉ ra năm yếu tố chính làm giá thuốc tại Việt Nam tăng cao, bao gồm: Cơ chế quản lý hoạt động kinh doanh; Tâm lý người tiêu dùng; Thông tin về tình hình dược phẩm; Công nghệ sản xuất thuốc Việt Nam chưa phát triển; sự độc quyền trong phân phối thuốc. Theo báo cáo trên, yếu tố bảo hộ quyền SHTT không phải là yếu tố quyết định đến giá thuốc cao tại Việt Nam. Tuy nhiên, theo tác giả, quan điểm này là chưa hoàn toàn chính xác. Bên cạnh những yếu tố được chỉ ra ở trên, các chi phí bất hợp lý trong việc phân phối thuốc và sự thiếu đạo đức của bác sĩ kê toa thuốc và sự “độc quyền” đối với dược phẩm là những yếu tố làm tăng giá thuốc. Ngoài tất cả các yếu tố trên, việc bảo hộ sáng chế dược phẩm cũng tác động mạnh đến giá thuốc. Bên cạnh việc cộng vào giá thuốc các chi phí cho việc bảo hộ sáng chế các dược phẩm, việc không có sản phẩm cạnh tranh trên thị trường trong thời gian bảo hộ sáng chế đã tạo cơ hôi cho người nằm độc quyền sáng chế tăng giá bán của dược phẩm. Giá thuốc quá cao, vượt quá khả năng chi trả của phẩn lớn người dân đã ảnh hưởng nghiêm trọng đến một trong những quyền cơ bản của con người là quyền được chăm sóc sức khỏe. Không giống như các loại hàng hóa thông thường, thuốc chữa bệnh là một hàng hóa đực biệt, khi đã bị bệnh, dù không đủ khả năng trả tiền thuốc thì người bệnh và người thân của người bệnh cũng sẽ phải huy động toàn bộ nguồn lực tài chính để chữa bệnh. Người tiêu dùng cũng có thể không tìm được sản phẩm thay thế. Vì trong nhiều trường hợp người bệnh sẽ không có sự lụa chọn dược phẩm giống như các hàng hóa thông thường. Một người bị bệnh ung thư không thể mua thuốc chữa dạ dày thay thế thuốc chữa ung thư đã được bác sỹ chỉ định chỉ vì lý do thuốc chữa dạ dày có giá rẽ hơn. Người bệnh cũng không thể tự mình thay thuốc chữa ung thư này bằng một loại thuốc khác chống ung thư khác nếu không có sự chỉ định của bác sỹ. Nhu vậy trong lĩnh vực dược phẩm rất cần nhà nước có những hành động tích cực, đưa ra nhưng giải pháp quan trọng để dược phẩm đến tay người tiêu dùng được giá cả hợp lý và chất lượng.
Để duy trì trùy cân bằng giữa việc bảo hộ sáng chế và quyền tiếp cận dược
phẩm Việt Nam cần đáp ứng những điều kiện cụ thể về pháp luật, về kinh tế, về công nghệ, về chính sách…mặt khác chúng ta phát huy những mặt tích cực của việc bảo hộ sáng chế tại Việt Nam cần có giải pháp tổng thể từ góc độ pháp lý, kinh tế, công nghệ đến năng lưc quản lý hành chính và khả năng chuyên môn của đối ngũ cán bộ, bên cạnh đó cũng cần nâng cao nhận thức của các doanh nghiệp về vấn đề này. Trong đó việc hoàn thiện pháp luật về bảo hộ sáng chế dược phẩm phải được xem là yếu tố quan trọng và cần tiến hành đồng thời cùng các giải pháp, tuy nhiên trong phạm vi nghiên cứu của luận văn tác giả sẽ tập trung vào việc đưa ra các giải pháp và kiến nghị cụ thể hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm theo hướng sau:
Thứ nhất, Việt Nam cần tuân thủ những cam kết quốc tế về SHTT đồng thời nghiên cứu và khai thác hiệu quả các quy định về các ngoại lệ và hạn chế quyền SHTT được quy định trong các ĐƯQT.
Bên cạnh việc thiết lập nhưng tiêu chuẩn bảo hộ tối thiểu và yêu cầu của các thành viên WTO phải tuân thủ; bằng các quy định tùy nghi, Hiệp định TRIPS đã trao quyền tự quyết cho các nước thành viên trong việc xây dựng hoàn thiên pháp luật phù hợp với chính sách và điều kiện thực tế của mỗi quốc gia. Các quy định tùy nghi bao gồm các quy đinh về thời hạn chuyển tiếp đối với các thành viên là quốc gia đang phát triển, quy đinh về các trường hợp ngoại lệ trong bảo hộ các đối tượng SHTT, quy định về các trường hợp hạn chế quyền SHTT, về nhập khẩu song song, về các định trưởng hợp không bảo hộ một số đối tượng SHTT…đặc biệt áp dụng đối với bảo hộ sáng chế dược phẩm.
Thứ 2, việc bảo hộ sáng chế cho dược phẩm cần xác rõ mục tiêu có ảnh hưởng đến hệ thống sáng chế, đến các vấn đề kinh tế xã hội của Việt Nam và đến lợi ích quốc gia cũng như quan hệ quốc tế trong trình hoàn thiện pháp luật về bảo hộ sáng chế dược phẩm để xây dựng các quy phạp pháp luật cho phủ hợp. Việc hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm đòi hỏi phải phù hợp với thực tiễn Việt Nam, phù hợp với sự phát triển kinh tế - xã hội của đất nước, nhằm đạt được các mục tiêu phát triển kinh tế và xã hội. Tuy nhiên, pháp luật Việt Nam phải đảm bảo có các quy định nhằm trách lạm dụng quyền của các quốc gia đang phát triển, áp dụng các ngoại lệ của TRIPS về bảo hộ sáng chế dược phẩm để gây
ảnh hưởng xấu đến lợi ích hợp pháp của người nắm độc quyền sáng chế, ảnh hưởng đến môi trường đầu tư cũng như quan hệ hợp tác quốc tế.
Thứ 3, nghiên cứu, tham khảo học tập có chọn lọc kinh nghiệm của các nước về bảo hộ sáng chế dược phẩm và vận dụng phù hợp với thực tiễn của Việt Nam. Pháp luật về sáng chế nói chung và pháp luật về sáng chế dược phẩm nói riêng tại một số quốc gia trên thế giới đã hình thành trước Việt Nam hàng thập kỷ. Việc học tập kinh nghiệm của các nước, đặc biệt các nước phát triển sẽ hữu ích cho Việt Nam trong việc hoàn thiện pháp luật Việt Nam về SHTT nói chung và pháp luật về bảo hộ sáng chế dược phẩm nói riêng. Tuy nhiên, “không có một mô hinh pháp luật nào phù hợp với tất cả các mô hình khác” dó đó việc hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm phải dựa trên điều kiện cụ thể của đất nước.
Trên cơ sở phương hướng đã được được xác định, việc đề xuất các giải pháp và kiến nghị nhằm hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế cho dược phẩm phải tuân thủ các nguyên tắc:
Thứ nhất các giải pháp kiến nghị nhằm hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm quán triệt đường lối của đảng và chinh sách của nhà nước về chủ động hội nhập quốc tế và thực hiện cam kết quốc tế, phát triển khoa học công nghệ, công nhận và tăng cường bảo hộ SHTT. Bên cạnh đó phải xuất phát từ thực tiễn Việt Nam, đồng thời tiếp thu có chọn lọc kinh nghiệm quốc tế về xây dựng và tổ chức thi hành pháp luật.
Thứ hai, đặc biệt quan trọng trong lĩnh vực bảo hộ sáng chế dược phẩm là cân bằng lợi ích giữa chủ sở hữu sáng chế và lợi ích của xã hội, lợi ích quốc gia là nguyên tắc cơ bản, xuyên suốt quá trình xây dựng và hoàn thiện pháp luật cũng như thực thi pháp luật trên thực tế. Việc tăng cường bảo hộ mạnh quyền SHTT khi Việt Nam hội nhập sâu vào quá trình toàn cầu hóa sẽ mang đến cho Việt Nam nhiều thách thức hơn là cơ hội. Trong bối cảnh đó, Việt Nam cần đảm bảo được lợi ich quốc gia, lợi ích xã hội và lợi ích của các tổ chức cá nhân trước sức ép của quá trình hội nhập quốc tế trong bảo hộ sáng chế dược phẩm đồng thời cần tôn trọng và thực hiện các cam kết quốc tế.
Thứ ba, việc hoàn thiện pháp luật về bảo hộ sáng chế cho dược phẩm cần đảm bảo tính “đồng bộ, thống nhất, khả thi, công khai, minh bạch”. Tính đồng bộ
thể hiện sự thống nhất, không mâu thuẩn, không trùng lặp, chồng chéo trong mỗi ngành luật, mỗi chế định pháp luật và giữa các quy phạm pháp luật vơi nhau. Cần phải đảm bảo tính thống nhất trong các quy định pháp luật về bảo hộ sáng chế dược phẩm không chỉ trong luật SHTT, giữa BLDS, Luật Dược, Luật Khám chữa bệnh, Luật Hành chính, Pháp luật về cạnh tranh…mà còn trong chính sách của nhà nước và bộ ban nghành liên quan như Bộ Y tế, Bộ Khoa học và Công nghệ.
3.3.2 Một số giải pháp nhằm hoàn thiện pháp luật Việt Nam về bảo hộ sáng chế dược phẩm:
3.3.2.1. Sửa đổi Điều 136 và Điều 142 Luật SHTT
Điều 136 Luật SHTT quy định: “Chủ sở hữu sáng chế có nghĩa vụ sản xuất sản phẩm được bảo hộ hoặc áp dụng quy trình được bảo hộ để đáp ứng nhu cầu quốc phòng, an ninh, phòng bệnh, chữa bệnh, dinh dưỡng cho nhân dân hoặc các nhu cầu cấp thiết khác của xã hội. Khi có các nhu cầu quy định tại khoản này mà chủ sở hữu sáng chế không thực hiện nghĩa vụ đó thì cơ quan nhà nước có thẩm quyền có thể chuyển giao quyền sử dụng sáng chế cho người khác mà không cần được phép của chủ sở hữu sáng chế theo quy định tại Điều 145 và Điều 146 của Luật này”.
Điều 145 Luật SHTT quy định: ”Bên được chuyển quyền sử dụng sáng chế theo hợp đồng độc quyền có nghĩa vụ sử dụng sáng chế như chủ sở hữu sáng chế theo quy định tại khoản 1 Điều 136 của Luật này”.
Tác giả kiến nghị sửa đổi Điều 136 và Điều 142 Luật SHTT ở hai nội dung: Sửa đổi Điều 136 (1) Luật SHTT theo hướng quy định chủ sở hữu sáng chế có nghĩa vụ sử dụng sáng chế phù hợp với yêu cầu phát triển kinh tế xã hội của Việt Nam; đưa quy định tại điều 142 (5) Luật SHTT vào quy định tại Điều 136 Luật SHTT.
a. Kiến nghị sửa đổi Điều 136 (1) Luật SHTT gắn với nghĩa vụ sử dụng sáng chế của sở hữu sáng chế phù hợp với yêu cầu phát triển kinh tế xã hội.
Thứ nhất quy định tại điều 136 (1) Luật SHTT gắn nghĩa vụ sử dụng sáng chế của chủ sở hữu sáng chế với mục đích “đáp ứng nhu cầu quốc phòng, an ninh, phòng bệnh, chữa bệnh, dinh dưỡng cho nhân dân hoặc các nhu cầu cấp thiết khác của xã hội” đã bộc lộ một số bất cập sau:
Một là, hạn chế khả năng sử dụng BBCGQSDSC trong trường hợp người nắm độc quyền vi phạm nghĩa vụ sử dụng sáng chế. Điều này đặc biệt quan trọng trong sáng chế dược phẩm, đây là loại hàng hóa đặc biệt, có ý nghĩa quan trọng đối với mỗi quốc gia. Nghĩa vụ sử dụng của chủ sở hữu sáng chế không chỉ giới hạn ở nghĩa vụ đáp ứng các nhu cầu cấp thiết của xã hội bao gồm nhu cầu an ninh, quốc phòng, phòng bệnh, chữa bệnh, dinh dưỡng cho nhân dân như quy định tại Điều 136(1) Luật SHTT. Nếu chỉ có thể BBCGQSDSC trong trường hợp chủ sở hữu vi phạm nghĩa sử dụng sáng chế mà ảnh hưởng đến việc đáp ứng nhu cầu an ninh, quốc phòng, mục đích công cộng mới là không hợp lý, hạn chế khả năng BBCGQSDSC trong trường hợp người nắm độc quyền sử dụng vi phạm nghĩa vụ sử dụng sáng chế, ảnh hưởng đến nhu cầu của xã hội, đến sự phát triển bình thường của nền kinh tế hay trong trường hợp cần thiết nhằm bảo vệ môi trường.
Hai là, có sự chồng chéo, mâu thuẩn trong quy định của Điều 136 (1) với Điều 133, Điều 145 (1(a)) Luật SHTT. Điều 133 Luật quy định các trường hợp sử dụng sáng chế nhân danh nhà nước nhằm phục vụ cho mục đích công cộng, phi thương mại, an ninh, phục vụ quốc phòng, phòng bệnh, chữa bệnh, dinh dưỡng cho nhân dân và đáp ứng các nhu cầu cấp thiết khác của xã hội. Theo Điều 133, khi xảy ra trường hợp trên, Bộ, cơ quan ngang bộ có thể sử dụng hoặc phải sử dụng sáng chế theo quy định bắt buộc chuyển giao quyền theo quy định tại Điều 145, 146 Luật SHTT. Điều 145 (1(a)) quy định về BBCGQSDSC trong trường hợp sử dụng sáng chế nhằm đáp ứng mục đích công cộng, phi thương mại, với sự liệt kê các trường hợp giống như quy định tại Điều 133. Tuy nhiên không chỉ có các Bộ, cơ quan ngang bộ mới có quyền yều cầu BBCGQSDSC theo các lý do được quy định tại Điều 145 (1(a)) mà quyền yêu cầu còn thuộc về tổ chức, cá nhân bất kỳ.
- Đối với Việt Nam trong quá trình gia nhập WTO, Việt Nam cũng khẳng định chủ sở hữu sáng chế hoặc bên nhận trong hợp đồng chuyển giao quyền sử dụng độc quyền có nghĩa vụ sử dụng sáng chế phù hợp với yêu cầu phát triển kinh tế - xã hội của Việt Nam. Vì vậy, yêu cầu sửa đổi Điều 136 (1) Luật SHTT như tác giả kiến nghị hoàn toàn phù hợp với các cam kết quốc tế của Việt Nam.
- Trong quá trình nghiên cứu pháp luật các nước, việc sử dụng sáng chế vì lý do “lợi ích công cộng” được quy định như những lý do độc lập, không phụ thuộc
vào việc người nắm độc quyền sáng chế có vi phạm nghĩa vụ sáng chế hay không. Do đó, yêu cầu sửa đổi Điều 136 (1) Luật SHTT như tác giả kiến nghị là phù hợp với quy định của các nước.
Ví dụ, Trong lĩnh vực dược phẩm, nếu người nắm độc quyền sử dụng sáng chế không cung cấp đủ số lượng sản phẩm nhằm đáp ứng nhu cầu hợp lý của xã hội hoặc cung cấp với mức giá cao một cách bất hợp lý, sẽ ảnh hưởng đến lợi ích của bệnh nhân. Việc sử dụng sáng chế không phù hợp cũng có thể ảnh hưởng nghiêm trọng tới sự phát triển bình thường của các lĩnh vực kinh tế quan trọng, đặc biệt trong lĩnh vực công nghệ dược phẩm.
b. Kiến nghị sửa đổi Điều 136 (1) Luật SHTT theo hướng đưa quy đinh tại Điều 142 (5) Luật SHTT vào quy định tại Điều 136 Luật SHTT. Kiến nghị này được đưa ra là dựa trên các cơ sở lý luận và thực tiễn sau:
Theo pháp luật Việt Nam hiện hành, nghĩa vụ sử dụng sáng chế được quy định ở hai điều luật khác nhau trong một đạo luật: Điều 136 (quy định nghĩa vụ sử dụng sáng chế của chủ sở hữu sáng chế); Điều 142 (quy định nghĩa vụ sử dụng sáng chế của người nắm độc quyền sáng chế). Điều này chưa thực sự hợp lý vì nghĩa vụ sử dụng sáng chế của chủ sở hữu sáng chế và bên nhận chyển giao trong hợp độc độc quyền là như nhau; nghĩa vụ sử dụng sáng chế của bên nhận chuyển giao trong hợp đồng chuyển giao độc quyền không phải là trường hợp hạn chế chuyển giao quyền sử dụng đối tượng SHCN, do đó, không nên quy định trong Điều 142, đặc biệt được quy định trên mối quan hệ tổng thể với các quy định khác trong Điều 142 Luật SHTT. Và như vậy tác giả kiến nghị sửa đổi Điều 136 như sau:
1. Chủ sở hữu sáng chế có nghĩa vụ sản xuất sản phẩm được bảo hộ hoặc áp dụng quy trình được bảo hộ phù hợp với yêu cầu phát triển kinh tế-xã hội của đất nước. Trong trường hợp chủ sở hữu sáng chế không sử dụng hoặc sử dụng sáng chế không phủ hợp với yêu cầu phát triển kinh tế-xã hội của đất nước thì cơ quan nhà nước có thẩm quyền có thể chuyên giao quyền sử dụng sáng chế cho người khác mà không cần được phép mà không cần được pháp của chủ sở hữu sáng chế theo quy định tại Điều 145, 146,147 của Luật này.
2. Bên được chuyển quyền sử dụng sáng chế theo hợp đồng độc quyền có nghĩa vụ sử dụng sáng chế như chủ sở hữu sáng chế theo quy định tại khoản 1