Trích ly theo cơ chế trao đổi ion Nguyên tắc
Dựa trên cơ sở của quá trình trao đổi ion của chất phân tích với ion đối (ion trao đổi) của chất trích ly (pha tĩnh trao đổi ion) để hấp thu (giữ) chất phân tích lại trên pha tĩnh (cột trích ly). Sau đó dùng một pha động (dung
dịch) phù hợp để rửa giải chất phân tích vào dung môi đó và sau đó tiến
hành xác định nó theo một phương pháp phân tích thích hợp đã chọn. Dung môi rửa giải ở đây là dung dịch nước của các muối tan của kim loại kiềm, amoni có pH phù hợp, hay dung dịch axit loãng và có thể có thêm chất tạo phức.
Chất trao đổi ion
Chất trao đổi ion của kỹ thuật này có thể là hai loại sau đã và đang được sử dụng phổ biến, đó là:
Trao đổi Cation axit mạnh (RSO3Na) và axit yếu (RCOONa).
Trao đổi Anion Bazơ mạnh (RN+(OH)), bazơ yếu (RNH2OH).
Cơ chế của sự trao đổi ion
Loại trao đổi Cation theo phương trình tổng quát quá trình trao đổi Cation:
Có thể bạn quan tâm!
-
 Kỹ Thuật Trích Ly Thường Sử Dụng Khi Xử Lý Mẫu
Kỹ Thuật Trích Ly Thường Sử Dụng Khi Xử Lý Mẫu -
 Trích Ly Lỏng Có Áp Lực Trong Phân Tích Thực Phẩm
Trích Ly Lỏng Có Áp Lực Trong Phân Tích Thực Phẩm -
 Trích Ly Bằng Dòng Siêu Chảy Trong Phân Tích Thực Phẩm
Trích Ly Bằng Dòng Siêu Chảy Trong Phân Tích Thực Phẩm -
 Phương Pháp Nội Suy Gián Tiếp Để Ước Tính Lượng Nước Bằng Cách Đo Obrix
Phương Pháp Nội Suy Gián Tiếp Để Ước Tính Lượng Nước Bằng Cách Đo Obrix -
 Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng
Xác Định Tỷ Trọng Bằng Bình Đo Tỷ Trọng -
 Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm
Hệ Sốchuyên̉ Đổi Nitơ Protein Của Nhiêù Loai Thực Phẩm
Xem toàn bộ 176 trang tài liệu này.
Trong đó:

nMatSO3Na + Men+ → (MatSO3)nMe + nNa+
(Chất trích ly) (Chất phân tích)
Mat: Mạng rắn của chất trao đổi ion;
Men+: Cation của chất phân tích.
Na+: Cation trao đổi của chất trích ly.
SO3Na: Nhóm chức trao đổi ion.
Loại trao đổi Anion: theo phương trình tổng quát quá trình trao đổi Anion
Trong đó:
nMatOH + Xn → (Mat)nX + nOH hay nMatCl + Xn →(Mat)nX + nCl (Chất trích ly) (Chất phân tích)
Mat: Là mạng rắn của chất trao đổi ion;
Xn : Anion của chất phân tích.
OH và Cl là anion trao đổi.
Trong quá trình trao đổi ion, tuỳ thuộc vào mỗi loại chất phân tích và
chất pha tĩnh (chủ yếu là nhóm chức trao đổi ion thuộc loại axit yếu hay mạnh, hoặc bazơ mạnh hay yếu), mà quá trình có thể được thực hiện tốt trong một vùng pH (môi trường axit) nhất định. Vì thế,trích ly theo cơ chế này cần phải được thực hiện trong môi trường pH (hay axit) phù hợp.
Trích lytheo cơ chế trao đổi cặp ion
Cùng với sự trao đổi cation và anion, trong trích ly pha rắn còn có cơ chế trích ly theo kiểu cặp ion. Đây cũng là bản chất trao đổi của ion của chất phân tích thông qua chất trung gian chất tạo cặp ion, nó cho ion trao đổi với chất phân tích. Nó cũng hoàn toàn tương tự như sắc ký cặp ion của hệ pha ngược hấp phụ (hệ RPHPLC). Chất trích ly ở đây thường là chất hấp phụ pha ngược.Ví dụ Silica LiChrosorb RP8, RP 18 hay là Hypersil ODS. Và ở đây cũng có hai kiểu trao đổi cặp ion.
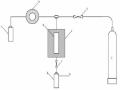
1.10.2.8 Kỹ thuật trích ly hấp phụ pha khí (rắnkhí)
Nguyên tắc chung
Kỹ thuật này dựa trên cơ sở là ở một nhiệt độ nhất định thích hợp, khi
thổi một dòng khí trơ
nóng (argon hay hêli) dẫn mẫu
ở dạng khí vào cột
trích ly, thì một nhóm các chất phân tích bị pha tĩnh rắn trong cột hấp phụ
giữ
lại, còn các chất khác thì đi qua. Vì thế
về bản chất nó cũng là quá
trìnhtrích ly giữa hai pha khí và rắn (pha trích lylà rắn, chất phân tích được trích lyở dạng khí) không tan vào nhau. Ở đây, trích lytheo cơ chế hấp phụ. Sau đó có thể:
Người ta lại làm nóng cột hấp phụ và cũng dùng dòng khí trơ nóng để giải hấp các chất phân tích đưa trực tiếp chúng vào hệ cột của máy GC hay cho chúng tan vào một dung môi hữu cơ phù hợp để xác định bằng cách khác, như HPLC hay phổ UVVIS.
Hay cũng có thể
giải
trích ly chất phân tích ra khỏi cột
trích ly
bằng một dung môi hữu cơ thích hợp hoà tan tốt chất và xác định chúng bằng HPLC hay IR.
Phương pháp trích lynày được ứng dụng cho cả mẫu rắn và lỏng, hay bùn, hay bã thải, nhưng chỉ cho các chất phân tích là các hợp chất hữu cơ có nhiệt độ bay hơi thấp (dưới 150 oC) và dễ bay hơi. Kỹ thuật này rất thích
hợp cho
trích lycác chất hữu cơ
trong môi trường khí, hay các mẫu rắn,
mẫu bột, hay mẫu bùn và mẫu nhão. Tất nhiên, việc trước tiên là phải nhũ hoá các mẫu này bằng một dung môi thích hợp, như nước hay dung môi hữu
cơ có nhiệt độ sôi cao. Còn chất hấp phụ ở đây là các hạt silica rắn xốp
được nhồi vào cột trích ly đóng kín. Nó cũng thường là các silica trung tính xốp hay silica đã được thế hoá (alkyl hoá), tương tự như trong hệ trích ly NPHPLC và RPHPLC.
Kỹ thuật này rất thích hợp cho việc xử lý các loại mẫu để xác định các chất hữu cơ có nhiệt độ sôi thấp (dưới 150 oC) và dễ bay hơi trong các loại mẫu rắn, mẫu bùn, các mẫu bã thải và các mẫu khí. Nó có ưu điểm là chọn lọc cao, thích hợp cho các phương pháp phân tích HPLC, GC, hay GCMS, để xác định lượng nhỏ các chất hữu cơ, một số hợp chất cơ kim và một số chất vô cơ, như H2S, HCN, v.v.
Thiết bị và một số ví dụ
Thiết bị gồm có hai loại là các hệ đơn giản và hệ hoàn chỉnh tự động theo chương trình. Khí mang trơ ở đây là khí argon, hêli hay nitơ tính khiết (> 99,9%). Cụ thể thiết bị là gồm các bộ phận:
+ Hệ cột trích lykín và buồng cột trích lycó gia nhiệt được,
+ Khí trơ mang mẫu, cũng như hay He).
để rửa giải chất phân tích (Ar, N2,
+ Hệ máy bơm khí và nén khí mẫu vào cột trích ly.
♦ Ví dụ: Trích ly lấy một số hợp chất pesticide dễ bay hơi trong các loại nước hay mẫu rắn, bùn (Method 502.2b. EPA).
Cột hấp phụ là chất trích ly pha rắn loại LC225x1 cm. Mẫu được giữ ở 150oC và dòng khí trơ Argon thổi qua bình mẫu với tốc độ 0,81,0 mL/phút để đưa chất phân tích vào cột hấp phụ. Các chất phân tích sẽ được hấp phụ vào cột này. Sau đó cũng giải hấp các chất trong cột hấp phụ bằng dòng khí trơ đó nhưng ở 200oC, để dẫn vào máy GC/MS để tách và xác định các chất.
CÁC PHƯƠNG PHÁP XÁC ĐỊNH HÀM LƯƠNG NƯỚC TRONG THỰC PHẨM
1.11 GIỚI THIỆU CHUNG
Nước là thành phần vốn có ở hầu hết cơ thể sinh vật và chiếm khoảng 90% khối lượng tươi của một số nguyên liệu thực vật. Do đó, nước giữ vai trò quan trọng đối với sự sống nói chung và ngành công nghiệp thực phẩm nói riêng. Hàm lượng nước trong thực phẩm dao động khá rộng từ rất nhỏ trong các loại hạt ngũ cốc khô đến rất lớn ở các loại nguyên liệu tươi sống như rau, quả tươi. Dù không cung cấp năng lượng nhưng nước lại giữ vai trò ổn định cấu trúc đặc trưng cho mỗi sản phẩm thực phẩm. Nước vừa có thể đóng vai trò là môi trường phản ứng mà cũng vừa có thể là chất tham gia phản ứng xảy ra trong thực phẩm.
Nước không chỉ là một nguyên liệu quan trọng không thể thiếu của công nghiệp thực phẩm mà nước còn là yếu tố ảnh hưởng lớn đến tính chất của
nguyên liệu và sản phẩm thực phẩm. Dựa vào hàm lượng nước có thực phẩm mà người ta chia thực phẩm thành 3 nhóm:
trong
Thực phẩm có hàm lượng nước cao: hàm lượng nước chiếm hơn 40%.
Thực phẩm có hàm lượng nước trung bình: hàm lượng nước từ 10 – 40%
Thực phẩm có hàm lượng nước thấp: những thực phẩm có hàm lượng
nước nhỏ hơn 10%.
Trong các sản phẩm thực phẩm, nước tồn tại ở hai dạng là nước tự do và nước liên kết:
Nước ở dạng tự do: nước vẫn giữ được tính chất của nước nguyên chất.
Nước ở dạng liên kết được chia thành ba dạng tùy thuộc vào mức độ liên kết.
Nước liên kết hóa học: nước liên kết rất chặt chẽ với các
thành phần trong thực phẩm và rất khó để tách chúng ra khỏi tương tác hóa học này.
Nước liên kết hấp thụ: độ bền liên kết kém hơn trong liên kết hóa học và được hình thành do tương tác lưỡng cực của nước với các thành phần phân cực trong thực phẩm.
Nước liên kết mao quản: nước được hấp thụ bởi các phần tử ở bề mặt mao quản rồi di chuyển vào bên trong các mao quản.
Nước liên kết là nước tham gia liên kết với các phân tử khác bằng lực Vanderwal, liên kết hydro, liên kết ion… Khi nước ở dạng liên kết thì nước không còn những tính chất như nước tự do. Cụ thể, nước liên kết không
còn khả năng là dung môi hòa tan các chất khác, không đóng băng và khó
bốc hơi hơn nước tự do.
Xác định chính xác lượng nước có trong thực phẩm là điều quan trọng vì
nó ảnh hưởng quyết định đến hiệu quả
chế
biến, bảo quản những sản
phẩm này.
Hàm lượng nước được đánh giá thông qua độ ẩm hoặc hoạt độ nước. Có nhiều phương pháp xác định hàm lượng nước trong thực phẩm, dưới đây là một số phương pháp tiêu biểu:
Xác định độ ẩm
Phương pháp khối lượng
Phương pháp chuẩn độ Karl Fischer
Phương pháp xác định gián tiếp thông qua oBrix
Xác định hoạt độ nước
Phương pháp điểm sương
Phương pháp đường đẳng áp
1.12 MỘT SỐ PHƯƠNG PHÁP XÁC ĐỊNH HÀM LƯỢNG NƯỚC
1.12.1 Phương pháp khối lượng
Độ ẩm trong mẫu được xác định bằng cách xác định sự chênh lệch khối lượng mẫu trước và sau khi sấy trong thiết bị sấy thích hợp (tủ sấy đối lưu, sấy chân không hoặc microwave) và trong một thời gian sấy nhất định để hóa hơi hoàn toàn nước có trong mẫu.
Phương pháp khối lượng được sử
dụng đế
xác định độ ẩm còn được
gọi là phương pháp sấy đến khối lượng không đổi. Bởi phương pháp này sử dụng sự chênh lệch khối lượng của mẫu trước và sau khi sấy đến khối
lượng không đổi để
tính toán giá trị
độ ẩm. Chính vì sự
chênh lệch khối
lượng của mẫu được sử
dụng để
tính toán độ ẩm mà phương pháp này
được đánh giá là phương pháp không phản ánh chính xác lượng nước có trong mẫu. Điều này được lý giải như sau: thứ nhất là, không phải tất cả nước có mặt trong thực phẩm đều có thể bay hơi một cách dễ dàng khi tiến hành sấy mẫu mà chỉ có một phần nước tồn tại trong mẫu không bị bay hơi khi sấy. Chẳng hạn, nước liên kết khó có thể bay hơi hoàn toàn khỏi mẫu.
Lý do thứ
hai đó là tốc độ
của quá trình bay hơi nước sẽ
tăng nhanh khi
nhiệt độ sấy tăng. Tuy nhiên, thực phẩm là một tổ hợp của rất nhiều thành
phần nhạy cảm với nhiệt độ cao. Khi nhiệt độ sấy tăng lên đến hoặc cao
hơn 100°C thì những hợpc chất này có thể bị biến đổi thành những hợp
chất khác nhau. Lý do cuối cùng đó là không chỉ có nước mới bị hóa hơi khi bị xử lý nhiệt mà còn có một số những thành phần khác cũng hóa hơi khi nhiệt độ tăng. Mặc dù vậy, phương pháp khối lượng vẫn được lựa chọn là phương pháp chuẩn để xác định hàm ẩm.
Phương pháp này chỉ cần một lượng mẫu nhỏ đã được đồng nhất và có thể xác định chính xác độ ẩm trong khoảng từ 0,01% đến 99,99%. Sau đây, chúng tôi sẽ trình bày cách tiến hành xác định độ ẩm bằng thiết bị sấy đối lưu.
1.12.2 Phương pháp chuẩn độ KarlFischer
Không giống như
phương pháp khối lượng khi giả sử
tất cả
các chất
bay hơi được loại ra dẫn đến sự giảm khối lượng mẫu là nước, phương
pháp chuẩn độ Karl Fischer là phương pháp trực tiếp xác định hàm lượng nước. Phương pháp này đặc biệt thích hợp với mẫu có độ ẩm thấp (nhỏ hơn 1%) và có thể xác định hàm lượng ẩm ở mức 0,01%. Phương pháp Karl Fischer cũng thích hợp khi xác định hàm lượng nước của những mẫu có hàm lượng đường hay protein cao, mà không cần phải lo lắng về khả năng các chất này có thể phân hủy khi xác định hàm lượng nước như ở phương pháp khối lượng.
Bản chất của phương pháp là dựa vào sự
chuẩn độ
nước bằng dung
dịch methanol khan có chứa iod, SO2 và một lượng dư pyridine. Chuẩn độ dựa trên phản ứng giữa iod với SO2, phản ứng này chỉ xảy ra khi có sự hiện diện của nước theo phương trình: