Bảng 2.3. Môi trường, hóa chất sử dụng trong nghiên cứu
Môi trường, hóa chất | Hãng | |
1 | Canh thang Thioglycolate (FTM: Thioglycolate Fluid Medium) | Sigma |
2 | Môi trường MEM(Minimum Essential Medium) | Gibco |
3 | Dung dịch nhuộm cố địnhCrystal violet 5% | VABIOTECH |
4 | Huyết thanh bào thai bê(FBS) | Gibco-Thermo |
5 | Dung dịch Trypsin – EDTA | Gibco-Thermo |
6 | Dung dịch Hank's | VABIOTECH |
7 | Dung dịch Alserver | VABIOTECH |
8 | Dung dịch PBS, pH 7 | VABIOTECH |
9 | Thạch PPLO(pleuropneumonia-like organisms) | HiMedia |
10 | Canh thang PPLO | HiMedia |
11 | NaCl | Merck |
12 | Na2HPO4.12H2O | Merck |
13 | KH2PO4 | Merck |
14 | KCl | Merck |
15 | Tween 20 | Merck |
Có thể bạn quan tâm!
-
 Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào
Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào -
 Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1 -
 Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam
Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam -
 Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong
Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong -
 Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1
Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1 -
 Tính Ổn Định Hiệu Giá Chủng Gốcbv-Msv-0210 Và Chủng Sản Xuất Bv- Wsv-0310 Khi Bảo Quản Trong Nitrogen Lỏng
Tính Ổn Định Hiệu Giá Chủng Gốcbv-Msv-0210 Và Chủng Sản Xuất Bv- Wsv-0310 Khi Bảo Quản Trong Nitrogen Lỏng
Xem toàn bộ 178 trang tài liệu này.
Bảng 2. 4. Trang thiết bị, vật tư tiêu hao sử dụng trong nghiên cứu
Thiết bị | Hãng | |
1 | Máy đo nhiệt độ thỏ có độ chính xác 0,1oC | Ellab |
2 | Tủ nuôi cấy tế bào | JISICO |
3 | Tủ ấm(30-35oC) | MEMMERT |
4 | Tủ mát(20-25oC) | SANYO |
5 | Pipet tự động, bán tự động | DRUMMOND |
6 | Máy lắc | IKA |
7 | Kính hiển vi soi ngược | OLYMPUS |
8 | Hốt vô trùng | TELSTAR |
9 | Cân động vật(0-420g cho chuột nhắt; 0-2100g cho chuột lang) | SATORIUS |
10 | Máy ly tâm lạnh | BECKMAN |
11 | Nồi hấp vô trùng | HIRAYAMA |
12 | Máy ly tâm Eppendorf | EPPENDORF |
13 | Máy rửa bản ELISA | SANOFI |
14 | Máy đọc kết quả ELISA | SANOFI |
15 | Máy ủ 4 tấm Sanofi IPS | SANOFI |
16 | Máy khuấy từ MIDI MR1 | IKA |
17 | Máy đo pH Thermo | FNH |
18 | Hệ thống máy Real-time PCR CFX96TM | BioRad |
19 | Máy giải trình tự gen NGS | ThermoFisher |
20 | Máy ủ nhiệt khô MS0030 | BioRad |
21 | Cân phân tích (0,082-220g) XSR204 | Mettler toledo |
22 | Cân phân tích (sai số 4 chữ số) | Satorius, Đức |
23 | Máy đo tỷ trọng | Anton Paar (Đức) |
2.2.2. Động vật thí nghiệm
Bảng 2. 5. Trang thiết bị, vật tư tiêu hao sử dụng trong nghiên cứu
Giống | Trọng lượng | Số lượng | Giới tính | |
Chuột nhắt ổ 1-3 ngày tuổi | Swiss/ICR | / | 80 con | Đực và cái |
Chuột nhắt trắng 3 tuần tuổi | Swiss/ICR | 11-13 g | 600 con | Đực và cái |
Chuột nhắt trắng 4 tuần tuổi | Swiss/ICR | 17-22 g | 350 con | Đực và cái |
Chuột lang | Việt Nam | 250 – 450 g | 40 con | Đực và cái |
Thỏ | Newzealand | 1,8 – 2,5 kg | 60 con | Đực và cái |
2.3. Thiết kế nghiên cứu
Sơ đồ hình 2.2. Mô tả tóm tắt các thử nghiệm kiểm tra chất lượng chủng MSV, WSV và vắc xin JECEVAX. Nội dung được thực hiện trên 2 nhóm đối tượng nghiên cứu: Chủng vi rút VNNB được sản xuất gồm lô chủng gốc BV-MSV-0210 và lô chủng sản xuất BV-MSV-0310; 10 lô vắc xin Viêm não Nhật Bản JECEVAX.
BV-WSV-0310
Sản xuất từ 2010 đến 2018
Mycoplasma
Hiệu giá và ổn định về hiệu giá
Ổn định di truyền
Hình 2.2. Sơ đồ nghiên cứu
2.4. Biến số và nội dung nghiên cứu
Bảng 2. 6. Chỉ tiêu nghiên cứu trên lô chủng gốc BV-MSV-0210 và lô chủng sản xuất BV-WSV-0310
Chỉ tiêu | Phương pháp | Tiêu chuẩn viện dẫn | |
1 | Nhận dạng chủng MSV và WSV với kháng thể đặc hiệu | ELISA | TCCS; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
2 | Nhận dạng và xác định tính ổn định di truyền của chủng MSV và WSV | Giải trình tự gen | TCCS, DĐ TQ, WHO TRS 963 |
3 | Tương đồng nucleotide | Giải trình tự gen | TCCS, DĐ TQ, WHO TRS 963 |
4 | Tương đồng protein | Giải trình tự gen | TCCS, DĐ TQ, WHO TRS 963 |
5 | Hiệu giá vi rút trên tế bào | Tạo đám hoại tử PFU | TCCS, DĐVN V, 2017; Dược điển Châu Âu, 2018; WHO TRS 963 |
6 | Hiệu giá vi rút trên động vật thí nghiệm | Thử trên não chuột nhắt | TCCS, DĐVN V, 2017; Dược điển Châu Âu, 2018; WHO TRS 963 |
7 | Nhiệt độ bảo quản phù hợp | Hiệu giá chủng được kiểm tra sau khi bảo quản ở các dải nhiệt độ khác nhau, trong các khoảng thời gian khác nhau | TCCS, WHO TRS 963 |
8 | Vô trùng | Cấy trực tiếp trên môi trường Thioglycholate và soybean casein | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
9 | Kiểm tra nhiễm Mycoplasma | Cấy trên môi trường PPLO lỏng I, II, thạch PPLO | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
10 | Vi rút ngoại lai trên chuột nhắt | Thử trên chuột nhắt (tiêm não và phúc mạc) | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
11 | Vi rút ngoại lai trên chuột nhắt ổ | Thử trên chuột nhắt ổ (tiêm não và phúc mạc) | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
12 | Vi rút ngoại lai trên chuột lang | Thử trên chuột lang (tiêm phúc mạc) | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
13 | Vi rút ngoại lai trên tế bào | Tế bào Vero, BHK21, MRC5 | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
Bảng 2.7. Chỉ tiêu nghiên cứu trên vắc xin JECEVAX
Chỉ tiêu | Phương pháp | Tiêu chuẩn chấp nhận | Tiêu chuẩn viện dẫn | |
1 | Cảm quan | Quan sát bằng mắt thường | Dung dịch trong suốt, đồng nhất và không có vật thể lạ | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
2 | Thể tích | Cân và đo tỷ trọng | ≥ 1,0 ml | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
3 | pH | Máy đo pH | 6,8-7,4 | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
4 | Hàm lượng Thimerosal | Thuốc thử acetylacetone, đo OD, = 415nm (DĐVN IV, 2009, PL15.29) | ≤ 120 µg/ml | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
5 | Hàm lượng Formaldehyde | Thuốc thử Ditizon, đo OD, = 480 nm (DĐVN IV, 2009, PL15.25) | ≤ 10 µg/ml | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
6 | Hàm lượng DNA tồn dư | PCR/ phương pháp lai điểm | ≤ 10 ng/ml | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
7 | Hàm lượng protein tổng số | Lowry | ≤ 80 µg/ml | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
8 | Kiểm tra vô trùng | Cấy trực tiếp trên môi trường Thioglycholate và soybean casein (DĐVN IV, 2009, PL15.7) | Không có sự phát triển của vi khuẩn và nấm sau 14 ngày theo dõi | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
9 | An toàn chung | DĐVN IV, 2009, PL15.11 | Trong vòng 7 ngày theo dõi toàn bộ động vật thí nghiệm sống, khỏe mạnh, tăng cân và không có biểu hiện bệnh lý hoặc nhiễm độc | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
10 | Chất gây sốt | Tiêm tĩnh mạch tai thỏ, DĐVN V, 2009, PL 15.12 | Mẫu thử đạt yêu cầu về chất gây sốt nếu nhiệt độ chênh lệch của mỗi thỏ ≤ 0,60C và tổng nhiệt độ chênh lệch của 3 thỏ ≤ 1,30C | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
11 | Công hiệu | Phương pháp trung hòa giảm 50% đám hoại tử (PRNT50) | ≥ 1,3 log PRNT50/ml; hoặc công hiệu tương quan của vắc xin thử so với vắc xin mẫu chuẩn ≥ 1,0 | DĐVN V, 2017; DĐ Châu Âu, 2018; WHO TRS 963, PL1 |
2.5. Phương pháp nghiên cứu (chi tiết xem phụ lục 5)
2.5.1. Kiểm định vi rút ngoại lai
Kiểm định vi rút ngoại lai là một trong các tiêu chuẩn nhằm đảm bảo chất lượng của chủng vi rút sử dụng trong sản xuất vắc xin Viêm não Nhật Bản. Phương pháp kiểm định vi rút ngoại lai bao gồm kiểm định trên động vật thí nghiệm và trên tế bào.
Tế bào được dùng để kiểm định vi rút ngoại lai gồm nhiều dòng tế bào khác nhau: tế bào Vero, tế bào MRC5, BHK-21. Chủng vi rút Viêm não Nhật bản được trung hòa với kháng huyết thanh đặc hiệu và cấy 3 ml vào 5 chai tế bào thử nghiệm. Tế bào được nuôi cấy ở 36,5 0,5oC trong vòng 14 ngày. Trong quá trình nuôi cấy, chai tế bào được theo dõi đám hoại tử (CPE) dưới kính hiển vi soi ngược vào ngày thứ 1, 4, 7, 11 và 14.Sau 14 ngày theo dõi tình trạng phát triển của tế bào, nước nổi trong các chai tế bào được loại bỏ để kiểm tra vi rút hấp phụ hồng cầu. Chủng vi rút Viêm não Nhật Bản đạt yêu cầu kiểm định vi rút ngoại lai khi thử nghiệm không phát hiện tế bào bị hủy hoại (CPE) và không có vi rút hấp phụ hồng cầu.
Kiểm tra vi rút ngoại lai trên động vật thí nghiệm được thực hiện với 20 chuột nhắt trắng tiêm não, 10 chuột nhắt trắng tiêm phúc mạc, 20 chuột ổ 1-3 ngày tuổi tiêm não, 10 chuột ổ 1-3 ngày tuổi tiêm phúc mạc và 5 chuột lang tiêm phúc mạc. Chủng vi rút Viêm não Nhật Bản được trung hòa với kháng huyết thanh đặc hiệu trước khi tiêm cho động vật thử nghiệm và theo dõi tăng trưởng cân nặng, các dấu hiệu bệnh lý bất thường sau tiêm. Chủng vi rút Viêm não Nhật Bản đạt yêu cầu kiểm định vi rút ngoại lai thử nghiệm trên động vật khi:
Chuột nhắt: không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý sau 21 ngày theo dõi.
Chuột ổ: không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý sau 14 ngày theo dõi.
Chuột lang: không có chuột chết, 100% chuột sống khỏe mạnh, không có dấu hiệu bệnh lý, giải phẫu bệnh không thấy tổn thương phủ tạngsau 42 ngày theo dõi.
2.5.2. Kiểm định vô khuẩn
Kiểm định vô khuẩn được thực hiện nhằm đảm bảo chủng vi rút Viêm não Nhật Bản được sử dụng sản xuất vắc xin không nhiễm các tác nhân vi khuẩn hoặc nấm. Huyền dịch chủng vi rút Viêm não Nhật Bản được cấy trên môi trường Thioglycolate theo hướng dẫn của Dược điển Việt Nam 5, 2017. Môi trường Thioglycolate sau nuôi cấy được ủ ở nhiệt độ32,5±2,50C, và 22,5±2,50C trong thời gian 14 ngày. Môi trường sau nuôi cấy được theo dõi hàng ngày và ghi kết quả theo dõi vào phiếu theo dõi thử nghiệm vô khuẩn các ngày 1, 3, 5, 7, 10 và 14.
Chủng vi rút Viêm não Nhật Bản đạt yêu cầu vô khuẩn khi cả 2 loại môi trường đều trong, không bị vẩn đục, môi trường Thioglycolate không bị mất lớp chỉ thị màu ở phía trên.Chứng tỏ không có sự phát triển của vi khuẩn và nấm sau 14 ngày theo dõi.
2.5.3. Nhận dạng
Chủng gốc và chủng sản xuất vi rút Viêm não Nhật Bản sử dụng sản xuất vắc xin được kiểm định nhận dạng bằng kỹ thuật ELISA trực tiếp. Kỹ thuật dựa trên sự kết hợp đặc hiệu giữa kháng nguyên và kháng thể. Trong đó kháng thể IgG chuột kháng vi rút VNNB chủng Beijing-1 đã gắn vào phiến kết hợp với kháng nguyên vi rút VNNB trong mẫu thử. Sau đó cho cộng hợp IgG chuột kháng Beijing-1 gắn enzyme (peroxidase) sẽ tạo thành phức hợp kháng thể - kháng nguyên - cộng hợp. Thêm cơ chất OPD, enzyme peroxidase sẽ thủy phân cơ chất thành một chất có màu. Sự xuất hiện màu chứng tỏ đã xảy ra phản ứng đặc hiệu giữa kháng thể với kháng nguyên và thông qua cường độ màu mà biết được nồng độ kháng nguyên trong mẫu thử. Đo mật độ quang học (OD) trên máy đọc ELISA ở bước sóng = 490/620nm.
Các giá trị OD của mỗi mẫu thử và mẫu chuẩn được thể hiện bằng đồ thị logarit (xử lý số liệu trên Excel) với trục tung là độ pha loãng, trục hoành là các giá trị OD. Kết quả nhận dạng được xác định đảm bảo các yếu tố chứng âm và Blank không lên màu; mẫu thử và mẫu chuẩn phải có màu vàng và OD mẫu ≥ 10 lần OD Blank thì được coi là dương tính.
2.5.4. Đánh giá ổn định di truyền
Chủng gốc và chủng sản xuất vi rút Viêm não Nhật Bản sử dụng sản xuất vắc xin được đánh giá tính tương đồng về mặt di truyền bằng kỹ thuật giải trình tự gen.
Bộ gen được sử dụng trong kiểm định này là đoạn gen E bao gồm trình tự nucleotide của đoạn gen E và trình tự acid amin được tổng hợp từ gen này. Kết quả giải trình tự gen của các đợt đánh giá trên chủng gốc và chủng sản xuất vi rút Viêm não Nhật Bản được so sánh với kết quả giải trình tự gen ngay sau khi sản xuất của chính các chủng này, so sánh với chủng Beijing – Kanonji, so sánh với các chủng vi rút Viên não Nhật Bản phân lập được trên người, lợn và muỗi tại Việt Nam giai đoạn 1964 đến 2014.Quy trình giải trình tự gen E của chủng gốc và chủng sản xuất của vi rút Viêm não Nhật Bản trong nghiên cứu này được thực hiện như sơ đồ hình 2.2.
RNA tổng số được tách chiết và tinh chế từ mỗi mẫu nhờ QIAamp Viral RNA Mini Kit (Qiagen). Vùng gen E được khuếch đại bằng RT-PCR sử dụng bộ kit OneStep PCR Kit (Qiagen) với cặp mồi được thiết kế bằng chương trình Primer-Blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi) dựa trên trình tự gen E của vi rút Viêm não Nhật Bản. Cặp mồi có trình tự như sau::
JEV-E-p1: 5’-TTCAACTGTCTGGGAATGG-3’ (19 nu) JEV-E-p2: 5’-AGCATGCACATTGGTAGCTA-3’ (20 nu)
Với chương trình: bước 1 ở 50°C 30 phút, bước 2 ở 95°C 15 phút; lặp lại 30 chu kỳ (94°C trong 1 phút, 50°C trong 1 phút, 72°C trong 1 phút), bước 3 ở 72°C trong 10 phút và bước 4 giữ sản phẩm ở 4oC cho tới khi sử dụng. Vùng gen E được khuếch đại có độ dài tính theo lý thuyết là 1500 bp. Sản phẩm PCR được kiểm tra trên gen agarose 1%. Băng chứa sản phẩm PCR được thôi gel và tinh chế nhờ QIAquick PCR Purification Kit (Qiagen) để phục vụ cho việc giải trình tự. Giải trình tự gen được thực hiện với bộ Kit Applied Biosystems™ Sanger Sequencing Kit (Thermo Fisher) và máy giải trình tự gen ABI 3500 của Viện Công nghệ sinh học, Viện Hàn lâm KH&CN Việt Nam.
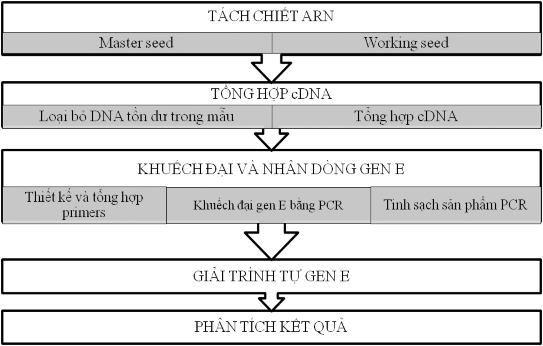
Hình 2. 3. Quy trình giải trình tự gen E vi rút Viêm não Nhật Bản
Trình được gen E được phân tích nhờ các phần mềm như Blast, CLC Generation Worbench, Aliview, BioEdit, MEGA6.0...để đánh giá mức độ tương đồng và xây dựng cây phả hệ dựa trên trình tự vùng gen E của 2 chủng Beijing-1 với chủng chuẩn và các chủng virus VNNB phân lập từ người, lợn và muỗi ở Việt Nam từ những năm 1964 đến năm 2014 (Bảng 2.7.). Phân tích epitope kháng nguyên vùng gen E được tiến hành theo phương pháp của Luca et al., (2012).