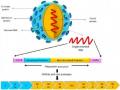
Việt Nam bắt đầu đưa vắc xin VNNB JEVAX vào chương trình tiêm chủng mở rộng quốc gia (TCMR QG) từ năm 1991 đến nay số ca nhiễm vi rút VNNB giảm đáng kể.
Bảng 1. 2. Tỷ lệ mắc VNNB ở bệnh nhân VNVR năm 1991-2019
Số mẫu xét nghiệm | Số mẫu (+) với VNNB | Tỷ lệ (+) VNNB (%) | |
1991-1995 | 2.373 | 1.454 | 61,3% |
1996-2000 | 1.285 | 599 | 46,6% |
2001-2005 | 2.880 | 1.129 | 39,2% |
2009 | 697 | 68 | 9,7% |
2010 | 1.075 | 140 | 13,0% |
2011 | 1.059 | 126 | 11,2% |
2012 | 1.846 | 183 | 9,9% |
2013 | 2.234 | 224 | 10,0% |
2014 | 2.275 | 421 | 18,5% |
2015 | 2.744 | 368 | 13,4% |
2016 | 3.230 | 357 | 11,0% |
2017 | 1.977 | 203 | 10,3% |
2018 | 3.125 | 313 | 10,0% |
2019 | 2.334 | 196 | 8,4% |
Có thể bạn quan tâm!
-
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 1 -
 Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 2
Nghiên cứu xây dựng tiêu chuẩn chất lượng vi rút Beijing-1 để ứng dụng sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam - 2 -
 Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản
Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản -
 Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1 -
 Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam
Tóm Tắt Quy Trình Thiết Lập Ngân Hàng Chủng (Beijing-1) Để Sản Xuất Vắc Xin Viêm Não Nhật Bản Bất Hoạt Trên Tế Bào Vero Tại Việt Nam -
 Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu
Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu
Xem toàn bộ 178 trang tài liệu này.

(Nguồn: TCMRQG trong báo cáo hội nghị TCMRQG 2020)
Qua bảng 1.2 để thấy rõ vai trò của vắc xin trong công tác phòng bệnh với vi rút VNNB của VN.
1.2.2. Sự phát triển của vắc xin Viêm não Nhật Bản trên tế bào
Trung Quốc là nước đầu tiên trên thế giới nghiên cứu sản xuất vắc xin trên tế bào, hiện nay Nhật Bản cũng đã nghiên cứu thành công công nghệ này.
Sau nhiều năm nghiên cứu, các tác giả Trung Quốc đã tạo được một chủng VNNB giảm độc lực SA 14-14-2. Chủng này nhân lên tốt trên tế bào PHK và được sử dụng để sản xuất vắc xin sống giảm độc lực. Trung Quốc đã gây miễn dịch cho lợn ở các trại chăn nuôi để hạn chế ổ dịch vi rút viêm não gần người. Ngày nay vắc
xin sống giảm độc lực trên tế bào PHK đã dùng cho người và thấy có khả năng bảo vệ gần 70%. Tuy nhiên về mặt an toàn thì còn phải được chứng minh đầy đủ[6].
Từ năm 1994, Viện sản xuất các chế phẩm sinh học Chengdu, Vũ Hán, Lanzhou bắt đầu ứng dụng công nghệ sản xuất vắc xin sống giảm độc lực trên tế bào PHK để sản xuất và đưa ra sử dụng ở một số nơi tại Trung Quốc[6].
Vắc xin bất hoạt được nuôi cấy trên tế bào thận chuột hamster tiên phát,đã sử dụng chủng Beijing -3 (P3) và được sản xuất tại Viện sản xuất các sản phẩm sinh học Bắc Kinh, Thượng Hải, Vũ Hán và Thành Đô. Đây là loại vắc xin rất an toàn nhưng hiệu quả bảo vệ thấp,chỉ đạt dưới70%[24, 26, 27].
Tại Việt Nam, từ thập kỷ 70, tác giả Đỗ Quang Hà cũng đã nghiên cứu sản xuất thử vắc xin VNNB từ tế bào thận lợn tiên phát, nhưng thử nghiệm thực địa không có đáp ứng miễn dịch.
Những năm cuối thập kỷ 90 của thế kỷ trước, nhiều nhà sản xuất trên thế giới đã nghiên cứusản xuấtvắc xin VNNB bất hoạt, tinh khiếttrên tế bào Vero như Aventis (Pháp), Biken (Nhật), Viện vắc xin và huyết thanh Bắc Kinh (Trung Quốc), Intercell (Áo) và Học viện nghiên cứu Y học quân sự Mỹ… bước đầu cho thấy vắc xin cótỷ lệ bảo vệ trên thực địa cao >80%. Hiện nay vắc xin VNNB bất hoạt trên tế bào Vero của Intercell đã chuyển giao công nghệ cho Novatis và được sử dụng tiêm chủng cho lính Mỹ và khách du lịch đến các vùng có dịch VNNB. Vắc xin VNNB bất hoạt trên tế bào Vero của Biken (Nhật Bản) đã có mặt trên thị trường quốc tế[5, 8, 21, 28]. Ở VN từ năm 2006, GS. Huỳnh Thị Phương Liên và cs (Vabiotech) bắt đầu nghiên cứu sản xuất vắc xin VNNB bất hoạt trên tế bào Vero dùng chủng Beijing-1 (vắc xin JECEVAX), đến năm 2020 vắc xin này đã xong thử nghiệm lâm sàng và đang hoàn thiện các thủ tục để đăng ký lưu hành [6, 29, 30].
Hướng nghiên cứu vắc xin VNNB tái tổ hợp cũng được nhiều nhà Khoa học rất quan tâm. Tuy nhiên, việc nghiên cứu dùng vi rút Pox, Varicella, Bacculovirus…làm vector vẫn chưa đạt được kết quả như mong muốn. Các nghiên cứu trên mới chỉ dừng lại ở phòng thí nghiệm vì hiệu quả rất thấp.Từ cuối những năm 1990, chủng SA 14-14-2 sống giảm độc lực còn được sử dụng để nghiên cứu phát
triển vắc xin mới bằng công nghệ DNA tái tổ hợp tạo ra 1 chủng vi rút Chimeric YF- JE bằng cách thay thế các gen prM và E của vi rút sốt vàng YFV 17D với các gen tương ứng của chủng SA 14-14-2 sống giảm độc lực của JEV[31, 32].
Vắc xin tái tổ hợp sống giảm độc lực sản xuất trên TB Vero (được gọi là ChimeriVax-JE) được đưa ra thị trường với một trong ba tên thương mại IMOJEV, JE-CV và THAIJEV. Hiệu quả bảo vệ có thể đạt từ 96-99% sau mũi 2. Hiện tại, vắc xin này đã được lưu hành ở 15 nước trên thế giới như: Úc, Hàn Quốc, Hồng Kông, Đài Loan, Philippin, Singapo, Malaysia, Thái Lan, Ấn Độ… [33].
Vắc xin sản xuất trên não chuột ổ tinh khiết mặc dù có hiệu lực bảo vệ cao, ổn định nhưng đòi hỏi nguồn nguyên liệu chuột phải sạch bệnh từ đó kéo theo một hệ thống chăn nuôi chuột và kiểm soát chất lượng rất phức tạp, tốn kém. Qui trình sản xuất bao gồm nhiều công đoạn từ sản xuất vắc xin thô đến tinh chế, lượng chất thải lớn, hệ thống nhà xưởng, trang thiết bị và nhân lực lớn, cồng kềnh, khó mở rộng qui mô sản xuất.Thêm vào đó, hiệu suất sản xuất không cao, chỉ đạt 4-5 liều vắc xin/1 não chuột nên sản lượng bị hạn chế.
Vắc xin sản xuất trên tế bào mặc dù hiệu quả bảo vệ có thấp hơn nhưng đã khắc phục được các nhược điểm của công nghệ sản xuất trên não chuột ổ. Điều đáng quan tâm hơn đó là công nghệ sản xuất vắc xin trên tế bào có thể mở rộng qui mô sản xuất một cách nhanh chóng, do đó có khả năng cung cấp sản lượng vắc xin lớn, giá thành rẻ và người dân dễ dàng tiếp cận vắc xin, nhất là trong các vụ dịch. Công nghệ tế bào cũng là công nghệ nền mở đường cho các công nghệ sản xuất hiện đại hơn như vắc xin tái tổ hợp, vắc xin vector, vắc xin DNA…trong tương lai.
1.2.3. Các biến thể di truyền và kháng nguyên trong vi rút VNNB và việc tiêm phòng[34]
Việc sử dụng chủng vi rút VNNB thuộc genotype III (GIII) để sản xuất vắc xin VNNB đến nay đã giúp thế giới đẩy lùi, giảm tỷ lệ bị mắc bệnh VNNB một cách đáng kể.
Tuy nhiên, trong 2 thập kỷ qua, việc thay thế chủng vi rút VNNB lưu hành trên người từ GIII bằng GI đã được quan sát thấy ở một số nơi[35, 36]. Một nghiên cứu gần đây ở người cho thấy hiệu quả trung hòa giảm đi đối với GI bằng các kháng
thể gây ra bởi JE-VAX (genotype III)[37]. Trong một nghiên cứu tương tự, đáp ứng miễn dịch thấp hơn so với các dòng GI và GIV, khi các đối tượng được tiêm vắc xin dựa trên GIII. Trong một nghiên cứu khác, chủng vi rút VNNB của GI đã được phân lập từ dịch não của một bệnh nhân đã được chủng ngừa với SA14-14-2 (GIII)[38]. Đây có thể là một thách thức lớn đối với việc chủng ngừa vì các vắc xin được cấp phép hiện nay đều dựa trên chủng GIII (Nakayama, Beijing-1, Beijing-3, và SA14- 14-2). Vấn đề trở nên phức tạp hơn như trong một số nghiên cứu còn cho thấy giảm khả năng kháng thể trung hòa đối với các dòng GIII khác nhau cũng đã được quan sát thấy khi các đối tượng được chủng ngừa với JE-VAX, SA14-14-2 và IC51[39, 40, 41, 42]. Cho nên việc tiếp tục nghiên cứu phát triển vắc xin này vẫn cần thiết và được nhiều nhà khoa học quan tâm.
1.2.4. Đánh giá chất lượng an toàn và tính sinh miễn dịch của vắc xin
Tính an toàn của vắc xin trên quy mô phòng thí nghiệm[22, 43]: Tính an toàn của vắc xin được kiểm soát qua các tiêu chuẩn về tính an toàn trên động vật thí nghiệm (thử chất gây sốt, an toàn chung, an toàn đặc hiệu), tính vô khuẩn và các đặc tính hóa lý của vắc xin. Tính an toàn của vắc xin được đánh giá qua các phản ứng tại chỗ như: Sốt, đau sưng, đau cơ, nổi ban … đến các biểu hiện nặng hơn như đau đầu, suất xuất huyết não, co giật, biếng ăn, ít vận động, tử vong… để kiểm soát hết các tính không an toàn (phản ứng phụ) này, chúng ta phải đánh giá qua 1 số thử nghiệm trên động vật (in vivo) và trong phong thí nghiệm (in vitro). Những thử nghiệm này đều là những thử nghiệm trong danh sách được tổ chức y tế thế giới (TCYTTG - WHO TRS 963) khuyến cáo phải thực hiện để đảm bảo tính an toàn cho vắc xin nói chung và vắc xin VNNB nói riêng. Toàn bộ quy trình thực hiện đều là các quy trình chuẩn theo dược điển đồng thời cũng được thẩm định bài bản trước khi tiến hành; người thực hiện đều được đào tạo bài bản, có thâm niên, kinh nghiệm cho từng thử nghiệm liên quan. Từng thử nghiệm cũng được phân về các khoa chuyên môn như thử nghiệm sinh học thì nhóm chuyên sâu về sinhhọc thực hiện; thử nghiệm hóa lý thì nhóm chuyên sâu về hóa lý thực hiện… nên kết quả thu được rất đáng tin cậy.
Tính an toàn trên động vật thí nghiệm:Ba loại động vật như chuột nhắt trắng, chuột lang& thỏ rất nhạy cảm và cũng là những động vật mà các nhà khoa học ngày
nay vẫn đang dùng thử nghiệm đánh giá tính an toàn của vắc xin, sinh phẩm và thuốc. Các động vật này tùy theo yêu cầu của thử nghiệm mà sử dụng đường tiêm, liều tiêm, loại động vật và có các tiêu chí đánh giá riêng.
Thử nghiệm kiểm tra chất gây sốt (pyrogens test) trên thỏ giúp ta kiểm soát các tác nhân có thể tạp nhiễm trong quá trình sản xuất vắc xin mà có thể gây sốt như: Nội độc tố của vi khuẩn Gram âm, vi khuẩn Gram dương, vi rút, nấm mốc, nấm men, các hạt bụi khác từ môi trường xung quanh.
Chọn thỏ vì thỏ là động vật rất nhậy cảm với nhiệt độ và chọn đường tĩnh mạch để quá trình phát hiện được nhanh, chuẩn xác nhất. Nếu vắc xin có tạp nhiễm hoặc tinh sạch không tốt, sau 3h tiêm, nhiệt độ của thỏ sẽ tăng > 1,3oC so với trước tiêm. Như vậy vắc xin sẽ không được phép sử dụng để tiêm cho người.
Thử nghiệm an toàn chung (hay an toàn không đặc hiệu) trên động vật: Chọn chuột nhắt trắng và chuột lang vì đây là 2 loại động vật rất nhậy cảm, giúp phát hiện nhanh khi vắc xin có các tạp nhiễm, chất tồn dư gây các phản ứng phụ không an toàn khác - trừ vi rút VNNB. Nếu chất tiêm (vắc xin) không an toàn, chuột sẽ xù lông, hóp bụng, nằm bẹp, ít vận động, ăn uống giảm sút dẫn đến giảm cân hoặc chết… Nên đây là một trong các thử nghiệm rất quan trọng để đảm bảo tính an toàn khi tiêm vắc xin trên người.
Vi khuẩn Gram âm, vi khuẩn Gram dương
Các tác nhân gây sốt
Vi rút, nấm mốc, nấm men
Hóa chất
Hình 1.2. Các tác nhân gây sốt
(https://bioprocessintl.com/analytical/downstream-validation/detecting-the-broad- spectrum-of-pyrogens-with-the-human-whole-blood-monocyte-activation-test/)
Thử nghiệm an toàn đặc hiệu trên động vật: Nếu quá trình bất hoạt vi rút chưa đạt tiêu chuẩn có thể dẫn đến các biểu hiện trên chuộtcác triệu chứng đặc trưng của
VNNB như liệt hoặc mù lòa, xù lông và nặng có thể chết. Nên đây cũng là một trong các chỉ tiêu rất được quan tâm và cần phải kiểm soát nghiêm ngặt để đảm bảo an toàn cho vắc xin khi sử dụng trên người.
Tính an toàn qua các chỉ tiêu lý-hóa tại phòng thí nghiệm
Cảm quan: Là đánh giá tính nguyên vẹn của ống mẫu (nhãn mác, sự nguyên vẹn của bao bì, trạng thái sản phẩm, màu sắc cũng như độ trong đục, vật thể lạ (nếu có)của vắc xin qua quan sát bằng mắt thường. Tùy theo thành phần của từng vắc xin mà tiêu chuẩn cảm quan sẽ là đặc trưng riêng. Chỉ tiêu này giúp chúng ta kiểm soát các tạp nhiễm hoặc dấu hiệu bất thường khác như tiêu chuẩn mô tả/đăng ký, nếu chỉ tiêu này không đạt thì không cần tiến hành các thử nghiệm khác và hủy không sử dụng vắc xin. Nên đây cũng là 1 trong các chỉ tiêu quan trọng và bắt buộc mà TCYTTG khuyến cáo cho vắc xin VNNB.
Thể tích đóng ống: Giúp kiểm soát lượng thể tích mẫu trong từng lọ vắc xin, đảm bảo đủliều tiêm như tiêu chuẩn đã đăng ký và đượcghi trên nhãn. Nếu không đủ là do phân liều hoặc đóng ống hoặc ống chứa bị lỗi dẫn đến thiếu hụt vắc xin trong lọ cũng không được dùng. Đây cũng là 1 trong các chỉ tiêu bắt buộc mà TCYTTG khuyến cáo cho vắc xin VNNB.
Vô trùng: Giúp kiểm soát tạp nhiễm về vi khuẩn và vi nấm (nếu có) trong vắc xin.Vắc xin kiểm tra không đạt vô trùng lô vắc xin phải hủy. Nên đây cũnglà 1 trong các chỉ tiêu bắt buộc mà TCYTTG khuyến cáo cho vắc xin VNNB và tất cảcác vắc xin khác.
Hàm lượng Thimerosal: Chất bảo quản giúp kéo dài hạn dùng cho vắc xin.Đây là chất có chứa thủy ngân nên hàm lượng sử dụng cần được kiểm soát chặt chẽ ở dạng vi lượng ≤ 120 µg/ml. Tuy nhiên khuyến cáo chung của TCYTTG hàm lượng nàycàng thấp càng tốt để các phản ứng quá mẫnkhông xảy ra.
Hàm lượng Formaldehyde: Đây là chất dùng để bất hoạt vi rút tồn dư, do đó cần được kiểm soát để không bị vượt quá giới hạn gây mất an toàn cho người dùng.TCYTTG cho phép tiêu chuẩn formaldehyde tồn dư của vắc xin bất hoạt là ≤ 10 µg/ml.
Hàm lượng Proteintổng số: Cần được kiểm soát để không bị vượt quá giới hạn gây phản ứng phụ, mất an toàn cho người dùng. Quy định của TCYTTG về hàm lượng protein tổng số cho vắc xin bất hoạt là ≤ 80 µg/ml.
DNA tồn dư: là DNA của tế bào nuôi cấy vi rút (Vero), việc kiểm soát hàm lượng DNA tồn dư là rất quan trọng và cần thiết để tránh quá trình sao chép, nhân bản DNA của tế bào này khi vào cơ thể người, gây nguy cơ đột biến gen hoặc ung thư….yêu cầu chung của TCYTTG về hàm lượng AND tồn dư trong vắc xin nuôi cấy tế bào là ≤ 10 ng/ml.
pH: là 1 chỉ số rất quan trọng để đánh giá tính ổn định của vắc xin. Mỗi vắc xin có một giới hạn cho pH để đảm bảo tính an toàn và hiệu quả cho vắc xin đến hạn sử dụng. Với vắc xin VNNB tiêu chuẩn pH thường từ 6,8-7,4.
Tính sinh miễn dịchcủa vắc xin trên quy mô phòng thí nghiệm[22, 43]
Đây là một chỉ số quan trọng nhất đánh giá hiệu quả bảo vệ của vắc xin, trong chuyên ngành gọi là thử nghiệm công hiệu.Nếucông hiệucủa vắc xin không đạt tức tính sinh miễn dịch ở quy mô phòng thí nghiệm của vắc xin không đạtthì vắc xin không được cấp phép đưa vào sử dụng.Công hiệu có công hiệuin vivo (đánh giá tính sinh miễn dịch hoặc hiệu quả tạo kháng thể đặc hiệu đối với chính vi rút/bệnh đó) và công hiệuin vitro (định lượng hàm lượng kháng nguyên đủ để tạo đáp ứng miễn dịch).Trong giai đoạn nghiên cứu phát triển vắc xin, tính sinh miễn dịch trên động vật là một thử nghiệm được quan trọng vì cần có đủ hàm lượng kháng nguyên là tạo được kháng thể bảo vệ như mong muốn ...Với vắc xin VNNB bất hoạt, thử nghiệm công hiệu chuẩn thức theo khuyến cáo của TCYTTG (WHO TRS 962) vẫn là đánh giá tính sinh miễn dịch trên chuột.
Đánh giá tính sinh miễn dịch trên động vật thí nghiệm được tiến hành đồng thời với vắc xin mẫu chuẩn: Pha vắc xin thử và mẫu chuẩn, gây miễn dịch, lấy máu tim, tách huyết thanh, xử lý huyết thanh vàđánh giáHGKTTHbằngphương pháp trung hòa giảm 50% đám hoại tử (PRNT50).
Theo quy định của TCYTTG thì HGKTTH giữa mẫu vắc xin thử nghiệm/mẫu chuẩn phải ≥ 1 là đạt yêu cầu. Một số nhà sản xuất chưa có vắc xin mẫu chuẩn, công
hiệu của vắc xin đạt yêu cầu khi HGKTTH≥ 1,5 log. Vắc xin Jevac (Biken, Nhật ) chỉ cần HGKTTH của vắc xin ≥1,3 log là đạt yêu cầu.
1.3. Chủng vi rút sản xuất vắc xin Viên não Nhật Bản
1.3.1. Chủng vi rút Nakayama-NIH
Nhật Bản là nước đầu tiên phân lập được vi rút VNNB năm 1935 từ một em bé bị VNNB, đặt tên chủng là Nakayama. Nhật Bản cũng là nước đầu tiên sản xuất vắc xin phòng bệnh VNNB, chủng Nakayama được chọn làm chủng sản xuất vắc xin trong số các chủng phân lập được ở Nhật Bản[13, 20].
Tác giả Aizawa và cs., Han và cs. đã chứng minh đáp ứng kháng thể khác nhau giữa chủng Nakayama-NIH và nhiều chủng khác bằng kỹ thuật trung hòa giảm đám hoại tử (PRNT). Từ đó đã chọn được 5 chủng: Nakayama-NIH, Nakayama Yokken, JaGar-01, Yokoshiba (YS) và T8 để sản xuất vắc xin.
Hai chủng Nakayama-NIH và Nakayama Yokken có nguồn gốc như nhau. Ở Nhật Bản dùng chủng Nakayama-NIH để sản xuất vắc xin cho người và chủng Nakayama Yokken sản xuất vắc xin cho động vật. Nhiều tác giả đã chứng minh rằng chủng Nakayama-NIH đạt được tất cả các tiêu chuẩn để sản xuất vắc xin và ở Nhật Bản. Từ năm 1989, 2 chủng Nakayama-NIH và chủng Beijing-1 được sử dụng đồng thời để sản xuất vắc xin phục vụ nhu cầu trong nước và xuất khẩu theo yêu cầu đặt hang [44].Ngoài Nhật Bản, chủng Nakayama đã được một số nước chọn để sản xuất vắc xin cho người như Hàn Quốc, Thái Lan, Việt Nam…
1.3.2. Chủng vi rút Beijing-1
Chủng Beijing-1 được phân lập từ người năm 1949 ở Bắc Kinh, Trung Quốc.Tại Trung Quốc, chủng Beijing-1 được cấy truyền 70 đời và đạt được tất cả các tiêu chuẩn như chủng Nakayama nên được sử dụng để sản xuất vắc xin trong nhiều năm qua. Nhật Bản bắt đầu sử dụng chủng Beijing-1cùng với chủng Nakayama –NIH để sản xuất vắc xin VNNB cho nhu cầu trong nước và xuất khẩu từ năm1989[45, 46].
Các công trình nghiên cứu của Kurane và Takasaki dựa trên kết quả của các nghiên cứu, thử nghiệm khác nhau cho thấy đáp ứng miễn dịch của vắc xin VNNB sản xuất từ hai chủng Nakayama và Beijing-1 đềuđạt được 94% sau 3 mũi tiêm. Các nghiên