có bệnh lý (chuột sạch, được kiểm soát chặt chẽ) và được cấp phép bởi cơ quan kiểm định quốc gia có thẩm quyền.
Đặc biệt tại vùng, bộ phận lấy tế bào phải được kiểm tra cẩn thận các dấu hiệu bệnh lý; quy trình sản xuất tế bào cũng phải đảm bảo các tiêu chuẩn về an toàn, chất lượng, GMP đủ tiêu chuẩn cho sản xuất và được phê chuẩn bởi cơ quan quốc gia có thẩm quyền.
Tế bào PHK:Tế bào từ mô thận chuột Hamster khi sử dụng phải được kiểm tra để đảm bảo các tiêu chuẩn về vô trùng, các tác nhân vi rút ngoại lai, độ sống của tế bào (%), Mycoplasma… và được phê chuẩn bởi cơ quan quốc gia có thẩm quyền.
Tế bào thường trực
Nếu dòng tế bào thường trực được sử dụng để sản xuất vắc xin VNNB thì ngân hàng tế bào gốc (MCB) và ngân hàng tế bào sản xuất (WCB) phải được kiểm soát và phải đáp ứng các tiêu chuẩn có nguồn gốc từ động vật sử dụng cho sản xuất các chế phẩm sinh học dùng cho người.
MCB và WCB phải nằm trong đời cấy chuyển tối đa cho phép, đồng thời phải kiểm tra: Mycoplasma, vô trùng, tác nhân ngoại lai, khả năng sinh khối u trên động vật, độ sống, độ ổn định về di truyền (đặc tính sinh hóa, miễn dịch, di truyền…), phải được phê chuẩn, cấp phép bởi cơ quan kiểm định quốc gia có thẩm quyền.
Môi trường sử dụng trong sản xuất vắc xin VNNB
Các loại môi trường nuôi cấy sử dụng (MEM/TCM199/…): Phải là các loại môi trường chuyên dụng, có chứng nhận chất lượng đầy đủ từ nhà sản xuất (nếu là các loại môi trường thương mại), còn các môi trường do nhà sản xuất tự nghiên cứu sản xuất thì phải đảm bảo đầy đủ các tiêu chuẩn quy định cho các hóa chất cho sản xuất các chế phẩm sinh học sử dụng cho người.
Huyết thanh, trypsin nếu được sử dụng trong nuôi cấy tế bào phải được kiểm tra để đảm bảo về vô trùng, Mycoplasma và tác nhân/vi rút ngoại lai trước khi đưa vào sử dụng.
Huyết thanh người không nên sử dụng nhưng Albumin huyết thanh người có thể được sử dụng nhưng phải đáp ứng đầy đủ các tiêu chuẩn cho các sản phẩm từ máu dùng cho người…
Kháng sinh: Không nên sử dụng Penicillin và các beta-lactams khác vìchúng rất nhậy cảm với vi rút và lượng tồn dư có thể xảy ra phản vệ cho người sử dụng vắc xin. Các kháng sinh khác có thể sử dụng trong quá trình sản xuất nhưng phải kiểm soát được sự ảnh hưởng, hàm lượng tồn dư trong giới hạn an toàn của sản phẩm cuối cùng.
Các cơ chất khác cũng có thể được sử dụng nhưng hàm lượng phải được kiểm soát trong giới hạn an toàn trong sản phẩm cuối cùng. Ví dụ các chỉ thị pH không độc (Phenol đỏ thì hàm lượng ≤ 0,002%).
Thành phần, hàm lượng các chất bổ sung vào môi trường nuôi cấy nhân vi rút đều phải được thẩm định hoặc dựa trên các nghiên cứu đã được thẩm định.
Chủng vi rút
Chủng vi rút sử dụng để sản xuất vắc xin VNNB bất hoạt phải là những chủng đảm bảo các tiêu chuẩn về thuần khiết, an toàn và hiệu quả trên lâm sàng khi đã bất hoạt; các tiêu chuẩn cho chủng sản xuất vắc xin cho người phải được phê chuẩn bởi cơ quan kiểm định quốc gia có thẩm quyền.
Hệ thống chủng vi rút gồm: Chủng gốc (Master seed lots) và chủng sản xuất (Working seed lots). Chủng phải có hồ sơ, lý lịch đầy đủ:
Tên chủng;
Nguồn gốc;
Số lượng (ống);
Hiệu giá;
Ngày sản xuất (thiết lập); ngày có hiệu lực. Lô/loạt;
Điều kiện bảo quản(*).
(*): Chủng đông khô có thể bảo quản ở ≤ -20oC; chủng đông băng thì bảo quản ở ≤ -60oC.
Chủng gốc và chủng sản xuất phải được kiểm tra từng tiêu chuẩn chất lượng quy định, phải đạt các tiêu chuẩn cơ sở và được phê chuẩn bởi cơ quan kiểm định quốc gia có thẩm quyền. Các tiêu chuẩn chất lượng cần được kiểm soát đối với chủng gốc và chủng sản xuất:
Nhận dạng: Để đảm bảo chủng vi rút trước sản xuất đúng là chủng (kháng nguyên) VNNB đăng ký để sản xuất vắc xin. Nhận dạng chủng thường được kiểm tra bằng phương pháp PCR hoặc ELISA hoặc một phương pháp hóa miễn dịch phù hợp được phê chuẩn.
Kiểm tra nấm, vi khuẩn, Mycoplasmab: thường được kiểm tra bằng phương pháp nuôi cấy trực tiếp và/hoặc PCR. Chủng phải đạt yêu cầu không nhiễm nấm, vi khuẩn, Mycoplasma.
Tác nhân ngoại lai: Kiểm tra trên động vật và tế bào theo theo đúng hướng dẫn của WHO và quy trình chung trong dược điển. Chủng sản xuất cần đạt yêu cầu loại trừ tác nhân ngoại lai.
Kiểm tra hiệu giá vi rút:
Hiệu giá của vi rút thường được kiểm tra bằng phương pháp gây nhiễm trên tế bào hoặc gây nhiễm trên não chuột. Tùy theo công nghệ sản xuất và loại chủng vi rút VNNB mà mỗi nhà sản xuất cần đưa ra hiệu giá phù hợp cho lô chủng của mình để đảm bảo tính ổn định trong sản xuất và năng suất sản xuất của vắc xin sau này.
1.5. Tóm tắt quy trình thiết lập ngân hàng chủng (Beijing-1) để sản xuất vắc xin viêm não Nhật Bản bất hoạt trên tế bào Vero tại Việt Nam
Quá trình thiết lập các ngân hàng chủng cho sản xuất vắc xin VNNB bất hoạt trên tế bào Vero, chủng Beijing-1 (JECEVAX) được tiến hành qua các giai đoạn sau:
Giai đoạn 1: Nghiên cứu thiết lập hệ thống ngân hàng chủng cùng với việc xây dựng quy trình sản xuất vắc xin VNNB bất hoạt trên tế bào Vero (năm 2006 -2012 - Đề tài cấp Bộ Y tế):
+ Từ năm 2006-2010: Nghiên cứu thích ứng chủng vi rút Beijing-1 trên tế bào Vero để tạo chủng vi rút đủ điều kiện cho phát triển và sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại Vabiotech
+ Từ tháng 4/2010: bắt đầu thiết lập chủng gốc và chủng sản xuất để sản xuất thử nghiệm các loạt vắc xin nhằm xây dựng quy trình sản xuất vắc xin VNNB bất hoạt trên tế bào Vero tại VABIOTECH.
Giai đoạn 2: Sử dụng hệ thống chủng đã được thiết lập sản xuất các loạt vắc xin cho các nghiên cứu thử nghiệm lâm sàng giai đoạn I, II, IIB & III tại Việt Nam (Năm 2013-2018 - Đề tài cấp Nhà nước); kiểm tra đánh giá tính ổn định của chủng beijing-1 và vắc xin JECEVAX sau sản xuất ở quy mô phòng thí nghiệm.
Giai đoạn 3: Tổng hợp các dữ liệu đã có để hoàn thiện, xây dựng tiêu chuẩn chất lượng cho ngân hàng chủng sản xuất, vắc xin.
Ngân hàng chủng vi rút là một phần quan trọng của quá trình sản xuất một sản phẩm sinh học nói chung và vắc xin nói riêng. Việc thiết lập Ngân hàng chủng vi rút đảm bảo nguyên liệu liên tục cho sản xuất vắc xin là cần thiết. Cụ thể, trong nghiên cứu này, chủng Beijing-1 được nhận từ viện Kanonji thuộc Trường đại học Osaka, Nhật Bản cũng đã qua 41 đời cấy chuyển (P41) để tạo chủng an toàn, hiệu quả. Beijing-1 cũng đang được sử dụng để sản xuất các vắc xin VNNB ở Nhật Bản. Về Việt Nam, chủng Beijing-1 P41 chúng tôi coi đó là P0, tính đến 2020 đã qua thêm 7 đời cấy chuyển (tương ứng với P48 từ chủng gốc), đời đầu tiên (P1) kích ứng trên não chuột, các đời tiếp theo nhân lên trên tế bào Vero như hình 1.6.
Cấy chuyển 1 lần trên não chuột |
Có thể bạn quan tâm!
-
 Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản
Dịch Tễ Học Phân Tử Của Vi Rút Viêm Não Nhật Bản -
 Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào
Sự Phát Triển Của Vắc Xin Viêm Não Nhật Bản Trên Tế Bào -
 Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1
Một Số Vắc Xin Vnnb Sản Xuất Từ Chủng Beijing-1 -
 Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu
Trang Thiết Bị, Vật Tư Tiêu Hao Sử Dụng Trong Nghiên Cứu -
 Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong
Thông Tin Về Trình Tự Vùng Gen E Của Các Chủng Vi Rút Vnnb Phân Lập Ở Việt Nam Trong Các Năm Khác Nhau Và Từ Các Vật Chủ Khác Nhau Sử Dụng Trong -
 Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1
Tính Ổn Định Về Hiệu Giá Và Di Truyền Của Chủng Beijing-1
Xem toàn bộ 178 trang tài liệu này.
Cấy chuyển 1 lần trên tế bào Vero |
1 ml/tuýp, Hiệu giá 1,75 .107PFU/ml | Cấy chuyển trên tế bào Vero |
Cấy chuyển trên tế bào Vero |
Cấy chuyển trên tế bào Vero |
1 ml/tuýp, Hiệu giá 1,4 .107PFU/ml | Cấy chuyển trên tế bào Vero |
Cấy chuyển trên tế bào Vero |
1 ml/tuýp, Hiệu giá 3,93 . 107 PFU/ml | Bảo quản nitrogen lỏng |
Chủng chuẩn gốc P0 (41)
Chủng P1 (42)
Chủng P3 (44)
Chủng P4 (45)
Chủng P6 (47) (Chủng gốc BV-MSV-0210)
Hình 1. 6. Sơ đồ thiết lập ngân hàng chủng gốc (BV-MSV-0210) và chủng sản xuất (BV-WSV-0310)
"P": Passage, đời cấy chuyển.
Như vậy, tại thời điểm nghiên cứu năm 2017, số đời cấy chuyển của lô chủng gốc BV-MSV-0210 là 6 lần (tương ứng với đời số P47 tính từ chủng chuẩn gốc Beijing-1 Kanonji) và số đời cấy chuyển của lô chủng sản xuất BV-WSV-0310 là 7 (tương ứng với đời số P48 tính từ chủng chuẩn gốc Beijing-1 Kanonji).
Sau khi các nghiên cứu thích ứng chủng và xây dựng được các ngân hàng chủng và chủng sản xuất cho sản xuất vắc xin, một việc rất quan trọng cần được tiến hành đó là xây dựng tiêu chuẩn chất lượng và các phương pháp kiểm tra chất lượng chủng. Điều này sẽ giúp cho nhà sản xuất khẳng định chất lượng hệ thống chủng sử
dụng trong sản xuất vắc xin từ đó khẳng định được chất lượng của vắc xin sản xuất ra. Các nghiên cứu nhằm xây dựng tiêu chuẩn chất lượng và các phương pháp kiểm tra chất lượng cũng như các đánh giá về tính ổn định hiệu giá và di truyền của chủng qua các đời cấy chuyển sẽ giúp nhà sản xuất hoàn thiện các hồ sơ về sản phẩm để sử dụng trong việc phê duyệt thử nghiệm lâm sàng, đăng ký lưu hành sản phẩm, kiểm tra chất lượng và xuất xưởng cho sử dụng sản phẩm. Các nghiên cứu xây dựng tiêu chuẩn chất lượng và các phương pháp kiểm tra chất lượng chủng được tiến hành độc lập sau khi đã thiết lập được hệ thống chủng và được tiến hành theo các phương pháp hồi cứu, tiến cứu hoặc kiểm chứng lại các kết quả đã công bố để khẳng định chất lượng từ đó xây dựng lên các tiêu chuẩn chất lượng theo quy định đối với các ngân hàng chủng cho sản xuất vắc xin VNNB bất hoạt trên tế bào Vero.
CHƯƠNG 2
ĐỐI TƯỢNG, VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Mẫu và cỡ mẫu: Chủng vi rút Viêm não Nhật bản(Beijing-1, nguồn gốc từ Viện Kanonji thuộc Trường đại học Osaka, Nhật Bản)
- Lô chủng gốc (BV-MSV-0210).
- Lô chủng sản xuất (BV-WSV-0310).
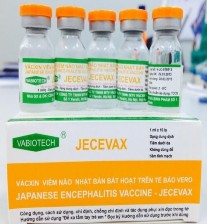
Vắc xin Viêm não Nhật Bản:Vắc xin JECEVAX(vắc xin bất hoạt trên tế bào Vero, chủng Beijing-1 do Vabiotech sản xuất)
Bảng 2.1. Cỡ mẫu sử dụng trong nghiên cứu
Tên mẫu | Thời gian sản xuất | Số lượng (lọ) | |
1 | Lô chủng gốc (BV-MSV-0210) | 2/2010 | 30 |
2 | Lô chủng sản xuất (BV-WSV-0310) | 3/2010 | 50 |
3 | 10 lô vắc xin JECEVAX | ||
3.1 | J-VC0110 (1 ml/lọ) | 2010 | 85 |
3.2 | J-VC0210 (1 ml/lọ) | 2010 | 85 |
3.3 | J-VC0310 (1 ml/lọ) | 2010 | 85 |
3.4 | J-VC010313 (1 ml/lọ) | 2013 | 85 |
3.5 | J-VC020713 (1 ml/lọ) | 2013 | 85 |
3.6 | J-VC030713 (1 ml/lọ) | 2013 | 85 |
3.7 | J-VC040713 (1 ml/lọ) | 2013 | 85 |
3.8 | J-VC031114 (1 ml/lọ) | 2014 | 85 |
3.9 | J-VC010416 (1 ml/lọ) | 2016 | 85 |
3.10 | J-VC010818 (1 ml/lọ) | 2018 | 85 |
|
|
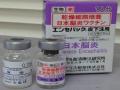
Hình 2.1. Hình ảnh ống chủng Beijing-1 và vắc xin JECEVAX
Địa điểm nghiên cứu:
- Phòng thí nghiệm, QC, QM của công ty VABIOTECH.
- Phòng thí nghiệm của Khoa VR Viện Vệ sinh dịch tễ trung ương (NIHE);
- Phòng thí nghiệm Vi sinh vật học phân tử - Viện Công nghệ sinh học.
- Phòng thí nghiệm của Khoa KĐVX Vi rút, NICVB
2.2. Vật liệu nghiên cứu
2.2.1. Sinh phẩm, hóa chất, thiết bị
Bảng 2. 2. Sinh phẩm sử dụng trong nghiên cứu
Sinh phẩm | Hãng/nguồn gốc | |
1 | Chủng gốc Beijing-1 | Beijing-1, nguồn gốc từ Viện Kanonji thuộc Trường đại học Osaka, Nhật Bản |
2 | Chủng Nakayama | Vabiotech |
3 | Ngân hàng tế bào Vero | Vabiotech (mua từ ATCC) |
4 | Ngân hàng tế bào BHK21 | Vabiotech(mua từ ATCC) |
5 | Ngân hàng tế bào MRC5 | Vabiotech(mua từ ATCC) |
6 | Kháng huyết thanh VNNBsản xuất từ chuột Swiss | Vabiotech |
7 | Sinh phẩm ELISA-Ag | Vabiotech |
8 | Bộ sinh phẩm QIAamp®Viral RNA mini | Qiagen |
9 | Bộ sinh phẩm Super ScripTM one-step with Platium taq | Invitrogen |
10 | Bộ sinh phẩm BigDye® Terminator v3.1 Cycle Sequencing | ABI |
11 | L48961.1/Beijing-1/CHN/1949 | NCBI |